盐雾胁迫对极小种群植物日本荚蒾光合生理的影响
徐千瑞, 顾嘉诚, 李贺鹏, 王珺, 房瑶瑶, 朱弘, 岳春雷*
盐雾胁迫对极小种群植物日本荚蒾光合生理的影响
徐千瑞1,2, 顾嘉诚1, 李贺鹏2, 王珺2, 房瑶瑶2, 朱弘2, 岳春雷2*
(1.浙江农林大学林业与生物技术学院,杭州 311300;2.浙江省林业科学研究院,杭州 310023)
为评价日本荚蒾()的耐盐雾能力,对4 a生实生苗用不同盐雾浓度处理(盐雾NaCl质量浓度分别为0%、1%、2%、3%),测定叶片净光合速率、最大光化学效率(Fv/Fm)和叶绿素含量(Chl)等指标的变化。结果表明,1%盐雾处理的日本荚蒾植株能够存活,但生长不良,大于2%的盐雾处理的植株全部死亡。随着浓度的升高,日本荚蒾叶片的最大光合速率、Fv/Fm及Chl含量下降,而光饱和点及光补偿点总体呈上升趋势。这说明盐雾胁迫通过伤害光系统II反应中心、改变植物可利用光能范围及降低叶绿素含量影响植物的光合作用。
日本荚蒾;盐雾胁迫;耐盐性;光合特性
沿海大气中弥散着大量盐雾。盐雾在重力和风的共同作用下黏附于植物表面,会造成植物的生理脱水、变色乃至死亡[1],这在一定程度上抑制沿岸植物的繁殖能力,也会影响植物分布[2]。植物的生长过程中光合作用是最重要的生理过程之一,也是影响植物生产力的关键因素[3]。研究表明,盐雾沉降作用下叶片细胞结构会被破坏,植物的光合作用受到抑制,植物不能获得足够营养,导致无法正常生长[4–6]。因此,研究植物光合作用对盐雾胁迫的响应,对于评价植物耐盐雾能力,筛选耐盐雾植物建设沿海防护林具有重要意义。
日本荚蒾()为常绿灌木,叶片革质深绿,白花簇状,熟果鲜红,具有较高的观赏价值[7]。野生日本荚蒾仅分布在海岛上,最早记录在日本本州、九州等海岛[8–9],在我国仅生长于浙江省台州市及舟山市的部分海岛,植株数量极少,已被列入浙江省重点保护野生植物名录(第一批)和浙江省极小种群拯救保护物种[10–13]。对日本荚蒾的研究主要集中在从叶片提取生物活性化合物方面[8,14],近年来,为探究日本荚蒾分布区狭窄、种群数量稀少的原因,还开展了遗传多样性研究[15]; 从水分和光照开展了生理生态学研究,探明其抗旱性和耐阴性机理[16–17]。由于日本荚蒾自然分布于海岛,其生长发育必然受到盐胁迫。但目前尚未有关于其耐盐性的报道。在植物耐盐性研究方面,大多数学者致力于植物根系受到盐胁迫的研究,而对盐雾胁迫下叶片的响应研究较少[18]。因此,研究盐雾胁迫下日本荚蒾的光合生理特性,探讨其对盐雾环境的适应能力和响应机理,可以深入了解日本荚蒾对盐雾胁迫的抗性,为极小种群植物日本荚蒾的树种保护和迁地引种提供科学依据。
1 材料和方法
1.1 试验材料
日本荚蒾()植株为临海市林业技术推广总站提供的4 a生实生苗。植株生长旺盛、长势一致,株高约50 cm。选择下口直径16 cm、上口直径21.3 cm、高20 cm的塑料盆钵进行盆栽试验,每盆放入挖于苗圃的熟土5 kg,土壤有机质、速效氮、速效磷、速效钾含量分别为27.43、0.175、70.50、20.57 g/kg,每盆栽1株。
1.2 试验设计
于2021年5月,将日本荚蒾植株移入温室大棚内缓苗,期间进行正常养护。缓苗1个月后,于2021年6月1日开始试验。根据海岛盐雾浓度约为3%的水平[19],设置盐雾NaCl的质量浓度分别为0% (CK)、1%、2%和3%,用盐雾溶液对叶片进行处理,每处理5个重复。使用造雾喷瓶将NaCl溶液以喷雾的形式呈水平方向均匀喷洒于叶片表面,每株植物每天16:30喷洒50 mL,连续喷洒40 d。植株经过盐雾处理后,每10 d测定1次叶片各项指标。
1.3 方法
土壤理化性质测定 土壤有机质含量的测定采用重铬酸钾容量法,速效氮的测定采用碱解扩散法,速效磷的测定采用碳酸氢钠法,速效钾的测定采用醋酸铵-火焰光度计法[20]。
生长观察 每天观察并记录植株的生长状况及形态变化,并根据盐害症状对划分盐害等级, 0级为无盐害症状;1级为少量叶片的叶尖、叶缘或脉部变黄,属于轻度盐害;2级为半数叶片的叶尖、叶缘焦枯,属于中度盐害;3级为绝大部分叶片的叶尖、叶缘焦枯,并有落叶现象,属于重度盐害; 4级为枝条干枯,叶片脱落,植株死亡,属于极重度盐害。
光合-光响应测定 每处理随机选择3株植株,选取生长较好的枝条中上部成熟叶片,每株1片。采用光合测量仪(Li-6400,Lincoln,USA)于上午8:30— 11:30,通过红蓝光源(6400-02B RedBlue)设置光合有效辐射(PAR),依次为2 000、1 500、1 200、1 000、800、600、400、300、200、150、100、50、0mol/(m2·s),测量叶片的净光合速率(Pn),绘制光响应曲线并将其与直角双曲线修正模型()=[(1-)/(1-)]-拟合,式中,()为Pn;为光响应曲线初始斜率;为修正系数;为光合有效辐射(PAR);c为暗呼吸速率(Rd),获得相应的光响应特征参数[21]。
叶绿素荧光参数的测定 在测量净光合速率的同时,使用标准荧光叶室测定叶片的叶绿素荧光参数。测量数据之前,对选定的叶片经过30 min的暗反应后,利用荧光叶室测定初始荧光(Fo)、最大荧光(Fm)和最大光化学效率(Fv/Fm)。
叶绿素含量的测定 用80%丙酮浸提法测定叶片的叶绿素(Chl)含量。每处理随机选择3株植株,每株选取正常枝条的中上部成熟叶片2~3片, 将采集到的叶片进行编号并装入冰桶带回。叶片处理干净后剪成小块放入试管,加入含丙酮及80%丙酮的Chl提取液,混合后放于暗处浸提过夜,浸提的过程中摇晃试管3~4次。浸提结束后,用紫外分光光度计测出处理后的Chl提取液在波长为663和645 nm处的吸光值,Chl浓度=20.29×A645+8.05× A663; Chl含量(mg/g FW)=(×V)/(FW×1000),式中,为叶绿素浓度(mg/L); FW为样品鲜质量(g);V为提取液总体积(mL)。
1.4 数据处理
本文采用SPSS 23.0软件对实验数据进行单因素方差分析,运用LSD法进行显著性分析和多重比较,使用Origin 2018绘制图形。
2结果和分析
2.1 盐雾胁迫对生长的影响
试验期间,CK植株能正常生长,无明显变化(图1)。1%盐雾处理的日本荚蒾全部存活,但处理20 d时部分叶片的叶缘开始干枯,30 d时部分叶片大面积干枯,40 d时半数以上叶片脱落,达3级盐害。2%盐雾处理植株10 d部分叶片叶缘干枯,20 d时有1/3叶片完全变褐色,30 d时仅剩极少部分叶片保持绿色,40 d全部植株死亡,达4级盐害。3%盐雾处理的植株5 d就出现盐害症状,10 d时1/3叶片失绿,20 d部分植株死亡,25 d全部植株死亡,达4级盐害。这表明日本荚蒾在盐雾NaCl浓度大于2%的环境中无法存活。
2.2 盐雾胁迫对光合速率的影响
日本荚蒾叶片的Pn随盐雾NaCl浓度的升高而下降,且盐雾处理的Pn随胁迫时间的延长与CK的差距越来越大(图2)。试验初期(10 d),1%盐雾处理植株叶片的光响应曲线与CK呈现相似的变化趋势,且各PAR下的Pn值相差较小,而2%和3%盐雾处理的Pn与CK相比大幅下降,胁迫反应明显。胁迫处理20 d后,盐雾处理的植株叶片Pn均下降,1%盐雾处理的Pn与CK差距明显加大, 2%盐雾处理的Pn趋于0,3%盐雾处理的Pn小于0,植株趋于死亡。胁迫处理30 d时,1%和2%盐雾处理的Pn继续下降,2%盐雾处理的Pn降至0以下,3%盐雾处理的植株全部死亡;胁迫持续40 d后,1%盐雾处理的Pn继续下降,2%盐雾处理的植株死亡。

图1 日本荚蒾在不同浓度盐雾处理下的生长情况。CK: 对照。下同
2.3 盐雾胁迫对光响应特征参数的影响
从表1可见,盐雾胁迫相同时间,最大净光合速率(Pnmax)随盐雾NaCl浓度的升高持续下降,且盐雾处理的Pnmax均显著小于CK (<0.05);暗呼吸速率(Rd)在胁迫过程中无明显变化;光饱和点(LSP)均随盐雾NaCl浓度的升高而增大,且处理间的差异显著(<0.05)。除试验初期(10 d)外,其他胁迫时间植物的光补偿点(LCP)均随盐雾NaCl浓度的升高而显著增大(<0.05)。
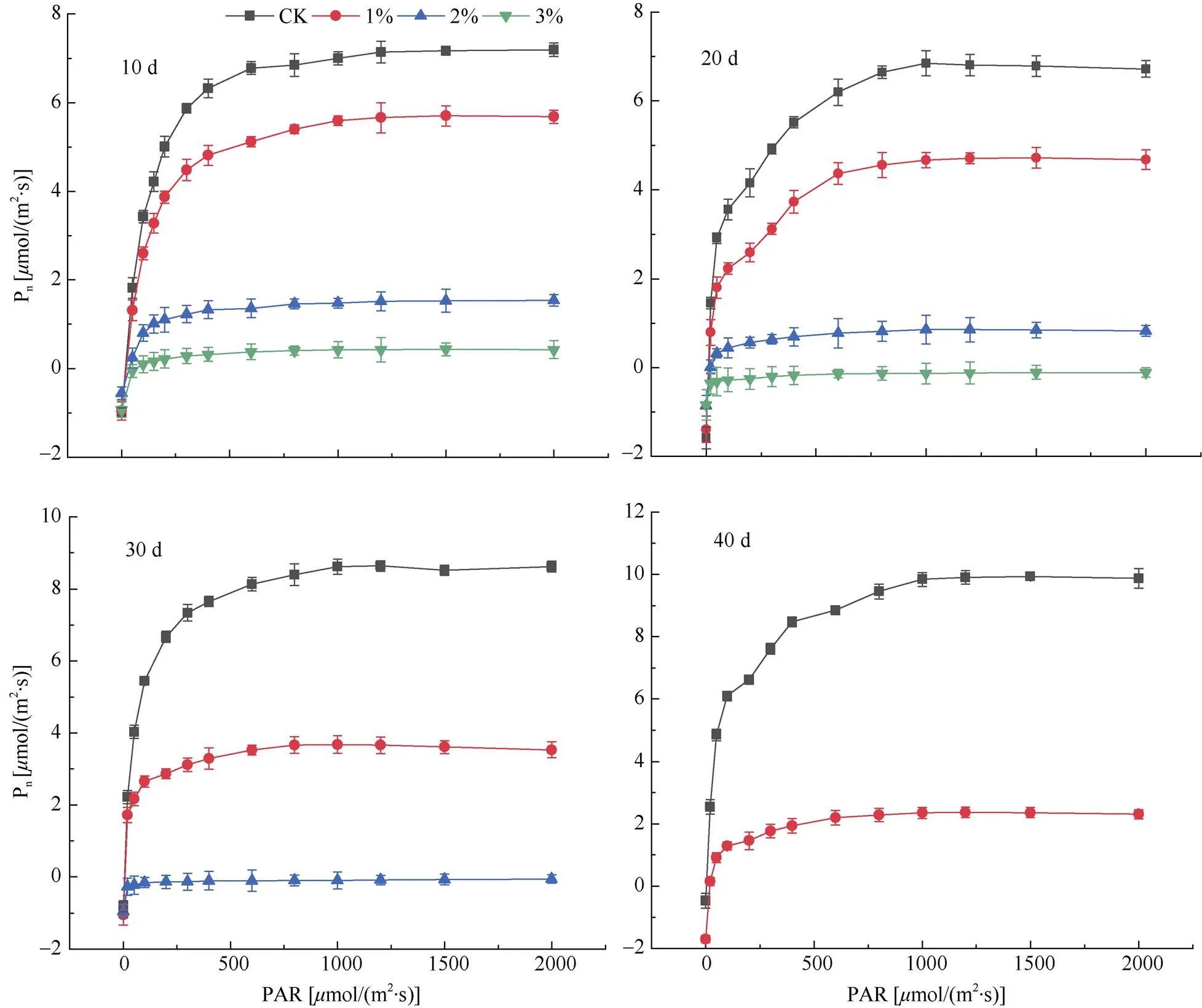
图2 日本荚蒾在不同浓度盐雾处理下的光合-光响应曲线。Pn: 净光合速率; PAR: 光合有效辐射。
2.4 盐雾胁迫对叶绿素荧光参数的影响
Fv/Fm与盐雾NaCl浓度和胁迫持续时间成反比(图3)。胁迫10 d,CK、1%和2%盐雾处理的Fv/Fm无显著差异(>0.05),而3%盐雾处理的低于0.75, 与其他处理的差异显著(<0.05);胁迫20 d时,2%盐雾处理的Fv/Fm明显下降,降至0.748,与CK的差异显著(<0.05),而3%盐雾处理的为0.627,胁迫效应显著;1%盐雾处理30 d的Fv/Fm与CK的差异显著(<0.05),但仍维持在较高水平。可见,中高浓度盐雾环境(盐雾NaCl浓度大于2%)会使Fv/Fm显著下降,而低浓度盐雾环境(小于1%)在胁迫初期对Fv/Fm无显著影响,后期有较小影响。
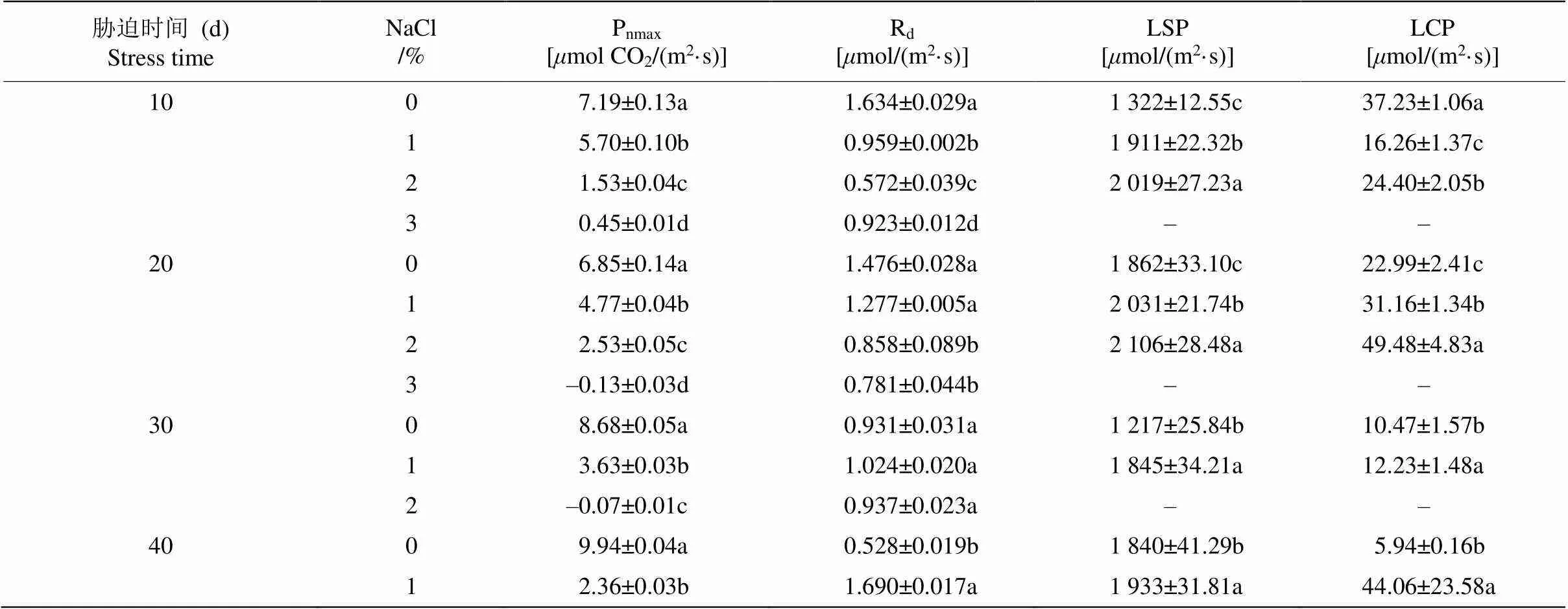
表1 不同浓度盐雾处理下日本荚蒾叶片的光合生理参数
Pnmax: 最大净光合速率; Rd: 暗呼吸速率; LSP: 光饱和点; LCP: 光补偿点。相同时间的同列数据后不同字母表示差异显著(<0.05)。
Pnmax: Maximum net photosynthetic rate; Rd: Dark respiration rate; LSP: Saturation point; LCP: Light compensation point; CK: Control. Data followed different letters within column treated the same time indicated significant differences at 0.05 level.
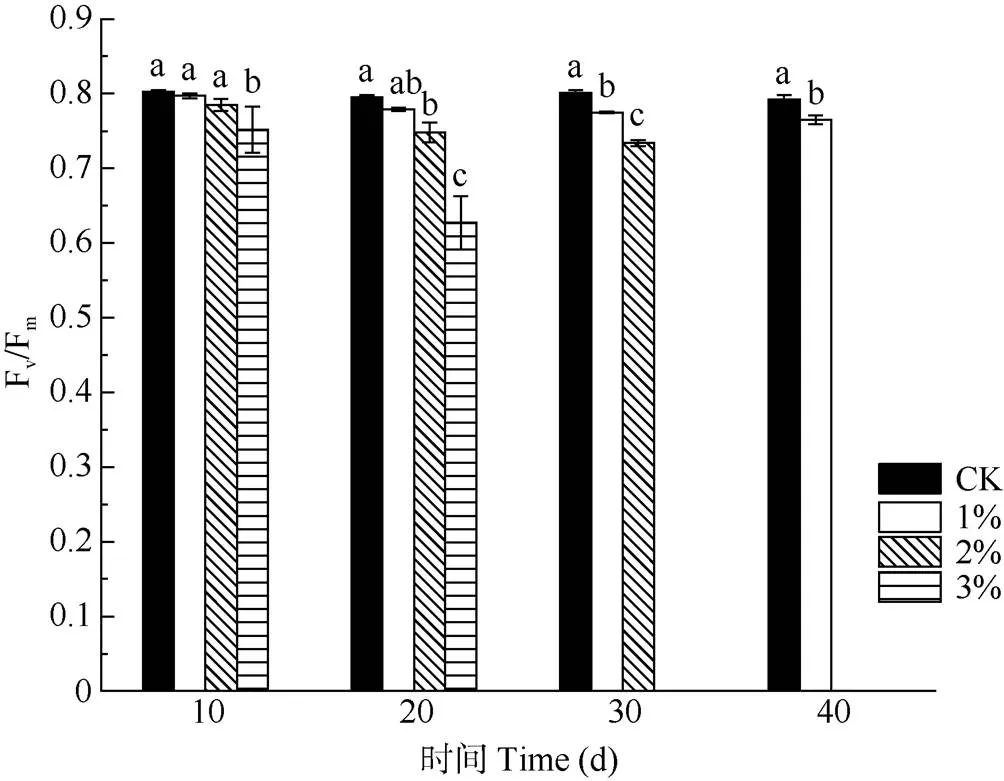
图3 不同浓度盐雾处理下日本荚蒾叶片的最大光化学效率。Fv/Fm: 最大光化学效率。柱上不同字母表示差异显著(P<0.05)。下同
2.5 盐雾胁迫对叶绿素含量的影响
日本荚蒾叶片的Chl含量随盐雾NaCl浓度的升高而下降(图4)。1%盐雾处理10 d的Chl含量与CK差异不显著(>0.05),处理20 d后与CK的差异显著(<0.05),其他处理的Chl含量均显著小于CK (<0.05)。盐雾处理的Chl含量均随胁迫时间的延长而降低。
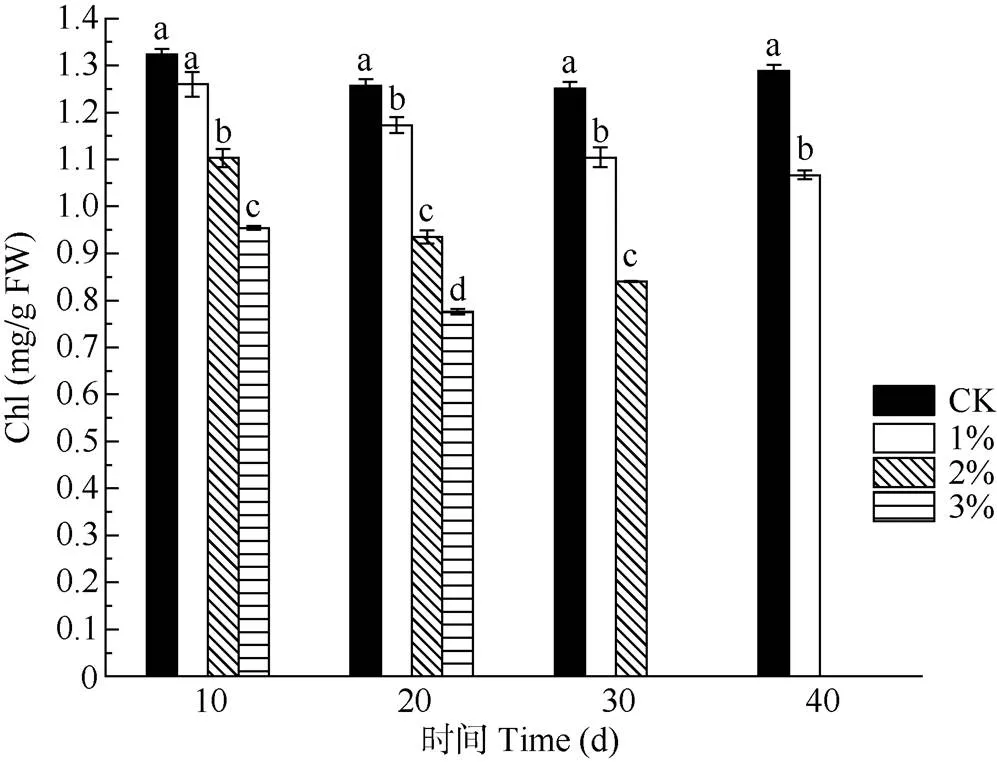
图4 不同浓度盐雾处理下日本荚蒾叶片叶绿素含量的变化。Chl: 叶绿素含量。
3 结论和讨论
盐雾胁迫会通过影响植物的光合作用及生理活动,破坏植物的形态特征,影响植物的生长[22]。在本试验中,CK的日本荚蒾生长旺盛,长势较好;1%盐雾处理植株在胁迫初期生长无明显变化,随胁迫时间的延长逐渐出现叶片发黄、干枯甚至脱落等现象,但植株仍能全部存活;2%盐雾处理组植株从10 d时就产生了胁迫反应,40 d时死亡;3%处理组的植株在试验初期就表现出较明显的受害症状, 30 d时植株全部死亡。以上现象说明日本荚蒾在盐雾浓度较高的胁迫环境中无法存活。由此推测,日本荚蒾可以在海岛上生存,并不是因为该植物具有较强的耐盐雾能力,而是由于其是生长在林中层的灌木或小乔木,在野外大多零星分布于海岛山坡林、杂木林下,上层植物在盐雾沉降过程中为日本荚蒾起到了遮挡作用,只有少部分盐雾会落到其叶片上,导致该植物在生长过程中受到盐雾胁迫的影响较小。
植物叶片的Pnmax与植物光合能力成正比[23]。本试验中,Pnmax与盐雾NaCl浓度成反比,说明盐雾胁迫会削弱植物的光合作用能力;LSP可以判断植物利用强光的能力,两者具有正相关性[25]。日本荚蒾的LSP随盐雾NaCl浓度的升高不断增大,说明其在盐雾胁迫下利用强光的能力得到进一步提高; 植株利用弱光的能力可以根据LCP来判断,两者呈负相关[24],1%与2%盐雾处理10 d的LCP均小于CK,即在试验初期,受到轻中度盐雾胁迫的日本荚蒾植株利用弱光的能力增强,而盐雾处理20 d后, LCP均随胁迫程度的增强而增大,即利用弱光的能力降低。综合分析LSP及LCP,在盐雾胁迫初期, 受到轻中度胁迫的日本荚蒾对光能的利用能力增强, 即对盐雾胁迫产生一定的抗性;而随胁迫的持续进行,其利用强光的能力逐渐增强,而利用弱光的能力不断下降,即在盐雾环境中,植株可利用的光能范围发生了变化,不断向强光区偏移[25],使光合作用受到影响,对植物的生长十分不利。植物的光合作用遭到抑制后,PSII最先受到影响,因此探究PSII的变化可以了解胁迫对植物光合作用能力的影响[26]。叶绿素荧光是反映植物光合作用情况的探针, 有利于深入探究盐雾胁迫下植物光合作用的内在特性[14–15], 了解植物受伤害的机理[27]。Fv/Fm代表PSII反应中心的光能转换效率[28],在正常环境下,植物叶片的Fv/Fm一般维持在0.75~0.85且变化较小[29]; CK与1%盐雾处理的Fv/Fm均高于0.75, 说明在轻度盐雾胁迫下,植物PSII反应中心几乎没有受到损伤。而2%处理10 d的Fv/Fm与CK差异不显著(> 0.05),胁迫20 d后降至0.75以下且与CK差异显著(0.05),说明在中度盐雾胁迫的初期, 日本荚蒾受到的影响较小,随着胁迫时间的延长, 盐害程度不断加深。3%盐雾处理的Fv/Fm在10 d时为0.75,20 d时降至0.627,说明日本荚蒾在3%盐雾环境中,植物的PSII反应中心遭到破坏,植物无法正常生长。这与束靖等[30]对盐胁迫下樱桃(spp)幼苗的研究结果一致,NaCl会使植物叶片发生光抑制,从而影响植物的光合作用。
Chl含量是反映植物光合能力的指标,可衡量植物的耐盐雾性[31]。盐胁迫会通过破坏叶绿体结构及提高叶绿素酶活性降低植物体内的Chl含量,进而影响植物的光合作用[32]。在本试验中,日本荚蒾叶片中的Chl含量与盐雾NaCl浓度及胁迫时间成反比,说明盐雾胁迫通过降低叶肉细胞内的Chl含量,影响植物吸收及传递光能的过程,进而削弱植物的光合能力。陈顺伟等[33]研究了杜英()等树种的耐盐雾性,认为盐雾胁迫会导致植物叶片不同程度的失绿、变黄,即造成叶绿素含量下降,这与本试验结论一致。
综上所述,日本荚蒾耐盐雾能力并不强。在盐雾NaCl质量浓度小于1%的环境中,日本荚蒾会通过维持PSII反应中心正常工作,保证光合作用的正常进行。当达到2%及以上时,叶片的叶绿素含量降低,可利用光能范围变窄,导致植物对光能的利用能力减弱。同时,PSII反应中心遭到较大程度的破坏,植物的光合作用受到严重抑制,对光合产物的消耗远大于积累,植物无法正常生长。野生日本荚蒾仅生长于海岛,易受到海风侵蚀,而海岛环境中盐雾NaCl质量浓度大约为3%[19],由此推测日本荚蒾耐盐雾能力弱是其分布区狭窄、数量稀少的原因之一。因此,在栽培日本荚蒾时,应选择盐雾NaCl浓度较低的环境,或者将其与其他乔灌木搭配种植,形成植物屏障,降低盐雾在日本荚蒾上的沉降量,以确保植物能够正常生长。然而,本研究仍存在一定局限性,在设置盐分梯度时,各处理的浓度差距较大,导致无法得出更精准的结果;试验周期较短,应适当延长试验时间,进行长期观测,以得出更具说服力的结论。
[1] WANG W Q, CHEN Q. Salt-Tolerant Plant Resources from Coastal Areas of South China, Vol. 1 [M]. Xiamen: Xiamen University Press, 2013: 8. [王文卿, 陈琼. 南方滨海耐盐植物资源(一) [M]. 厦门: 厦门大学出版社, 2013: 8.]
[2] TESTER M, DAVENPORT R. Na+tolerance and Na+transport in higher plants [J]. Ann Bot, 2003, 91(5): 503–527. doi: 10.1093/aob/ mcg058.
[3] WANG Y P, GAO H H, LIU Y S, et al. Adaptation mechanisms of alpine plants photosynthetic apparatus against adverse stress: A review [J]. Chin J Appl Ecol, 2013, 24(7): 2049–2055. [王玉萍, 高会会, 刘悦善, 等. 高山植物光合机构耐受胁迫的适应机制 [J]. 应用生态学报, 2013, 24(7): 2049–2055. doi: 10.13287/j.1001-9332.2013.0441.]
[4] GRIFFITHS M E. Salt spray and edaphic factors maintain dwarf stature and community composition in coastal sandplain heathlands [J]. Plant Ecol, 2006, 186(1): 69–86. doi: 10.1007/s11258-006-9113-8.
[5] OGURA A, YURA H. Effects of sandblasting and salt spray on inland plants transplanted to coastal sand dunes [J]. Ecol Res, 2008, 23(1): 107–112. doi: 10.1007/s11284-007-0347-2.
[6] GRIFFITHS M E, ORIANS C M. Salt spray effects on forest suc- cession in rare coastal sandplain heathlands: Evidence from field surveys andtransplant experiments [J]. J Torrey Bot Soc, 2004, 131(1): 23–31. doi: 10.2307/4126925.
[7] LI R J, YUE C L, LI H P, et al. Effects of drought stress on the physiological and biochemical characteristics ofseedlings [J]. J NW For Univ, 2018, 33(2): 56–61. [李瑞姣, 岳春雷, 李贺鹏, 等. 干旱胁迫对日本荚蒾幼苗生理生化特性的影响 [J]. 西北林学院学报, 2018, 33(2): 56–61. doi: 10.3969/j.issn.1001-7461. 2018.02.09.]
[8] IWAGAWA T, HASE T. An iridoid acetylalloside from[J]. Phytochemistry, 1986, 25(5): 1227–1229. doi: 10.1016/ S0031-9422(00)81587-3.
[9] KERN J H. The genus(Caprifoliaceae) in Malaysia [J]. Reinwardtia, 2015, 1(2): 107–170.
[10] QIU P L, CHEN Z H, ZHANG X H. Some newly recorded taxa to China and the Chinese mainland from Zhejiang Province [J]. Acta Bot Yunnan, 1994, 16(3): 231–234. [裘宝林, 陈征海, 张晓华. 见于浙江的中国及中国大陆新记录植物 [J]. 云南植物研究, 1994, 16(3): 231–234.]
[11] GUO L, SUN H P, CHEN X Z, et al. Study on the flora of offshore islands in Taizhou city of Zhejiang Province [J]. J Zhejiang Univ (Agric Life Sci), 1999, 25(4): 368–372. [郭亮, 孙海平, 陈献志, 等. 浙江省台州市海岛植物区系的研究 [J]. 浙江大学学报(农业与生命科学版), 1999, 25(4): 368–332.]
[12] ZHU H, GE B J, YE X Y. Seed plant flora of Dongfushan Island in Zhoushan, Zhejiang Province [J]. J Zhejiang Agric For Univ, 2015, 32(1): 150–155. [朱弘, 葛斌杰, 叶喜阳. 浙江舟山东福山岛种子植物区系初探 [J]. 浙江农林大学学报, 2015, 32(1): 150–155. doi: 10. 11833/j.issn.2095-0756.2015.01.022.]
[13] GAO H J, WANG G M, YU Q J. Distribution characteristics and species diversity of seed plants in Zhoushan, Zhejiang [J]. Plant Sci J, 2015, 33(1): 61–71. [高浩杰, 王国明, 郁庆君. 舟山市种子植物物种多样性及其分布特征 [J]. 植物科学学报, 2015, 33(1): 61–71. doi: 10.11913/PSJ.2095-0837.2015.10061.]
[14] OHIGASHI H, KOSHIMIZU K. Chavicol, as a larva-growth inhibitor, fromspreng [J]. Agric Biol Chem, 1976, 40(11): 2283–2287. doi: 10.1080/00021369.1976.10862375.
[15] JIANG M, YING M H, XU L N, et al. The genetic diversity assessment of a rare plantby ISSR [J]. J Zhejiang Univ (Sci), 2021, 48(1): 100–106. [蒋明, 应梦豪, 徐丽娜, 等. 珍稀植物日本荚蒾遗传多样性的ISSR分析 [J]. 浙江大学学报(理学版), 2021, 48(1): 100–106. doi: 10.3785/j.issn.1008-9497.2021.01.014.]
[16] LI R J, CHEN X Z, YUE C L, et al. Effects of drought stress on the photosynthetic characteristics ofseedlings [J]. Acta Ecol Sin, 2018, 38(6): 2041–2047. [李瑞姣, 陈献志, 岳春雷, 等. 干旱胁迫对日本荚蒾幼苗光合生理特性的影响 [J]. 生态学报, 2018, 38(6): 2041–2047. doi: 10.5846/stxb201702240306.]
[17] XIA Y F, LI R J, YANG Z J, et al. Effect of light intensity on growth and physiological characteristics ofseedlings [J]. J Zhejiang For Sci Technol, 2020, 40(3): 16–21. [夏云飞, 李瑞娇, 杨在娟, 等. 光照强度对日本荚蒾幼苗生长和生理特性的影响 [J]. 浙江林业科技, 2020, 40(3): 16–21.]
[18] BIAN A N, LIN M, WANG W Q. Effects of salt spray on growth and compartmental allocation of mineral element ofseedlings [J]. Ecol Environ Sci, 2014, 23(11): 1752–1758. [卞阿娜, 林鸣, 王文卿. 盐雾胁迫对榄仁幼苗生长及体内矿质元素分布的影响 [J]. 生态环境学报, 2014, 23(11): 1752–1758. doi: 10.3969/j.issn. 1674-5906.2014.11.005.]
[19] XU G B. The content and distribution of salt spray in the coastal atmosphere of my country [J]. Environ Technol, 1994(3): 1–7. [徐国葆.我国沿海大气中盐雾含量与分布 [J]. 环境技术, 1994(3): 1–7.]
[20] Nanjing Institute of Soil Science, Chinese Academy of Sciences. Analysis of Soil Physical Chemical Feature [M]. Shanghai: Shanghai Scientific & Technical Publishers, 1978: 112–114. [中国科学院南京土壤研究所. 土壤理化分析 [M]. 上海: 上海科学技术出版社, 1978: 112–114.]
[21] YE Z P. A new model for relationship between irradiance and the rate of photosynthesis in[J]. Photosynthetica, 2007, 45(4): 637–640. doi: 10.1007/s11099-007-0110-5.
[22] WANG Q Z, LIU Q, GAO Y N, et al. Review on the mechanisms of the response to salinity-alkalinity stress in plants [J]. Acta Ecol Sin, 2017, 37(16): 5565–5577. [王佺珍, 刘倩, 高娅妮, 等. 植物对盐碱胁迫的响应机制研究进展 [J]. 生态学报, 2017, 37(16): 5565–5577. doi: 10.5846/stxb201605160941.]
[23] WATLING J R, PRESS M C, QUICK W P. Elevated CO2induces biochemical and ultrastructure changes in leaves of the C4cereal sorghum [J]. Plant Physiol, 2000, 123(3): 1143–1152. doi: 10.1104/pp. 123.3.1143.
[24] WU W M, LI Z J, LUO Q H, et al. Effects of soil water stress on light response curves of photosynthesis ofand[J]. Sci Silv Sin, 2007, 43(5): 30–35. [伍维模, 李志军, 罗青红, 等. 土壤水分胁迫对胡杨、灰叶胡杨光合作用-光响应特性的影响 [J]. 林业科学, 2007, 43(5): 30–35. doi: 10.3321/j.issn:1001-7488. 2007.05.005.]
[25] HAN G, ZHAO Z. Light response characteristics of photosynthesis of four xerophilous shrubs under different soil moistures [J]. Acta Ecol Sin, 2010, 30(15): 4019–4026. [韩刚, 赵忠. 不同土壤水分下4种沙生灌木的光合光响应特性 [J]. 生态学报, 2010, 30(15): 4019–4026.]
[26] RAPACZ M. Chlorophyll a fluorescence transient during freezing and recovery in winter wheat [J]. Photosynthetica, 2007, 45(3): 409–418. doi: 10.1007/s11099-007-0069-2.
[27] MURCHIE E H, LAWSON T. Chlorophyll fluorescence analysis: A guide to good practice and understanding some new applications [J]. J Exp Bot, 2013, 64(13): 3983–3998. doi: 10.1093/jxb/ert208.
[28] FANG Y R, XUE L. Research advances in the effect of salt stress on plant chlorophyll fluorescence [J]. Ecol Sci, 2019, 38(3): 225–234. [方怡然, 薛立. 盐胁迫对植物叶绿素荧光影响的研究进展 [J]. 生态科学, 2019, 38(3): 225–234. doi: 10.14108/j.cnki.1008-8873.2019.03.028.]
[29] XU D Q, ZHANG Y Z, ZHANG R X. Photoinhibition of photo- synthesis in plants [J]. Plant Physiol Commun, 1992, 28(4): 237–243. [许大全, 张玉忠, 张荣铣. 植物光合作用的光抑制 [J]. 植物生理学通讯, 1992, 28(4): 237–243. doi: 10.13592/j.cnki.ppj.1992.04.001.]
[30] SHU J, LIU S H, ZHANG A H, et al. Effects of NaCl stress on photosynthetic characteristics, chlorophyll fluorescence and osmotic adjustment substances of cherry seedlings in greenhouse [J]. J Shanxi Agric Sci, 2021, 49(7): 834–838. [束靖, 刘素慧, 张爱花, 等. NaCl胁迫对设施樱桃幼苗光合特性、叶绿素荧光及渗透调节物质的影响 [J]. 山西农业科学, 2021, 49(7): 834–838. doi: 10.3969/j.issn.1002- 2481.2021.07.08.]
[31] BEN-ASHER J, TSUYUKI I, BRAVDO B A, et al. Irrigation of grapevines with saline water: I. Leaf area index, stomatal conductance, transpiration and photosynthesis [J]. Agric Water Manag, 2006, 83(1/2): 13–21. doi: 10.1016/j.agwat.2006.01.002.
[32] QIU L Z, HUANG Y J, HUANG J Q, et al. Comparative study on vegetal and physiological characteristics of different salt-tolerant plants under salt stress [J]. J Zhejiang Univ (Agric Life Sci), 2006, 32(4): 420–427. [裘丽珍, 黄有军, 黄坚钦, 等. 不同耐盐性植物在盐胁迫下的生长与生理特性比较研究 [J]. 浙江大学学报(农业与生命科学版), 2006, 32(4): 420–427. doi: 10.3321/j.issn:1008-9209.2006.04.015.]
[33] CHEN S W, GAO Z H, YUE C L, et al. Dynamics of salt fog-tolerant physiological characteristics of 11 tree species [J]. J Nanjing For Univ (Nat Sci), 2003, 27(5): 11–14. [陈顺伟, 高智慧, 岳春雷, 等. 盐雾胁迫下杜英等树种生理特性的变化 [J]. 南京林业大学学报(自然科学版), 2003, 27(5): 11–14. doi: 10.3969/j.issn.1000-2006.2003.05.003.]
Effect of Salt Spray Stress on Photosynthetic Physiology ofwith Extremely Small Population
XU Qianrui1,2, GU Jiacheng1, LI Hepeng2, WANG Jun2, FANG Yaoyao2, ZHU Hong2, YUE Chunlei2*
(1. School of Forestry and Bio-technology,Zhejiang Agricultural & Forestry University,Hangzhou 311300, China; 2. Zhejiang Academy of Forestry,Hangzhou 310023, China)
is a species with extremely small populations, only distributing on islands. In order to evaluate the effect of salt spray stress on growth of, 4-year-old seedlings were treated with different salt spray concentrations (mass concentrations of NaCl in salt spray were 0%, 1%, 2% and 3%, respectively), the changes in photosynthetic rate, maximum photochemical efficiency (Fv/Fm), chlorophyll content (Chl) were measured. The results showed thattreated with 1% salt spray could survive, but all plants died treated with more than 2% salt spray. With the increment of salt spray concentration, the maximum photosynthetic rate, Fv/Fmand Chl content in leaves generally decreased, and the light saturation point and light compensation point showed an upward trend. Therefore, it was indicated that salt spray stress affected plant photosynthesis by harming photosystem II reaction center, changing the range of available light energy and reducing chlorophyll content.
; Salt spray stress; Salt tolerance; Photosynthetic characteristics
10.11926/jtsb.4568
2021-11-17
2022-06-09
浙江省“尖兵”“领雁”研发攻关计划项目(2022C02038);浙江省省院合作林业科技项目(2022SY06)资助
This work was supported by the Project for “Pioneer” and “Leading Goose” Research & Development in Zhejiang (Grant No. 2022C02038), and the Cooperation Project for Forestry Science and Technology of Zhejiang Province and Chinese Academy of Forestry (Grant No. 2022SY06).
徐千瑞(1997年生),女,硕士研究生,主要从事植物生态研究。E-mail: 100540507@qq.com
通信作者Corresponding author.E-mail: 1049876924@qq.com

