某三甲医院近三年抗菌药物不良反应研究
唐志勇 李 锐 苏 强▲ 杨思芸 唐 捷
1.南充市中心医院 川北医学院第二临床医学院药学部,四川南充 637000;2.川北医学院附属医院药剂科,四川南充 637000
抗菌药物在临床中广泛应用,挽救了许多感染性疾病患者的生命,已成为人类不可或缺的一类药品[1]。然而,近年来抗菌药物药品不良反应(adverse drug reaction,ADR)的发生日益突显,已成为了医疗卫生服务中不可忽视的问题[2-4]。在临床药物治疗中抗菌药物ADR时有发生,某些严重ADR可能会给患者带来危害,甚至造成患者的死亡[5-6]。据相关报道,我国2019年因药品不良反应住院的患者就有55.0~263.4万人次[7]。因此,对抗菌药物ADR进行系统性研究分析显得很有必要。本研究对某三甲医院近三年抗菌药物不良反应上报数据进行回顾性研究分析,以期了解抗菌药物ADR发生的规律及特点,探讨其原因及预防措施,为临床抗菌药物合理使用提供理论参考,确保患者用药安全。
1 资料与方法
1.1 一般资料
从该医院ADR监测系统中收集2019—2021年上报的抗菌药物ADR报告。采用回顾性统计分析方法,按ADR发生类型、发生时间、患者的性别及年龄、抗菌药物种类、药品剂型、ADR累及器官或系统以及关联性评价及临床转归等信息进行系统性研究分析[8]。因部分ADR存在可能由多种药物共同引发或累及多个器官系统的情况,故按药品种类、药品剂型或累及的器官系统计算总例数时超过实际统计总例数。
1.2 纳入及排除标准
纳入标准:①该医院2019—2021年上报的ADR报告;②抗菌药物相关ADR报告。排除标准:①非抗菌药物ADR报告;②填报不完整;③重报;④无法分析评估的报告。
1.3 统计学分析
采用SPSS 22.0统计学软件分析,计数资料以[n(%)]表示,组间比较采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 ADR的类型分布
在216例抗菌药物ADR报告中,发生最多的类型为一般ADR,共有103例,占47.68%。新的及严重ADR共有113例(包含新的一般、新的严重和严重ADR),占总数的52.31%。见表1。
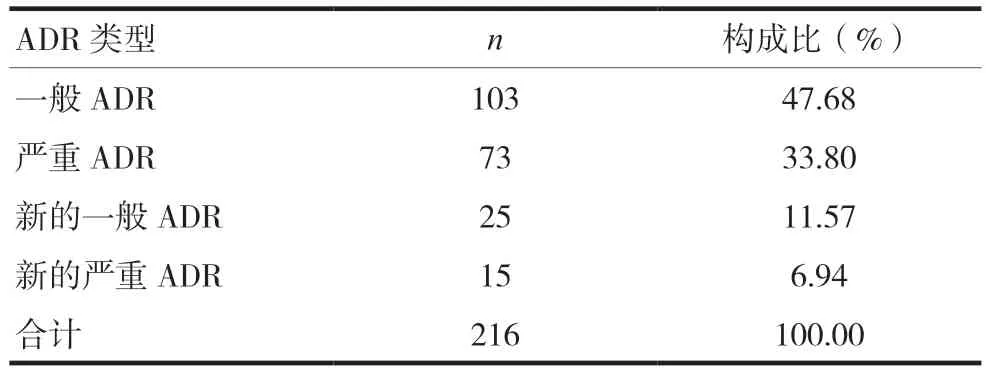
表1 ADR报告类型分布
2.2 ADR发生时间分布
分析结果显示,患者在使用抗菌药物后1 d内出现ADR的有51例,占比23.61%;绝大多数ADR发生在用药后2~5 d,共有92例,占比42.60%;随着用药时间的延长,ADR的发生率降低。见表2。

表2 ADR发生时间分布
2.3 患者发生ADR的性别及年龄分布
在216例抗菌药物ADR报告中,男127例,占58.80%;女89例,占41.20%。男性比例高于女性,但差异无统计学意义(χ2=0.032,P=0.859)。患者年龄最小为1个月,最大为90岁。61~80岁患者所占比例最高,占比36.57%,其次是41~60岁的患者,占比26.85%。见表3。

表3 发生ADR患者的性别及年龄分布
2.4 抗菌药物发生ADR的品种分布
分析结果显示,抗结核类抗菌药物发生ADR最多,占比51.50%;其次是头孢菌素类,占比16.00%;然后是喹诺酮类,占比13.50%。在抗结核类抗菌药物中,ADR主要在一线抗结核药物中发生,如异烟肼53例,乙胺丁醇50例,吡嗪酰胺48例,利福平46例;其次头孢菌素类中头孢哌酮/舒巴坦(23例)及喹诺酮类中左氧氟沙星45例的ADR发生率也较高。见表4。

表4 发生ADR的抗菌药物种类及分布
2.5 抗菌药物发生ADR的给药方式分布
统计结果显示,静脉给药发生ADR共有177例,占比最大,为44.25%;口服给药次之,有172例,占比43.00%;其他给药方式总计51例,占比12.75%。见表5。
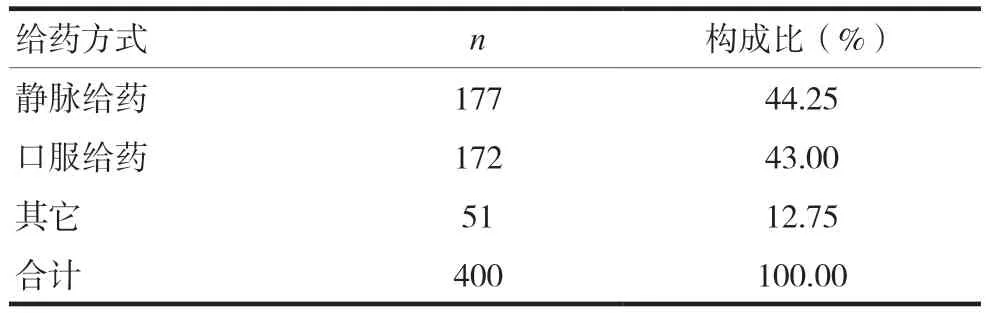
表5 引起ADR的给药方式分布
2.6 ADR累及器官或系统的主要临床表现
抗菌药物ADR对皮肤或其附件的损害最为常见,共89例,占比36.62%,临床主要表现为皮疹、红斑疹、皮肤发红、水肿、瘙痒等;其次,累及消化系统的ADR共计77例,占比31.69%,临床主要表现为腹痛、恶心、呕吐、呃逆、反酸、腹泻、转氨酶升高、胆红素升高等;发生ADR最少的是泌尿系统,共4例,占比1.65%。见表6。

表6 ADR累及器官或系统的临床表现分布
2.7 ADR关联性评价及临床转归
216例抗菌药物ADR中,评价为“可能”的最多,有169例,占比78.24%;评价为“很可能”的有47例,占比21.76%;而评价为“肯定”“可能无关”和“待评价”的有0例。临床转归方面,155例患者通过停用怀疑药物和对症治疗后好转,占比71.76%;46例患者通过医治后治愈,占比21.3%;14例患者的转归信息不详细,占比6.48%;病情没有好转的仅1例,占比0.46%。
3 讨论
3.1 抗菌药物ADR发生与用药时间的关系
研究结果显示,患者在使用抗菌药物后发生ADR最快是在用药第1天,最晚是在用药两个月后,ADR发生的时间跨度较长。但绝大多数ADR发生在用药后前5 d内,占比为66.2%。因此在患者用药后前5 d内应重点监测ADR的发生,以便及时采取相应治疗措施。同时对于非敏感体质的患者用药前期ADR症状并不明显,但随着用药时间的延长药物在人体内不断累积,ADR发生的风险增高。因此对于用药时间较长的患者也因警惕ADR的发生。
3.2 抗菌药物ADR发生与患者性别及年龄的关系
在性别方面,男性发生ADR的比例高于女性,但差异无统计学意义(P> 0.05),这与已有的其他文献报道结果相似[9-10]。在年龄方面,发生ADR主要集中在61~80岁(36.57%)和41~60岁(26.85%)两个年龄段。究其原因,61~80岁的老年患者生理功能退化,药物吸收、分布、代谢和排泄减慢,药物在体内易蓄积,且老年患者病情复杂,常需要联合用药,导致ADR更易发生[11];对于41~60岁的中年患者,医生常认为这类患者身体承受力较强,用药剂量偏大、种类偏多[12],同时在静脉滴注过程中患者私自加快滴注速度以节省输液时间,进而增加ADR的发生风险[13]。因此中老年患者应根据其脏器功能代谢水平合理选择抗菌药物品种及用法用量,应针对性个体化用药,减少合并用药,遵循抗菌药物“最小有效剂量、最短必须疗程”的使用原则,医生、药师、护士应做好临床用药监护工作,保障患者用药安全。
3.3 抗菌药物ADR发生与药物品种的关系
分析结果显示,抗结核类抗菌药物的ADR发生率最高,占比51.50%,一方面可能因我国结核病的发病率较高,占全球的25%[14],该医院收治的结核患者较多;另一方面抗结核治疗需采用多种抗结核药物联合用药,治疗时间长,增加了ADR的发生风险;另外,我国为肝炎大国和酒文化大国,导致抗结核药物ADR的发生风险明显增大[15]。因此,对于结核患者及家属应加强健康宣教,对患者相关生理指标进行定期检查,出现严重ADR时应立即停药并就医对症处理。头孢菌素类抗菌药物ADR发生率仅次于抗结核药物,占比为22.41%,其可能原因为这类抗菌药物作为目前临床上抗感染治疗的主力药物,具有品种数量多、药物性质稳定等突出优点,被视为临床上治疗细菌感染的首选[16]。其在临床上的使用范围广、频率高,导致其ADR的发生率也随之增加[17]。因此用药前应详细询问患者的既往史、家族史及药物过敏史,以减少ADR的发生。另外喹诺酮类药物因其抗菌谱广,与其他抗菌药物无交叉耐药以及无需皮试等优点[18],在临床上应用广泛,同时该类抗菌存在无指征用药、联合用药、超剂量和超疗程用药等情况,造成了该类药物滥用,导致ADR的发生增加[19]。因此,应加强对医务人员进行抗菌药物相关知识培训,提高临床合理使用抗菌药物水平,减少抗菌药物ADR的发生。
3.4 抗菌药物ADR发生与给药方式的关系
结果显示,由静脉给药引发的ADR所占比例最大,为44.25%,其主要原因可能是一方面静脉给药具有无肝脏首过效应、生物利用度高、起效迅速等特点,作为临床上疾病治疗的常见给药方式[20];但另一方面注射剂也具有pH值不稳定、内毒素、微粒超标、给药时间长、给药速度过快等ADR风险[21];另外抗菌药物静脉给药通常仅在医院内部进行,患者一旦出现ADR,医务人员可以及时发现救治,故抗菌药物静脉给药ADR上报率高于其他给药方式。其次,口服给药的ADR发生略低于静脉给药,占比43.00%,其原因可能是一方面口服给药在临床上作为相对安全的给药方式而普遍使用;另一方面该医院抗结核类抗菌药物的ADR发生率最高,而在抗结核治疗中多数患者使用口服剂型抗结核药物治疗。然而,在不纳入抗结核药物占比条件下,口服给药ADR发生仍明显低于静脉给药。所以在病情允许时,患者尽可能地选择口服给药,必须静脉给药时应随时注意患者的临床表现,出现问题时可以迅速地采取应对措施。
3.5 抗菌药物ADR累及的器官或系统
研究结果显示,抗菌药物ADR累及皮肤及其附件的情况最为常见,为36.62%,其次是消化系统,为31.69%,该项数据与已有的文献报道相似[22]。其主要原因可能是皮肤及其附件和消化系统ADR的临床表现比较直观且易观察和诊断,不易与其他疾病相混淆,而累及其他器官或系统的ADR较为隐匿[23],还特别容易与原来的疾病混淆,不容易被临床工作者发现,这可能导致它们的ADR报告率较低。因此对于其他系统的损害,医务人员应提高警惕,谨防严重ADR的发生,同时临床科室应常备严重ADR抢救性药品,坚持及时发现、尽早救治的原则。
综上所述,临床应对抗结核类、头孢菌素类、喹诺酮类抗菌药物的ADR进行重点监测。在临床药物治疗中患者应尽量选择口服给药,必须静脉给药时应随时关注患者的临床表现。在患者用药后前5 d内应重点监测ADR的发生。抗菌药物对皮肤及附件和消化系统的损害较常见,同时医务人员对其他较隐蔽的系统损害也应保持警惕,谨防严重ADR的发生,坚持及时发现、尽早救治的原则。抗菌药物引起ADR的因素较多且复杂,应发挥临床药师的积极作用,在临床上提供用药咨询服务,对患者进行用药教育、用药监护[24],尽可能在第一时间发现ADR并做出干预,以促进临床安全合理用药。

