人工栽培桑黄HPLC指纹图谱及主成分含量测定
钟 石,曹英龙,王文琼,霍进喜,孙雨晴,宣利江,李有贵,*
(1.浙江省农业科学院 蚕桑与茶叶研究所,浙江 杭州 310021; 2.中国科学院 上海药物研究所,原创新药研究重点实验室,上海 202009; 3.中国科学院大学,北京 100049)
桑黄是一种珍贵的药用真菌,主要生长在柳、栎、女真等阔叶树,以及柳杉等针叶树的腐木上,又被称为桑耳、桑臣等[1]。最早的文献记录始于2000年前汉朝的《神农本草经》,《中药大辞典》中记载桑黄具有利五脏、排肠胃气、排毒气的功效,用于治疗淋病、脱肛、盗汗、血崩、痢疾等症[2]。桑黄主要分布在中美洲、非洲以及东亚地区的中国、韩国和日本等国家,在中国主要分布在东北、华北、西北、西南等地区[3-4]。现代研究表明,桑黄主要含有多糖类、苯乙烯吡喃酮类、黄酮类、萜类等成分[5-7]。
近年来,桑黄在抗肿瘤、抗炎、免疫调节等方面受到广泛的关注[8-9]。但随着桑黄药用价值的开发和利用,野生桑黄资源逐渐枯竭;人工种植由于菌种、基质配方和生长年限等不同导致桑黄活性成分差异大,品质参差不齐。因此,建立快速、准确、有效的桑黄质量评价方法,从源头控制桑黄品质尤为必要。《中国药典》2020年版并未收录桑黄,《湖北省中药材质量标准》采用性状鉴别和薄层鉴别的方法制定桑黄质量标准。而指纹图谱技术由于其灵敏性、整体性、全面性等优点,成为了中药材品质评价公认的有效方法[10]。指纹图谱技术与含量测定联合使用,更能够直观、全面地反映桑黄等药材的内在质量[11-12]。
本研究旨在通过对人工栽培桑黄HPLC指纹图谱和苯乙烯吡喃酮类成分Hypholomine B的含量测定,通过定性分析和定量测定方法研究,初步建立人工栽培桑黄的质量标准,为桑黄的质量控制和功能成分的高效利用提供科学依据。
1 材料与方法
1.1 仪器与软件
Agilent 1260高效液相色谱仪(美国Agilent公司);SHB-ⅢS型循环式真空泵(郑州长城科工贸有限公司);数控超声波清洗器(Fisherbrand FB15067,功率300 W,频率37 kHz)。
中药色谱指纹图谱相似度评价系统2004A版;聚类分析软件:IBM SPSS Statistics 23版;OPLS-DA分析软件:SIMCA-p 14.1 (32-bit)版。
1.2 药品与试剂
Hypholomine B对照品(本实验室自主分离得到,纯度≥95%),水为超纯水,乙腈和甲醇为色谱纯,其他试剂均为分析纯。
人工栽培桑黄样品从浙江省多家生物科技公司购买,经中国科学院微生物研究所鉴定为瓦宁纤孔菌Sanghuangporusvaninii的子实体。样品信息见表1。
1.3 方法
1.3.1 桑黄提取溶液制备
精密称取桑黄粉末500 mg,置于100 mL锥形瓶中,加入50 mL甲醇溶液,室温超声提取2次,每次1 h,过滤,滤液减压浓缩至干,甲醇溶解并转移至5 mL容量瓶中,摇匀,定容。0.45 μm微孔滤膜过滤,即得。
1.3.2 对照品溶液的制备
取Hypholomine B对照品适量,以10%甲酸甲醇作为溶剂制备Hypholomine B对照品溶液,质量浓度为1.0 mg·mL-1,-20 ℃储存备用。
1.3.3 HPLC色谱条件
HPLC色谱柱:Exsil Plus EPS C18 (250 mm×4.6 mm,5 μmol·L-1);流动相:0.1%甲酸水为流动相A,0.1%甲酸乙腈为流动相B,梯度洗脱(0~10 min,10%~27% B;10~22 min,27% B;22~30 min,27%~90% B)。检测波长364 nm;流速1.0 mL·min-1;柱温25 ℃;进样量10 μL。
2 结果与分析
2.1 桑黄指纹图谱验证
2.1.1 精密度实验
取同一样品溶液,按1.3.3节进样6次重复实验,获得AIA格式的数据后,导入 “中药色谱指纹图谱相似度评价系统2004 A版”进行相似度评价。6次进样结果相似度均为1,说明精密度好。
2.1.2 重复性实验
按1.3.3节色谱条件,平行制备样品溶液6份进样分析,然后进行相似度评价。6次进样结果相似度均为1,说明重复性好。
2.1.3 稳定性实验
取同一样品溶液,室温放置0、2、4、8、12、24 h后,按1.3.3节条件分别进样,然后进行相似度评价。6次进样结果相似度均为1,说明样品溶液在24 h内稳定。
2.1.4 指纹图谱的建立及相似度分析
按1.3.1节方法制备各批次桑黄样品溶液(S1~S10),按1.3.3节条件分别进样分析,以AIA格式将色谱数据导入 “中药色谱指纹图谱相似度评价系统2004 A版”软件中(图1),然后对色谱图进行适当处理,时间窗宽度为0.1 min,以S1为参照图谱,标记共有峰,多点校正后自动匹配,以平均数生成对照指纹图谱(图2)。同时计算各批次桑黄与对照图谱的相似度(表2)。

图1 各批次桑黄的HPLC图谱

表2 桑黄指纹图谱相似度评价结果(10批)
对各批次桑黄样本进行分析,标定了12个共有峰,相似度在0.924~0.989,其中10号色谱峰(Hypholomine B)稳定、峰面积较大、分离度好,可作为参照峰,并对其进行含量测定。
2.2 化学模式识别研究
2.2.1 系统聚类分析(HCA)
将“中药色谱指纹图谱相似度评价系统”软件处理得到的匹配数据保留为xsl格式,将数据导入IBM SPSS Statistics 23软件中,进行系统聚类分析(hierarchical cluster analysis, HCA)。以样品编号为依据,以共有峰的峰面积为变量,采用组间联结(between-groups linkage)的方法,以皮尔逊相关系数(Pearson correlation coefficient)为依据,输出聚类分析树状图(图3)。

图3 桑黄聚类分析树状图
从实验结果可知,若将10批样品分为两类(分类距离为20),则S6、S7、S8、S9为一类,其他样品为一类。若将10批样品分为三类(分类距离为15),则S6、S7、S8、S9为一类,S5为一类,其他的为一类。
2.2.2 主成分分析(PCA)
采用“IBM SPSS Statistics 23版”软件对10批桑黄样品中共有峰峰面积进行主成分分析(principal component analysis, PCA),表3结果显示,前4个成分(特征值>1)已包含了色谱图大部分的信息,累积的方差贡献率达到了88.343%。根据图4的12个共有峰对4个主成分影响的得分图的结果显示,共有峰5、8、9对主成分1贡献大(载荷的绝对值>0.8)[13-14],共有峰3对主成分2贡献大。基于此,可将10批次桑黄样本分为两类(图5),与聚类分析结果一致。

图4 四个主成分得分图

图5 桑黄的PCA图

表3 四个主成分因子的特征值和方差贡献率
2.2.3 正交偏最小二乘判别分析(OPLS-DA)


图7 十批桑黄样品中各成分的VIP值图
2.3 含量测定
桑黄对照指纹图谱的10号峰是桑黄不同批次间产生差异的最重要成分。采用与对照品对比的方法,确认了10号峰为苯乙烯吡喃酮类成分Hypholomine B。为了建立桑黄指标性成分,进一步开展了Hypholomine B含量测定方法学研究。
2.3.1 专属性实验
精密取供试品溶液和对照品溶液各10 μL,按1.3.3节条件进样分析。结果显示,空白溶剂对测定结果无干扰,各成分均能达到基线分离(图8)。
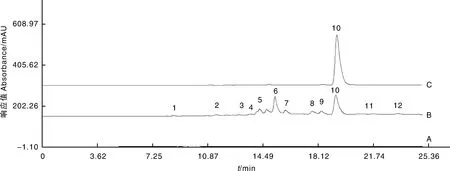
A,空白溶剂MeOH;B,桑黄样品;C,Hypholomine B对照品。
2.3.2 精密度实验
取制备的供试品溶液,连续按1.3.3节条件分析6次。结果显示,Hypholomine B峰面积的RSD值为0.72%(n=6),说明仪器精密度好。
2.3.3 稳定性实验
取制备的供试品溶液,于0、1、2、4、8、18、24 h按1.3.3节条件分别进样分析。结果显示,Hypholomine B峰面积的RSD值为1.29%(n=7),说明对照品溶液在24 h内稳定。
2.3.4 线性关系考察
精密称取Hypholomine B对照品2.00 mg,用10%甲酸甲醇溶液配置成2.00、1.50、1.00、0.50、0.25、0.125 mg·mL-1溶液,按1.3.3节条件分别进样。以进样量(X,μg)为横坐标,峰面积(Y)为纵坐标绘制标准曲线并进行线性回归。Hypholomine B的线性回归方程:Y=8 638.5X+285.19 (R2=0.999 9)。结果表明,Hypholomine B在1.25~20.00 μg范围内其进样量与峰面积的积分值呈较好的线性关系,结果见表4。
2.3.5 加样回收率
取桑黄药材250 mg,加入甲醇25 mL,超声提取2次,每次1 h。合并滤液,减压浓缩蒸干,加入2.00 mg对照品Hypholomine B,用5 mL甲醇溶解,超滤后,用1.3.3节条件进样分析,平行6组,计算回收率和RSD。结果显示,该方法的回收率在95%~99%,RSD值为1.48%。
2.3.6 检测限实验
精密称取Hypholomine B样品1.00 mg,用10%甲酸甲醇溶液配置成1.00 mg·mL-1的对照品溶液,稀释400倍,配置成2.5 μg·mL-1的样品溶液,按1.3.3节条件检测,计算其信噪比为11(S/N>10),故检测限为0.025 μg。
2.3.7 Hypholomine B的含量测定
各批次桑黄样品按2.1节供试品溶液制备方法制备,分析条件按1.3.3节进行,计算各批次桑黄中Hypholomine B的含量,结果见表4。

表4 各批次桑黄中Hypholomine B的含量
3 讨论
据文献研究,有报道采用麦角甾醇为对照建立桑黄药材的质量标准[15]。麦角甾醇是真菌细胞膜的重要组成部分[16],并不能用于桑黄质量标准的控制。桑黄抗肿瘤活性的物质基础是苯乙烯吡喃酮类成分[17-18],故以此为基础选择苯乙烯吡喃酮类成分为对照。经筛选以Hypholomine B为对照,其最大吸收波长在364 nm附近。
对提取方法的考察。桑黄含有多糖类成分,为排除多糖的干扰,选择75%甲醇、甲醇、乙醇作为提取溶剂,选取超声和加热回流作为提取方法。超声时间:0.5 h、1.0 h、1.5 h。提取次数:1次、2次、3次。实验结果表明,用甲醇作为溶剂通过超声提取2次,每次1 h,提取效果好,步骤简单。
对流动相的优化。实验结果表明,有机相为甲醇时,出峰时间靠后,且分离度较差;不同浓度的甲酸对分离也有一定的影响,综合考虑,水(0.10%甲酸)-乙腈(0.10%甲酸)为相对优的流动相。
本实验建立桑黄瓦宁纤孔菌HPLC指纹图谱,共含有12个共有峰,10号色谱峰为苯乙烯吡喃酮类成分Hypholomine B。10批桑黄样本指纹图谱的相似度在0.924~0.989,表明其整体化学成分相对稳定。为更好地辨识桑黄药材的批间差异,通过PCA、HCA、OPLS-DA等分析结果,可以将桑黄10批样品分为两类。指认了桑黄药材间含量差异的最主要成分(OPLS-DA的VIP值最大,且VIP>1)为Hypholomine B。
相较于传统方法,本研究所建立的HPLC指纹图谱具有高效、快速、分离效果好的优势,能较好地反映桑黄药材的整体特征。通过化学计量学分析,找出不同批次桑黄的差异性成分。随后对色谱条件进行优化,Hypholomine B的精密度、稳定性、线性关系、加样回收率和检测限均符合要求。故本实验采用该色谱方法测定了Hypholomine B的含量。各批次桑黄样本中Hypholomine B含量在0.15%~0.95%。本文通过建立基于指纹图谱的定性鉴别方法及含量测定的定量分析方法,结合化学计量学方法对数据进行分析与挖掘,为桑黄整体性质量标准的建立提供依据。

