鹌鹑GnRH-1基因多态性与蛋品质的关联分析
王龙威,白俊艳,2,*,贾小平,雷 莹,2,陈梦柯,樊红灯,卢小宁,何豫涵,曾凡林,张容恺
(1. 河南科技大学 动物科技学院,河南 洛阳 471023; 2.洛阳市动物遗传育种重点实验室,河南 洛阳 471023; 3.河南科技大学 农学院(牡丹学院),河南 洛阳 471023)
促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)也叫促黄体化激素释放激素,是由脊椎动物下丘脑神经元分泌的一种十肽类激素,是动物生殖过程中最重要的激素之一。垂体分泌的促卵泡素(FSH)和促黄体素(LH)主要受下丘脑GnRH的控制。GnRH在下丘脑神经元中合成,并分泌至垂体门脉循环中,主要作用于垂体前叶。随着研究的不断深入,人们发现GnRH分布于下丘脑、胎盘绒毛、胰腺癌、乳腺癌组织、消化道和胸腺等组织中[1]。GnRH与G蛋白偶联受体促性腺激素释放激素受体(GnRHR)结合,启动下游信号传导,诱导促性腺激素的产生,FSH和LH进入外周循环,作用于卵巢和睾丸,以调节卵泡生成、排卵、精子和类固醇的生成。GnRH脉冲式释放刺激垂体促性腺激素(GTH)的合成和分泌,从而调节性激素的分泌,是性腺轴系的原动力,对性腺可能具有直接作用[2]。
GnRH最初由美国科学家Schally领导的研究小组在猪的下丘脑分离纯化获得,被鉴定为促性腺激素释放激素。1982年,King等[3]在鸡中发现了GnRH亚型,即GnRH-1。继GnRH-1之后,其他形式的GnRH不断被发现,又从鸡下丘脑中分离出了GnRH-2。Sherwood等[4]研究发现,GnRH-3是鱼类中存在的第3种变体,最早发现于大西洋鲑(Salmosalar)中,也称为salmon GnRH。Shao等[5]研究表明,刺鱼基因组中存在GnRH2和GnRH3基因,没有GnRH1基因。目前的研究表明,GnRH主要包括3种类型,即GnRH-1、GnRH-2、GnRH-3,在每种脊椎动物的脑中至少存在2种GnRH类型(GnRH-1和GnRH-2),而在某些鱼类中还存在着GnRH-3类型。GnRH具有多重功能,在动物的生长发育、生殖行为、妊娠、分娩等生命活动中起着至关重要的作用[6]。GnRH通过调控促性腺激素的分泌在繁殖中起着关键作用,GnRH-1主要存在于下丘脑,对动物性腺发育和性成熟至关重要[7]。张蕊等[8]研究表明,产蛋后鸽下丘脑中GnRH基因表达量最高,且极显著高于产蛋前和哺育期。张泽林[9]研究表明,GnRH和LH在妊娠期不同阶段母猪黄体组织都有表达,其表达水平与妊娠期黄体功能一致。Hameed等[10]探讨了GnRH基因短期孕酮联合心电图(eCG)对anestrous Beetal山羊非繁殖期繁殖参数的影响。李志惠等[11]、黄种彬等[12]、杨涛[13]研究表明,GnRH基因与榕江小香羊的繁殖能力,以及连城白鸭、皖西白鹅和莱茵鹅的产蛋性能等存在密切联系。作为基础脊椎动物的七鳃鳗是最早进化的脊椎动物,七鳃鳗的两种促性腺激素释放激素通过下丘脑-垂体-性腺轴控制生殖过程[14]。以上研究充分说明,GnRH基因与动物的繁殖性状存在紧密的联系,可以作为动物生产过程中的重要候选基因进行研究。
鹌鹑蛋近圆形、个体小,一般有10 g左右,表面有棕褐色斑点,被认为是“动物中的人参”,宜常食,为滋补食疗品。鹌鹑蛋的营养价值不亚于鸡蛋,有较好护肤、美肤作用,特别是所含的蛋白质中含有较多的苯丙氨酸、酪氨酸、亮氨酸等人类容易吸收的必需氨基酸,以及矿物质元素和多种维生素、卵磷脂、脑磷脂和激素,又被称作是调理和滋补的理想佳品。本研究通过PCR扩增和DNA测序技术分析GnRH-1基因的多态性及其与鹌鹑蛋品质的关联性,以期获得鹌鹑蛋品质相关的分子标记,为蛋用鹌鹑新品系的培育和标记辅助选择提供参考。
1 材料与方法
1.1 试验材料
中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑均为母鹌鹑,每个品种鹌鹑50只,单笼饲养,饲养试验前对屋舍进行严格消毒,定期进行喷雾消毒。试验笼具为4层全重叠式。试验期间屋舍内保持24 h光照,鹌鹑自由饮水与采食,每日早晚两次定时人工补充饲料,饲养温度与湿度根据饲养管理要求而定。实验周期为鹌鹑7周龄至18周龄。
1.2 试验方法
1.2.1 鹌鹑蛋品质测定
使用游标卡尺测量鹌鹑蛋的纵径长、横径长和蛋黄宽度;使用蛋品质测定系统测定鹌鹑蛋的质量、蛋白高度、蛋黄高度和蛋黄质量;使用螺旋测微仪测定鹌鹑蛋的蛋壳厚度。测量方法如下:
(1)蛋质量(g):将鹌鹑蛋放置在电子天平上并读出度数。测定同一个体产的3枚蛋质量,取平均值。
(2)蛋纵径长(mm):使用游标卡尺测量鹌鹑蛋长端最远距离。
(3)蛋横径宽(mm):使用游标卡尺测量鹌鹑蛋短端最短距离。
(4)蛋白高度(mm):将鹌鹑蛋打开并将蛋液自然平铺在玻璃板上,选取浓蛋白边缘与蛋黄边缘中间均匀分布的3个等距离点,使用蛋品质测定系统测定蛋白高度,取3次结果的平均值。
(5)蛋黄高度(mm):使用蛋品质测定系统测量平铺后的蛋黄最高点的高度,分别测量3次,取平均值。
(6)蛋黄宽度(mm):使用游标卡尺测量平铺后蛋黄两端的宽度,在不同位置重复3次,取平均值。
(7)蛋黄质量(g):将蛋黄与蛋白分离,将蛋黄放置在电子天平上,待读数稳定后读取数据。
(8)蛋壳厚度(mm):分别取蛋的大头、小头和中间部分的蛋壳,去除内壳膜,分别使用游标卡尺测量厚度,结果取3点的平均值。
(9)蛋形指数=蛋的纵径长/蛋的横径长。
(10)蛋黄指数=蛋黄高度/蛋黄宽度。
1.2.2 基因组DNA提取与PCR扩增
实验结束时从鹌鹑心采血5 mL,并利用试剂盒法提取基因组DNA,试剂盒购自郑州鼎国生物有限公司。本实验GnRH-1引物序列参照文献[15]的引物序列,上游引物为5′-TCTTGGTTGGTGTTCTCCT-3′,下游引物为5′-ATTGCTCAGCCTGGGAT-3′,扩增片段906 bp。PCR反应体系15 μL:去离子水3.5 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,2×TaqPCR Mix 7.5 μL。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 7 min;4 ℃保存。
1.2.3GnRH-1基因多态性与鹌鹑蛋品质的关联分析
利用SPSS19.0软件进行分析,最终以均值±标准误的形式列出。
关联分析模型为Yijk=μ+Pi+Mj+eijk,其中,Yijk为性能观测值,μ为均值,Pi为第i个品种效应,Mj为第j个基因型效应,eijk为随机误差。
2 结果与分析
2.1 GnRH-1基因的扩增
中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑GnRH-1基因的扩增结果见图1,扩增片段在900 bp附近均有一明亮高清的条带,这与目的条带906 bp相一致。

1~2,中国黄羽鹌鹑;3~4,北京白羽鹌鹑;5~6,朝鲜鹌鹑。
2.2 GnRH-1基因的SNP位点检测
GnRH-1基因在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中总计检测到14个突变的SNP位点,具体为C71T、C108T、C168T、C178T、A184G、C206T、A209C、C215T、A252G、A279T、C281T、C293G、C339T、C458T(图2)。

图2 鹌鹑GnRH-1基因的SNP检测
2.3 GnRH-1基因的基因型频率和基因频率
GnRH-1基因在3个鹌鹑品种中的基因型频率见表1,除A209C和C281T在中国黄羽鹌鹑和北京白羽鹌鹑中只检测到2种基因型外,其他12个SNP位点在3个鹌鹑品种中均检测到3种基因型。C71T位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率较高的基因型均为TT、CT;C108T位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率较高的基因型均为CC、CT;A209C位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率最高的基因型均为CC,频率分别为0.980、0.955、0.624;C281T位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率的最高基因型为TT,频率分别为0.980、0.955、0.708;C293G位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率较高的基因型为CG、GG;C339T位点在中国黄羽鹌鹑、北京白羽鹌鹑、朝鲜鹌鹑中频率最高的基因型均为CC,频率分别为0.833、0.795、0.688。
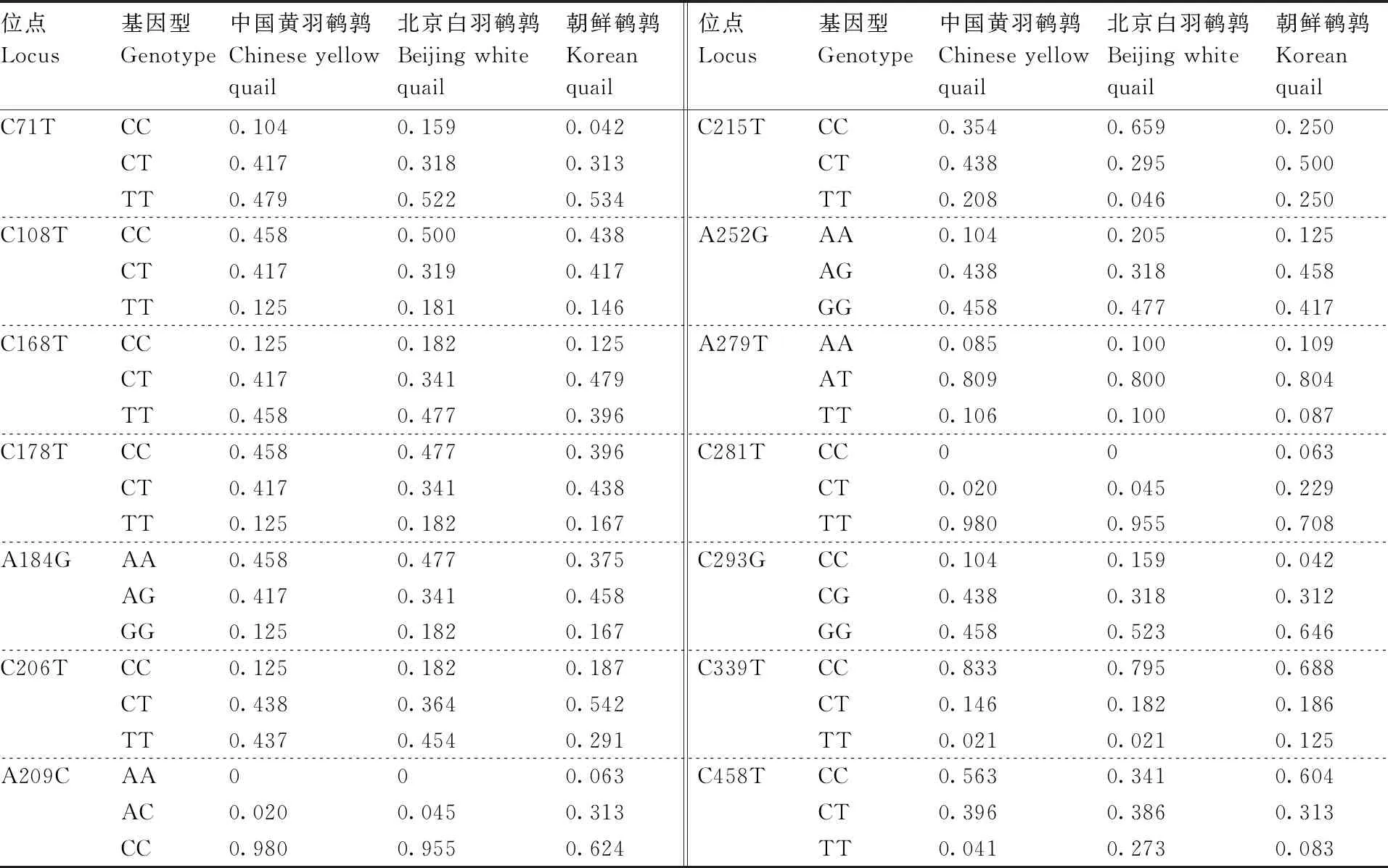
表1 GnRH-1基因的基因型频率
GnRH-1基因的等位基因频率见表2。C108T、C178T、A209C、C215T、C339T、C458T位点在3个鹌鹑品种中以C等位基因频率为最高,故C为优势等位基因;C71T、C168T、C206T、C281T位点在3个鹌鹑品种中以T等位基因频率为最高,T为优势等位基因;A184G位点在3个鹌鹑品种中以A等位基因频率最高,A为优势等位基因;A252G位点和C293G位点在3个鹌鹑品种中以G等位基因频率为最高,G为优势等位基因;A279T位点在朝鲜鹌鹑中以A等位基因频率最高(0.511),A等位基因为优势基因;而A279T位点在中国黄羽鹌鹑和北京白羽鹌鹑中以T等位基因频率为最高(0.511和0.500),T等位基因为优势基因。

表2 GnRH-1基因的等位基因频率
2.4 鹌鹑GnRH-1基因与蛋品质的关联分析
GnRH-1基因的多态性与鹌鹑蛋品质的关联分析结果见表3。C71T、C215T位点CC基因型的蛋黄高度和蛋黄指数显著(P<0.05)高于CT和TT基因型。A209C位点CC基因型的蛋黄高度显著(P<0.05)高于AA、AC基因型,CC基因型蛋黄指数显著高于AA基因型,而AA基因型的蛋黄宽度(P<0.05)显著高于AC基因型和CC基因型。A279G位点TT基因型的蛋黄指数显著(P<0.05)高于AA基因型,蛋壳厚度显著(P<0.05)大于AT基因型。除此之外,GnRH-1基因的其他位点对鹌鹑蛋品质无显著影响(P>0.05)。

表3 GnRH-1基因的多态性与鹌鹑蛋品质的关联分析

续表3 Continued Table 3
3 讨论
3.1 GnRH基因具有多态性
GnRH基因部分位点突变可能会影响人和动物的生殖、生理,为本实验探究GnRH基因对蛋品质的影响开拓了先河。蒲跃进[15]对鹌鹑的GnRH-1多态性进行了分析,检测到C108T、C168T、C178T、A184G、C206T、C215T共6个突变位点,且只有C108T是同义突变,并没有造成相应编码氨基酸序列的变化。而本研究除了检测到与上述6个突变位点外,还检测到8个新的突变位点:C71T、A209C、A252G、A279T、C281T、C293G、C339T、C458T,可见GnRH-1基因在3个蛋用鹌鹑群体中具有丰富的多态性。Nakayama等[16]采用Southern blot和PCR产物克隆测序的方法发现人GnRH基因外显子2序列中有一处碱基G>C突变,致使色氨酸突变成丝氨酸,认为该突变与性成熟有关。在人GnRH基因5′端调控区164 bp处发现了G>A的突变,认为该突变可能与启动青春期的时间有关联[17]。颜泉梅等[18]研究表明,GnRH基因185、336 bp位点突变对西农莎能奶山羊和布尔山羊产羔数存在显著影响。通过关联分析推测,GnRH基因可能影响鹌鹑的蛋黄高度、蛋黄指数、蛋黄宽度和蛋壳厚度。
3.2 GnRH基因位点突变影响鹌鹑产蛋性能
Wu等[19]研究表明,300日龄和400日龄文昌鸡的产蛋数受GnRH基因型影响显著;吴旭等[20]研究表明,GnRH基因5′调控区检测到3种基因型AA、AB、BB,AA型与BB型相比发生G→A突变,不同基因型与300日龄产蛋数和最大连产天数均显著相关,与开产日龄无显著相关性。黄种彬等[12]检测到连城白鸭GnRH基因有3种基因型,不同基因型对产蛋数有明显影响。杨涛[13]研究表明,GnRH基因3种基因型与皖西白鹅产蛋量有显著相关性,BB基因型产蛋量明显高于AA和AB型,3种基因型与莱茵鹅产蛋量也有显著相关性,FF基因型的产蛋量明显低于EB和EF型。彭亮[21]在番鸭GnRHR基因的内含子2片段GR1上检测到1个位点的碱基突变,为CT突变,发现存在AA、AB和BB这3种基因型,不同基因型与开产日龄、最长连产天数、平均连产天数和300日龄产蛋数显著相关。Hu等[22]在二郎山鸡群体中发现了GnRH基因的5个SNP,其中3个SNP位点对鸡的开产日龄有显著影响,SNP5对开产体重有显著影响。康乐[23]利用克隆测序技术发现,鸡cGnRH-1基因长6 941 bp,共有15处变异,其中3′端调控区的2处突变导致不同基因型的开产日龄和个体就巢持续天数存在显著差异。这说明GnRH基因位点的突变可能影响家禽的繁殖性能。
鹌鹑作为与鸡和鸭同源性最高的品种,其GnRH基因相关报道较少,仅文献[15]报道了GnRH-l基因在鹌鹑中的作用,鹌鹑GnRH-1基因在心脏、肺、腿肌、胸肌、胰中不表达,在肠、肝、卵巢、脾、肾和下丘脑中表达,在脾中的表达量最高,下丘脑次之,肝中的表达量最低。本研究结果表明,C71T、C215T、A209C、A279G位点与鹌鹑的蛋黄高度和蛋黄指数有显著相关性,A209C位点与鹌鹑的蛋黄宽度有显著相关性,A279G位点与鹌鹑的蛋壳厚度有显著相关性,推测GnRH-1基因可能是影响鹌鹑蛋品质的候选基因,GnRH-1基因变异可能作为影响蛋用鹌鹑产蛋性能的重要候选基因。GnRH-1基因是否影响鹌鹑蛋品质及其作用机制尚需进行进一步研究。
4 结论
本研究利用DNA测序技术检测到GnRH-1基因在3个蛋用鹌鹑群体中有14个SNP突变位点(C71T、C108T、C168T、C178T、A184G、C206T、A209C、C215T、A252G、A279T、C281T、C293G、C339T、C458T),其中C71T、C215T、A209C、A279G位点与鹌鹑的蛋黄高度和蛋黄指数有显著相关性,A209C位点与鹌鹑的蛋黄宽度有显著相关性,A279G位点与鹌鹑的蛋壳厚度有显著相关性。综上所述,GnRH-1基因可以作为影响鹌鹑蛋品质的分子标记或候选基因。

