“酸碱中和反应”实验中酚酞的尴尬角色
荆丽田 杨彩霞
(1.兰州市第四十九中学 甘肃兰州 730070;2.西北师范大学化学化工学院 甘肃 兰州 730070)
一、问题的提出
人教版九年级化学(下)“酸和碱的中和反应”课题中,在探究酸和碱是否发生了反应以及酸和碱反应的实质时,教材编写的实验如下:
实验10-8 如图所示:在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变为无色为止(图见课本60页)。
笔者发现这个实验在教学过程并不能很好地辅助教学,课堂实验演示并没有达到预期的教学目的。对实验现象,有些学生认为指示剂遇酸或碱的变化是物理变化,还有学生对实验结论始终处于困惑之中。
笔者查阅了人教版初中化学课本的其他几个版本,包括20 世纪80 年代的初级中学化学(全一册)到2012 版九年级化学(下册)等教材,[1-3]其中关于酸碱中和反应的实验,都是用酚酞做指示剂,在氢氧化钠溶液中滴加盐酸,溶液由红色变为无色,据此判断酸和碱发生了反应。仔细分析,人教版课本编著者在编写这个实验的过程中,借鉴了高中酸碱中和滴定实验的内容。那么,在九年级化学课本中这个实验的呈现是否符合九年级学生的认知情况呢?教师需从学生的认知能力及酚酞在酸碱反应中的变色原理去分析。
二、酚酞在“酸碱中和反应”实验中的角色和变色机理
酚酞是二元弱酸的内酯,能够水解为阴离子(见图1)。
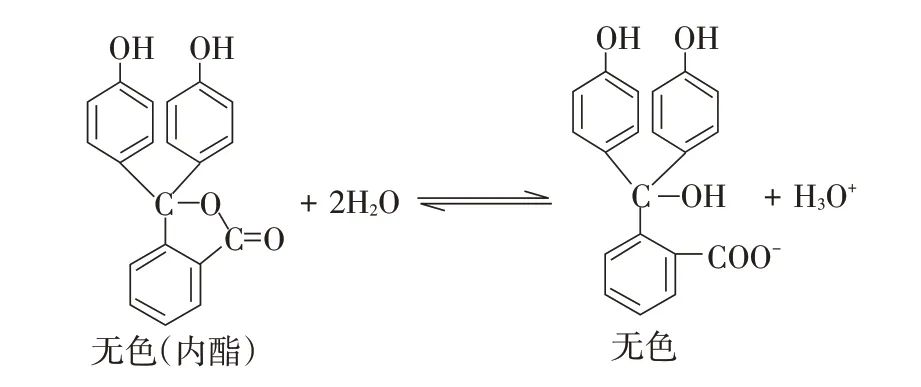
图1 酚酞的水解
其水溶液为无色的酸性溶液,在酸性或碱性条件下存在下列平衡(见图2)。

图2 酚酞的酸碱平衡
在以酚酞做指示剂的碱性溶液中,由于溶液呈碱性,使得图2中的平衡向共轭链增长的醌式结构移动,因此溶液呈红色;当加入稀盐酸时,盐酸中的氢离子与原平衡体系中的氢氧根离子反应生成水,溶液碱性逐渐减弱,使得图2中的平衡向共轭链缩短的酚式结构移动,溶液呈无色。[4]通过酚酞做指示剂,在酸碱中和反应中不仅证明了酸、碱之间发生了中和反应,而且可依据溶液颜色变化来判断酸、碱中和反应的终点,这即是酚酞在酸碱中和反应中的变色机理。
对高二学生而言,他们已具有初中化学酸碱反应的基础知识,是在学习了化学平衡以及电离平衡之后进一步学习酸碱中和滴定。学生已经建立了化学平衡的概念,并且在课本阅读材料中,也介绍了酸碱指示剂在酸性及碱性条件下,平衡移动的知识。所以,在高中化学学习阶段,学生理解和掌握关于酸碱中和的本质,以及设计用指示剂判断酸碱中和的滴定终点,相对而言,水到渠成;课本编排的顺序是合理的。
三、酚酞在初中化学“酸碱中和反应”实验中的尴尬角色分析
九年级学生在学习溶液内容时,对于物质的溶解,以及在改变条件时,溶质在饱和溶液中结晶的知识,只有初步的了解,还没有形成系统的化学平衡思想,也就无法深入理解指示剂在酸碱中和反应中的化学反应机理。笔者也听过一些老师的公开课,一些老师为了迎合学生自主学习、自主探究的课堂模式,先提出问题:酸和碱会发生反应吗?然后让学生自己设计实验,学生事先预习了,当然会按课本所设定的实验来设计。也有些学生有所创新,把课本上的酚酞溶液更改为石蕊试液,或把盐酸加入到氢氧化钠溶液中,更改为将氢氧化钠溶液加入到盐酸中。最后通过演示实验或学生实验,得出了酸和碱确实发生了反应。但课后问学生为什么这样设计实验,学生自己也说不清楚,学生对自己所“设计”的实验也一知半解,对实验的结论当然更是稀里糊涂。
也有化学教师在讲解“酸碱中和反应”时,常常会设计如下教学过程:先复习回顾已学过的酸和碱的化学性质,接着提出问题:“酸和碱之间是否会发生反应呢?”,然后做补充演示实验:在一定量的氢氧化钠溶液中逐滴加入稀盐酸溶液;老师又提出问题:“没有明显现象,是不是酸和碱之间不发生反应呢?”“如何设计实验证明酸和碱之间发生了反应?”在教师的启发和阅读课本的过程中,学生被动接受了课本上所设计的实验。老师对实验现象的分析和讲解如下:通过前面的学习,我们知道氢氧化钠溶液呈碱性,能使酚酞溶液变红色,在加有酚酞溶液的氢氧化钠溶液中,逐滴滴加稀盐酸时,红色溶液逐渐变为无色。这说明加入一定量的盐酸后,溶液不呈碱性了,由此证明了盐酸和氢氧化钠溶液确实发生了反应……
对于九年级学生来说,对实验中酚酞的颜色变化的理解,会出现两种情况:
一种理解是这个变化是物理变化。虽然老师强调过指示剂遇酸、碱变色的性质属于酸、碱的化学通性,但由于前面学过的化学变化(反应)都有对应的化学方程式,而老师没有教过酚酞在此反应中变化的化学方程式,课本上也没有。这样在思想上,学生错误地把指示剂的变色理解为简单的物理变化,而且由酚酞在酸碱中和反应过程中的变化所得的实验现象和结论,似乎更确定了他们理解的“正确性”。这样错误的理解容易形成歪打正着的认知,自然把酚酞在酸碱反应中颜色的变化,认为是酸碱确实发生反应的证据。殊不知自己的理解本身是错误的。
另一种理解是这个变化是化学变化。酚酞加入氢氧化钠溶液中变为红色,是由于酚酞与氢氧化钠反应生成一种红色的新物质,再在红色溶液中滴加盐酸的过程中,溶液逐渐变为无色。这是由于红色物质与盐酸反应,生成了无色的另一种新物质。持这种观点的同学,思维正确了,但困惑也出现了:这明明是两个不同的化学反应,而不是最后得出的结论——反应只是发生在酸和碱之间的一个反应,也即是说,老师的演示实验在他们的理解中,就无法证明氢氧化钠和盐酸确实发生了反应。这会使他们纠结于演示实验的现象和结论,以至于有些同学对化学实验的科学性提出质疑。敢于质疑的学生可能会来问老师,老师将会用高中的知识给他们予以解释,但是,学生依然会一知半解;不善于质疑的学生或许就一直困惑到高中。
因此,人教版九年级课本中利用酚酞做指示剂,证明酸碱中和反应的实验设计对教学并没有起应有的辅助作用,酚酞在该实验中无疑是尴尬的角色。
四、对九年级化学“酸和碱”单元知识编写的建议
化学研究的对象是物质,对学生而言,学习化学知识就是逐渐认识物质的过程。化学知识的呈现,应该是由浅入深,由表及里,层层递进,也理应符合学生认知的螺旋式递进规律。化学教科书的编纂也应该遵循这样的规律。
实验是化学研究的主要方法,实验也是学生学习化学、探究物质性质及其变化的非常有效的手段,而化学演示实验是化学教师教学中不可或缺。在化学学习中通过观察恰当的化学演示实验的现象,学生可以加深对物质变化的认识,增强对化学知识的理解,开拓化学实验探究的思维。恰当合理的实验设计能使教师的教学效果达到事半功倍的效果,更重要的是能很好地培养学生科学探究的素养。化学实验应该在学生已有的知识基础上进行设计。
笔者在多年的九年级化学教学过程中,尝试将人教版课本的内容,尤其一些演示实验进行了整合,现将“酸和碱”单元的内容整合情况列于表1。
从表1中可以看出,笔者把课题二中溶液的酸碱度部分调整到课题一中,设计的实验也进行了相应的整合。将课题一中溶液的导电性和溶液的酸碱度合并到一个大标题下,并增加了用手持pH计测定溶液酸碱度的实验。在课题二中把酸碱中和反应的实验进行了改进,由原来沿用高中酸碱中和滴定实验的指示剂法,改为利用pH测定法证明酸和碱确实发生了反应。
整合后的优点:课题一中酸的酸性和碱的碱性,以及溶液酸碱性的关系更加清晰,能够在课题二中水到渠成地用pH测定法,代替指示剂法确定酸碱中和反应的本质。pH测定法是:在稀氢氧化钠溶液中滴加稀盐酸溶液(当然也可以是在稀盐酸溶液中滴加稀氢氧化钠溶液)过程中,通过多次测定溶液的pH,直观地显示溶液中氢氧根离子(或氢离子)的变化过程,学生由此清楚地获得盐酸和氢氧化钠确实发生了反应,并且反应的实质是氢离子和氢氧根离子发生了反应,生成了水。教师再通过设计动画模型,使学生形象地获知酸碱中和反应的实质——氢离子和氢氧根离子结合生成了水。
整合后的教学材料,对学生自主探究酸碱反应实质的学习铺垫了基础素材,便于学生有根据地设计中和反应的验证实验。当然这样的整合也有其弊端,就是课题一的内容过多,教学过程由原来的二到三课时增加到三至四课时,但为了教学效果的优化,笔者认为整合是必要的。因为教学过程毕竟是在课程标准的指导下,教师针对学情,对教材、素材再加工、再整合的过程。

