老年住院患者衰弱发病的影响因素分析及与骨质疏松症的关系
王翠,鲁喦,靳冰,李跃华
1 北京中医药大学研究生院,北京 100029;2 中国中医科学院西苑医院老年病科
衰弱是一种随年龄增长而出现的复杂疾病,其特征是多个器官系统生理储备下降,即使暴露在轻微压力下,也会增加对不良健康结果的易感性[1]。衰弱被认为是与老龄化相关的最重要的问题之一。衰弱是可逆的,可以通过运动训练、营养支持等措施进行干预。因此,深入了解衰弱的危险因素对预防或延缓衰弱、减少不良健康后果意义重大。近年来多项研究表明,衰弱与骨质疏松症之间存在密切联系,两者有着共同的病因和生理病理机制且存在潜在的相互作用。目前国内对于衰弱与骨质疏松症之间关系的研究较少,因此,本研究对老年住院患者衰弱发病的影响因素进行分析,并探讨衰弱与骨质疏松症的关系,以期为衰弱的病因研究提供理论基础。
1 资料与方法
1.1 研究对象 选取2020 年8 月—2021 年8 月在中国中医科学院西苑医院老年病科住院的老年患者424 例作为研究对象,男163 例、女261 例,年龄60 ~ 94(73.16 ± 8.24)岁。纳入标准:①年龄≥60 岁;②无意识、语言障碍,能够理解并配合完成问卷调查;③肢体活动能力不受限,能主动配合完成各项评估;④对本研究知情同意并自愿参加本研究。排除标准:①严重认知功能障碍(意识不清、痴呆或精神疾病)患者;②急重症或处于慢性病急性期或疾病终末期患者;③患有严重的心、脑、肝、肾等脏器疾病及血液、呼吸、消化系统疾病者;④有精神疾病史或存在严重心理问题的患者;⑤患有影响骨密度检测结果的疾病(如恶性肿瘤、甲状腺及甲状旁腺疾病、类风湿关节炎等)患者。
1.2 衰弱评估 采用Freid衰弱量表评估患者是否存在衰弱。量表包含5 个评估项目:是否出现不明原因的体质量下降、握力值是否达标、是否步速减慢、是否躯体活动量减少、是否自觉疲乏。量表共计5 分,0 分为无衰弱,1 ~ 2 分判定为衰弱前期,≥3 分判定为衰弱。其中,步速评估采用4.6 m 步行速度,在地面取一段6 m长的距离,在1.4 m处用红色胶带做标志,嘱患者在保证身体平稳的情况下尽量以最快速度行走,用秒表计时,计算步速;握力评估使用统一标准的握力器,嘱患者使用优势手最大力度握3次,取平均值。
1.3 骨质疏松症诊断 使用双能X线骨密度仪测量患者腰椎及股骨颈部位的骨密度T值,根据中华医学会骨质疏松和骨矿盐疾病分会(2017)提出的骨质疏松症临床诊疗标准[2],评估骨质疏松症患病情况。
1.4 资料收集 设计调查问卷,向患者解释本次调查的目的、相关内容与方法,确保患者能理解并准确完成问卷。每份调查问卷完成后要及时检查,确保无遗漏项和填写错误,如有遗漏项或错误应及时与患者确认并补充完整。
1.4.1 一般资料、生理健康状况及生活习惯 记录患者的性别、年龄、身高、体质量、BMI、学历水平、退休前工作性质、患病种数、用药种数、睡眠质量、牙齿功能、烟酒史、运动频率、饮食习惯。其中,运动是指中强度有氧运动,如快走、慢跑、跳舞、游泳、骑自行车、太极拳、健身舞等;多病共存是指同时存在2 种或2种以上慢性病[3];多重用药指同时服用5种及以上的药物[4];饮食习惯中,素食为主是指以植物性食物为主(包括粮食、豆类、蔬菜、水果等)、植物油为主要脂肪来源[5],荤食为主是指以肉类、鱼类及其副产品为主[6]。
1.4.2 下肢运动及平衡能力 ①30 s 连续坐立试验:嘱患者坐在45 cm 左右宽的椅子上,背部挺直,不能贴于椅背,两手平放于胸前,在听到研究者喊“开始”指令后,在保证平稳的情况下,尽量快速地从椅子上站立、坐下,动作期间要求膝关节完全伸直,记录患者30 s内完成的连续站立—坐下的个数。②单腿直立时间:患者在平稳地面睁眼单腿站立,另一只脚需抬离地面大于5 cm,上肢及躯体不能依靠相关物体,用秒表记录站立时间。
1.4.3 营养状况 患者入院前测空腹8 ~ 12 h 血清白蛋白、右侧上臂围和右侧小腿围。上臂围:嘱患者上臂自然下垂,放松上肢,用记号笔标记右侧上臂肩峰与尺骨鹰嘴,取中点处,用软尺围绕一周取值。小腿围:嘱患者站立,用软尺测量右侧腓肠肌最粗处的周径。
1.5 分析方法 采用SPSS26.0 统计软件。符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验,多组比较采用方差分析;不符合正态分布的计量资料以M(IQR)表示,采用非参数检验。计数资料以n(%)表示,采用χ2检验。采用有序多因素Logistic 回归分析对衰弱发病的影响因素进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 老年住院患者衰弱及骨质疏松症发生情况424 例老年住院患者中,衰弱149 例(35.1%)、衰弱前期185 例(43.6%)、无衰弱90 例(21.2%),骨质疏松 症227 例(53.5%)、非 骨 质 疏 松 症197 例(46.5%)。
2.2 老年住院患者衰弱发病的影响因素 单因素分析结果显示,不同衰弱水平患者的性别、烟酒史、学历水平差异无统计学意义(P均>0.05)。不同衰弱水平患者的年龄、BMI、多病共存、多重用药、运动频率、饮食习惯、睡眠质量、牙齿状况、退休前工作性质比较,差异有统计学意义(P均<0.05);不同衰弱水平患者的腰椎和股骨颈骨密度T 值、骨质疏松症患病率、血清白蛋白、上臂围、小腿围、睁眼单腿直立时间及30 s 坐立个数比较,差异有统计学意义(P均<0.01)。见OSID 码表1。以衰弱状况为因变量(无衰弱=1、衰弱前期=2、衰弱=3)、无衰弱组为参考类别,以单因素分析中差异有统计学意义的项目为自变量,进行有序多因素Logistic 回归分析,结果显示,多病共存、多重用药、睡眠质量差、牙齿状况差、骨质疏松症是衰弱的危险因素,保持≥3 次/周的有氧运动、高血清白蛋白、粗小腿围、30 s坐立个数多、睁眼单腿直立时间长是衰弱的保护因素(P均<0.05)。见表1。
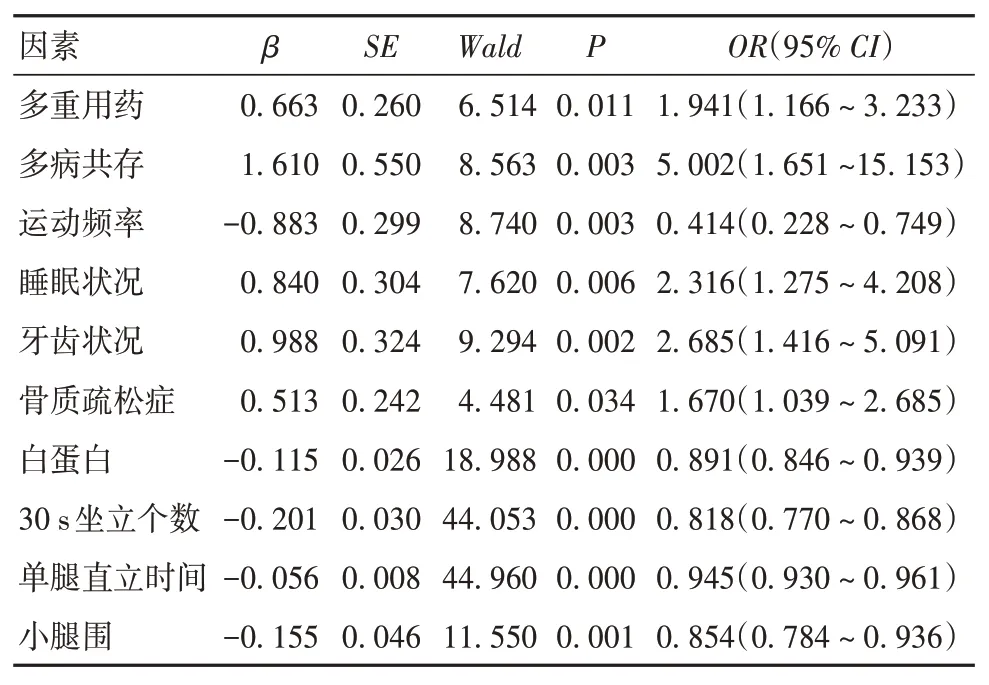
表1 老年住院患者衰弱发病影响因素的多因素Logistic回归分析结果
2.3 骨质疏松症与非骨质疏松症老年患者衰弱发生率、Freid 量表得分及步速和握力水平比较 骨质疏松症老年患者衰弱104 例(45.8%)、衰弱前期94例(41.4%),非骨质疏松症老年患者分别为45 例(22.8%)、91 例(46.1%)。骨质疏松症老年患者衰弱和衰弱前期发生率、Freid 量表得分高于非骨质疏松症老年患者,步速和握力水平低于非骨质疏松症老年患者(P均<0.01)。见表2。
表2 骨质疏松症与非骨质疏松症老年患者Freid量表得分及步速、握力水平比较(± s)

表2 骨质疏松症与非骨质疏松症老年患者Freid量表得分及步速、握力水平比较(± s)
注:与非骨质疏松症老年患者相比,*P<0.01。
是否患骨质疏松症骨质疏松症非骨质疏松症握力(kg)19.91 ± 6.85*22.76 ± 7.25 n 227 197 Freid量表得分(分)2.25 ± 1.27*1.49 ± 1.23步速(m/s)0.59 ± 0.20*0.69 ± 0.21
3 讨论
3.1 衰弱发病的影响因素
3.1.1 衰弱与多重用药、多病共存 本研究发现,多病共存和多重用药是衰弱的危险因素,这与既往多项相关研究结果一致[7-8]。衰弱与多病共存之间可能存在双向因果关系,衰弱可能使人易患多种慢性疾病,但衰弱也可能源于多种疾病并存[8]。积极防治慢性病、强调个体化用药、减少不必要的口服药物是预防或延缓衰弱的有效途径。
3.1.2 衰弱与睡眠 本研究发现,睡眠质量差是衰弱的危险因素之一。先前研究也证实,睡眠障碍与衰弱具有显著相关性[9-10]。一项纵向研究表明,睡眠质量差会导致抑郁和体力活动减少,增加不良健康后果的发生风险,从而引发身体衰弱[11];睡眠障碍引起的昼夜节律紊乱可能导致免疫系统失调,全身炎症因子水平增高[12];此外,睡眠障碍会使生长激素、胰岛素样生长因子1(IGF-1)和睾酮等激素的分泌减少,加速肌肉蛋白水解,从而导致肌肉减少和衰弱[9]。由此可见,医护人员应将睡眠障碍的诊断和治疗纳入预防老年患者衰弱的干预措施中。
3.1.3 衰弱与营养状况 单因素分析结果显示,血清白蛋白、上臂围及小腿围在不同衰弱水平的患者中存在差异,提示衰弱老年患者存在营养不良。随着人口老龄化,营养不良在老年人群中的比例越来越高[13]。由于胃肠功能衰退、牙齿状况较差(本研究发现牙齿状况是衰弱发病影响因素之一)、味蕾数量减少等生理变化,使得老年人在食物摄取、吸收方面受到影响,久之容易造成营养不良。长期蛋白质和能量摄入不足会导致与年龄相关的肌肉质量和肌肉功能逐渐丧失,可能造成肌力低下、低体质量和疲惫感[14]。另一方面,衰弱患者本身可能合并多种慢性病,疾病消耗自身能量且对日常饮食产生负面影响,也会影响营养状况。
3.1.4 衰弱与下肢运动功能及平衡能力 本研究多因素Logistic 回归分析显示,30 s 坐立个数多、单腿直立时间长是衰弱的保护因素,即下肢骨骼肌运动功能和躯体平衡能力良好的老年患者发生衰弱的风险较小。国外研究报道,下肢功能和平衡能力能够预测老年人未来失能的风险,对衰弱前期及无衰弱老年患者进行下肢功能和平衡能力检测,可以预防更多的老年人发生失能[15]。本研究结果显示,与≥3 次/周的有氧运动相比,每周≤1 次的有氧运动是老年人发生衰弱的危险因素。世界卫生组织于2020 年发布了关于体力活动和久坐行为的指南[16],强烈建议老年人每周进行3 d 或以上的多成分体育活动,强调功能平衡、强度适中或更高强度的力量训练,以增强身体功能,预防跌倒。
3.2 衰弱与骨质疏松症 本研究对不同衰弱水平的患者进行骨密度测量,结果显示衰弱患者的股骨颈骨密度T 值、腰椎骨密度T 值明显低于衰弱前期患者和无衰弱患者。同时,对合并骨质疏松症患者和非骨质疏松症患者进行分析发现,骨质疏松症老年患者衰弱和衰弱前期发生率、Freid 量表得分高于非骨质疏松症老年患者,步速和握力水平低于非骨质疏松症老年患者,提示合并骨质疏松症的老年患者发生衰弱的可能性更大,这与既往国外研究结果一致[17]。多因素Logistic 回归分析结果也显示,骨质疏松症与衰弱显著相关,合并骨质疏松症是老年患者衰弱的危险因素。分析可能的机制:衰弱和骨质疏松症有共同的危险因素和生物学途径。高龄、肌肉减少症、缺乏运动、营养不良、跌倒、认知功能减退是两病共同的危险因素[18]。骨质疏松症以骨密度降低、骨骼脆性增加为特征,脆性骨折是常见的并发症,骨折通常伴随着住院治疗、长期卧床、生活质量严重下降、失能等。骨质疏松症患者大都伴有自觉疲乏感和低体质量,容易进展成衰弱状态。此外,骨质疏松症患者存在害怕跌倒的心理[19],限制了患者参加户外活动,运动量不足可导致下肢肌力和平衡功能减退,使发生跌倒、骨折甚至失能的风险增加。
IGF-1 是调节骨代谢的重要因子,通过参与骨重建影响骨密度。有研究显示,低血清IGF-1 水平与老年人的衰弱程度独立相关[20]。IGF-1 对肌肉质量和力量有显著影响,随着年龄增长,血清IGF-1 水平降低,使肌肉质量和力量下降,逐渐发展为衰弱[21]。炎症标志物如C 反应蛋白和白细胞介素6 也与衰弱、骨质疏松症有关[22-23]。研究表明,炎症是影响骨质丢失的重要因素;同时,炎症也被认为是衰弱发生的潜在机制[24]。有学者发现,老年人白细胞介素6 水平升高与身体表现差和肌肉无力有关,并可以预测残疾的发生[25-26]。
综上,多病共存、多重用药、睡眠质量、牙齿状况、运动频率、血清白蛋白、小腿围、30 s 坐立个数、单腿直立时间是老年患者衰弱发病的影响因素;骨质疏松症是老年住院患者衰弱发病的危险因素,积极预防或治疗骨质疏松症对于延缓甚至逆转衰弱意义重大。然而,本研究样本量较小,且采用方便抽样进行样本抽取,使得样本代表性受到局限,未来需要更多高质量的证据进一步阐明衰弱与骨质疏松症之间的关联。

