Duchenne型肌营养不良合并认知功能障碍发病情况及预测模型构建
茹凉,阿尔孜古丽·艾买提,刘硕,汪川靖,翟如玉,马晓霞,叶力阿曼·加依拉吾,严媚
1 新疆医科大学第一附属医院儿科中心,乌鲁木齐 830054;2 新疆医科大学儿科学院
Duchenne 型肌营养不良(DMD)是一类X 连锁隐性遗传性肌肉病[1]。DMD 主要由抗肌萎缩蛋白(Dystrophin)基因突变引起,造成Dystrophin 表达缺失,使得肌细胞膜稳定性受影响,呼吸肌及心肌受累,引起呼吸功能不全或心功能不全而死亡[2]。Dystrophin 表达缺失不仅累及骨骼肌、心脏和呼吸肌,也可累及中枢神经系统[3]。近1/3 的DMD 患者可出现中枢神经系统损伤,涉及感知功能损害[4-5]、认知功能损害、阅读障碍,引起注意力不足/多动症、孤独症等神经行为学和心理学异常[6-7]。目前对认知功能与年龄的关系研究较多,但多数结论不一致[8-9]。炎症反应参与了DMD 肌肉损害的病理生理过程,在DMD 发病中起关键作用,但炎症反应是否与DMD 患儿认知功能障碍的发病有关,目前尚未明确。本研究调查了DMD 患儿合并认知功能障碍的现况,探索炎症、免疫指标变化与DMD 患儿认知功能障碍发生的关系,建立DMD 合并认知功能障碍的预测模型,为DMD 合并认知功能障碍的预测和诊断提供参考。
1 资料与方法
1.1 研究对象 选择2019 年6 月—2021 年6 月在新疆医科大学第一附属医院儿科病房住院、经基因检测或肌肉活检诊断为DMD 的0 ~ 14 岁患儿38 例纳入研究。患儿男36 例、女2 例,年龄1 ~ 12 岁,<6岁7 例、≥6 岁31 例,符合DMD 临床诊断标准[10],民族不限。排除存在精神病及其他神经遗传性疾病病史者,入组前合并全身其他严重器质性疾病者,入组时有急性炎症性疾病或感染性疾病、CRP≥10 mg/L者,入组前已使用糖皮质激素治疗者,有凝血功能障碍者,依从性差、不能完成临床试验者。本研究获得医院医学伦理委员会审批(伦理审批号K202202-17),并得到本人和(或)监护人的知情同意。
1.2 认知功能障碍判定 <6 岁患儿进行格赛尔发展量表检测,评估患儿动作能、应物能、言语能、应人能4 个方面的能力,计算发育商(DQ),将DQ<75 分判定为认知功能障碍[11]。≥6 岁患儿进行韦氏儿童智力量表第Ⅳ版检测,分析言语智商(VIQ)、操作智商(PIQ)及总智商(FSIQ),将FSIQ<70分判定为认知功能障碍。
1.3 DMD 合并认知功能障碍影响因素筛选及分析 收集并比较认知功能障碍患儿和认知功能正常患儿的DMD 疾病严重程度(分为症状前期、早期独走期、晚期独走期、早期不能独走期、晚期不能独走期[10])、Dystrophin 基因突变检测结果(突变类型、突变位点、突变外显子数)、肌酶和肝脏酶指标[肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、AST、ALT]检测结果、炎症因子指标[白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、白细胞介素10(IL-10)]检测结果、免疫学指标[免疫球蛋白E(IgE)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3]检测结果。采用SPSS25.0 软件进行统计分析。符合正态分布的计量资料以±s表示,两组比较采用t检验,多组比较采用方差分析、组间两两比较采用LSD检验;不符合正态分布的计量资料以M(P25,P75)表示,采用秩和检验。计量资料比较采用Fisher 确切概率法。相关性分析采用Spearman 秩相关分析法。纳入单因素分析差异有统计学意义的变量,采用Logistic 回归分析进行多因素分析。P<0.05 为差异有统计学意义。
1.4 DMD 合并认知功能障碍预测模型的构建及验证 根据DMD 合并认知功能障碍影响因素分析结果,采用R4.0.0软件及其“rms”“ROCR”“rmda”包绘制列线图,构建DMD 合并认知功能障碍的预测模型。采用列线图校正曲线和受试者工作特征(ROC)曲线评估模型的预测效能。采用临床决策曲线用于辅助决策。
2 结果
2.1 DMD 合并认知功能障碍发生情况 38例患儿合并认知功能障碍13 例(≥6 岁11 例、<6 岁2 例)、认知功能正常25 例(≥6 岁20 例、<6 岁5 例),认知功能障碍发生率为34.21%。≥6 岁的31 例患儿中,合并轻度认知功能障碍10例、中重度认知功能障碍1例;<6岁的7例患儿中,合并轻度、中重度认知功能障碍各1例。
2.2 DMD 合并认知功能障碍的影响因素 合并认知功能障碍的DMD 患儿症状前期1 例、早期独走期2 例、晚期独走期7 例、早期不能独走期1 例、晚期不能独走期2例,认知功能正常患儿分别为3、13、6、2、1例。合并认知功能障碍的DMD患儿基因突变类型为缺失突变6例、重复突变2例、点突变3例,突变位点为近端6 例、远端2 例,突变外显子数为26 个;认知功能正常患儿分别为16、1、2、7、10例和24个。认知功能正常与认知功能障碍DMD 患儿的疾病严重程度、基因突变类型、基因突变位点差异无统计学意义(P均>0.05)。本组大片段(总计1 个及以上外显子)缺失或重复患儿25 例,其累及外显子数量最少为1 个外显子,最长为34 个外显子。FSIQ 水平与突变外显子数无相关性(r=0.224,P=0.324)。DMD 合并认知功能障碍患儿血清IL-6、TNF-α 水平高于认知功能正常患儿,AST 水平低于认知功能正常患儿(P均<0.05)。见表1~3。将是否合并认知功能障碍作为因变量(是=1,否=0),将AST、IL-6、TNF-α 等作为自变量,进行Logistic 回归分析,结果显示,IL-6(OR=1.170,95%CI1.029 ~ 1.423)、TNF-α(OR=1.427,95%CI1.149 ~ 2.018)是DMD 合并认知功能障碍发病的危险因素。
表1 认知功能障碍与认知功能正常DMD患儿年龄及血清IL-10、IgM、C3水平比较(± s)

表1 认知功能障碍与认知功能正常DMD患儿年龄及血清IL-10、IgM、C3水平比较(± s)
认知功能情况n C3(g/L)0.82 ± 0.16 0.80 ± 0.18认知功能障碍认知功能正常13 25年龄(岁)8.51 ± 2.37 7.00 ± 2.51 IL-10(pg/mL)4.76 ± 1.47 4.19 ± 1.41 IgM(pg/mL)1.12 ± 0.29 1.28 ± 0.52

表2 认知功能障碍与认知功能正常DMD患儿血清CK、CK-MB、ALT、AST比较[U/L,M(P25,P75)]

表3 认知功能障碍与认知功能正常DMD患儿血清IL-6、TNF-α、IgE、IgG比较[pg/mL,M(P25,P75)]
2.3 DMD 合并认知功能障碍预测模型的构建及验证结果 根据AST、IL-6、TNF-α 建立DMD 合并认知功能障碍的预测模型,见图1。每个变量值有相应得分,根据各变量得分之和,计算出总得分,对应认知功能障碍的患病概率。预测模型列线图校正曲线见OSID 码图1,校准曲线贴近标准曲线,表明列线图模型构建尚可,该模型在临床预测中有一定的稳定性。该模型预测DMD 合并认知功能障碍的ROC曲线下面积为0.948(>0.8),具有较好的预测能力(OSID 码图2)。临床决策曲线结果显示,当阈值概率为5% ~ 100%时对人群进行临床干预后可能受益(OSID码图3)。
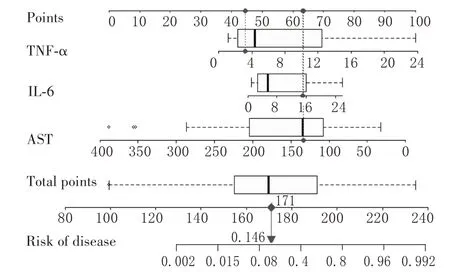
图1 基于血清AST、IL-6、TNF-α水平综合得分预测DMD合并认知功能障碍的列线图
3 讨论
DMD 除了肌肉进展性损害,还会产生注意缺陷、多动障碍、自闭症谱系功能障碍等多种认知及行为问题。既往研究指出,DMD 患者远端Dystrophin亚型丢失量与其发生认知功能障碍的概率及认知功能障碍严重程度呈正相关[12-13]。最近研究表明,Dystrophin 基因远端突变的患者FSIQ 得分低于全长Dystrophin基因缺失的突变患者;患者并发认知功能障碍的风险和严重程度与Dystrophin 基因远端突变基因产物的累积丢失有关,而其中Dp140和Dp71受累者风险更高。
本研究中,<6 岁的DMD 患儿适应性DQ 低于同龄正常儿童,语言能力的受损程度较社会行为能力更严重。而≥6 岁的患儿FSIQ、VIQ、PIQ 得分较人群常模得分降低,与以往研究结果相符;患儿言语智力和操作智力水平基本持平。本组DMD 合并认知功能障碍总发生率为34.21%,与国外研究结果一致[9]。而国内一项研究结果显示DMD 合并认知功能障碍发生率为20.31%[11],本研究数据高于国内平均水平,分析原因:①本研究多数患儿来自州、县、乡级地区,普通话水平较差,受教育程度低;②多数患儿就诊时肌肉损害较严重,已影响患儿运动能力及社交能力;③多数为少数民族患儿,与医师言语沟通可能存在一些理解偏差,导致评分偏低;④样本量偏少,也可能导致结果存在差异。
在了解DMD 患儿认知功能障碍发生情况的基础上,本研究进一步分析DMD 疾病严重程度和Dystrophin 基因突变情况与DMD 合并认知功能障碍的关系,结果显示,DMD 疾病严重程度、基因突变类型、基因突变片段长短与认知功能障碍发生均无关联,这与FLORENCIA 等[4]的研究结果相似,但不能排除因样本量少、样本代表性有限对结果的影响。本研究尚未发现Dystrophin 基因突变位点与认知功能障碍的相关性,这与既往研究结果存在差异,仍需加大样本量进一步研究,也可根据患儿年龄分布,分别研究总FSIQ、DQ与基因突变位点之间的关系。
本研究单因素分析结果显示,认知功能正常的DMD 患儿血清IL-6、TNF-α 水平高于认知功能障碍患儿,血清AST 水平低于认知功能障碍患儿。多因素分析发现,血清IL-6、TNF-α 水平是DMD 合并认知功能障碍的影响因素。根据影响因素分析结果筛选的3 个变量(AST、IL-6、TNF-α)建立DMD 合并认知功能障碍风险预测模型,稳定性及预测能力较好,当阈值概率为5%~100%时对人群临床早期识别及干预可能收益。本研究所构建模型对临床工作中预测DMD合并认知功能障碍具有一定参考价值。
总之,本研究发现,DMD 患儿合并认知功能障碍发生率约34.21%。在对DMD 患儿进行管理时,必须重视患儿认知功能评估,以便早期发现认知功能异常并及早实施针对性的干预与护理措施,改善患儿生活质量。认知功能障碍发生与患儿年龄、肌肉受损的严重程度、基因突变类型、突变外显子数目、突变位点均无相关性。血清IL-6、TNF-α 水平可能是DMD 合并认知功能障碍发生的危险因素。本研究建立的DMD 合并认知功能障碍预测模型为早期预测及干预DMD 合并认知功能障碍提供了依据。但本研究纳入样本量较小,多因素分析纳入因素较少,该模型的确切效能、成本效果及患者和医生的接受程度仍需后期验证,未来还可开展多中心的前瞻性队列研究,以探索更适用的预测工具。

