子宫内膜中肾腺癌1例及文献复习
李秀凤 刘德美 韩 凯 李云婷 张云香
潍坊市人民医院病理科,山东 潍坊 261042
中肾管或沃尔夫(wolf)管在胚胎期与苗勒管平行,胚胎发育过程中雌性的中肾管退化,其残余物通常可以沿着子宫颈、阴道和附件残留。因此,中肾管腺癌大多出现在子宫颈、阔韧带、输卵管系膜和卵巢门,子宫体处非常少见,查阅既往文献,仅描述了33 例[1],且以个案报道为主。本文报告了1 例发生于子宫体的中肾腺癌病例的临床、病理及分子学特征,并进行了相关文献复习。
1 临床资料
1.1 一般资料
女性,58 岁,绝经8 年,无明显诱因出现阴道出血20 d。妇科彩超示:宫腔内探及4.3 cm × 2.0 cm稍高回声,与肌层分界不清,内可见血流信号。肿瘤标志物:甲胎蛋白(alpha fetoprotein,AFP)、糖类抗原125(carbohydrate antigen 125,CA125)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)均在正常范围。行分段诊刮术,病理回报(子宫内膜)腺癌,分化差,结合免疫组化倾向宫颈腺癌。排除手术禁忌证后,行经腹广泛全子宫切除,双侧输卵管、卵巢切除术、盆腔淋巴结清扫术和主动脉旁淋巴结清扫术。手术标本用10%中性福尔马林充分固定,经全自动脱水机进行脱水、透明,常规石蜡包埋、切片及HE 染色。采用SP法进行免疫组织化学染色,所用试剂均购自福州迈新公司和北京中杉公司,严格按试剂盒说明书进行。KRAS基因检测采用二代测序(next generation sequencing,NGS)方法,所用试剂盒购于厦门艾德生物有限公司,实验步骤严格按试剂盒说明书进行。
大体标本:宫体部内膜粗糙,面积约5 cm ×1 cm,切面灰白,质中,宫壁僵硬,宫颈管略粗糙,宫颈未见异常。双侧输卵管均长4.5 cm,直径0.4 cm,输卵管伞部可见。双侧卵巢切面实性,质中,双侧附件未见异常。
镜下观察:肿瘤的组织学形态呈多样性(图1),有实性片状(图1A)、腺管状(图1B)、乳头状(图1C)、筛状(图1D)及小管状(图1E),其中腺管状结构的部分腺腔内见嗜酸性分泌物(图1F)。肿瘤侵及宫体肌壁深肌层近浆膜,累及宫颈管内膜,且侵犯神经,脉管内见癌栓。术中腹腔冲洗液细胞学检查发现腺癌细胞,呈片状(图2A)或乳头状(图2B)。
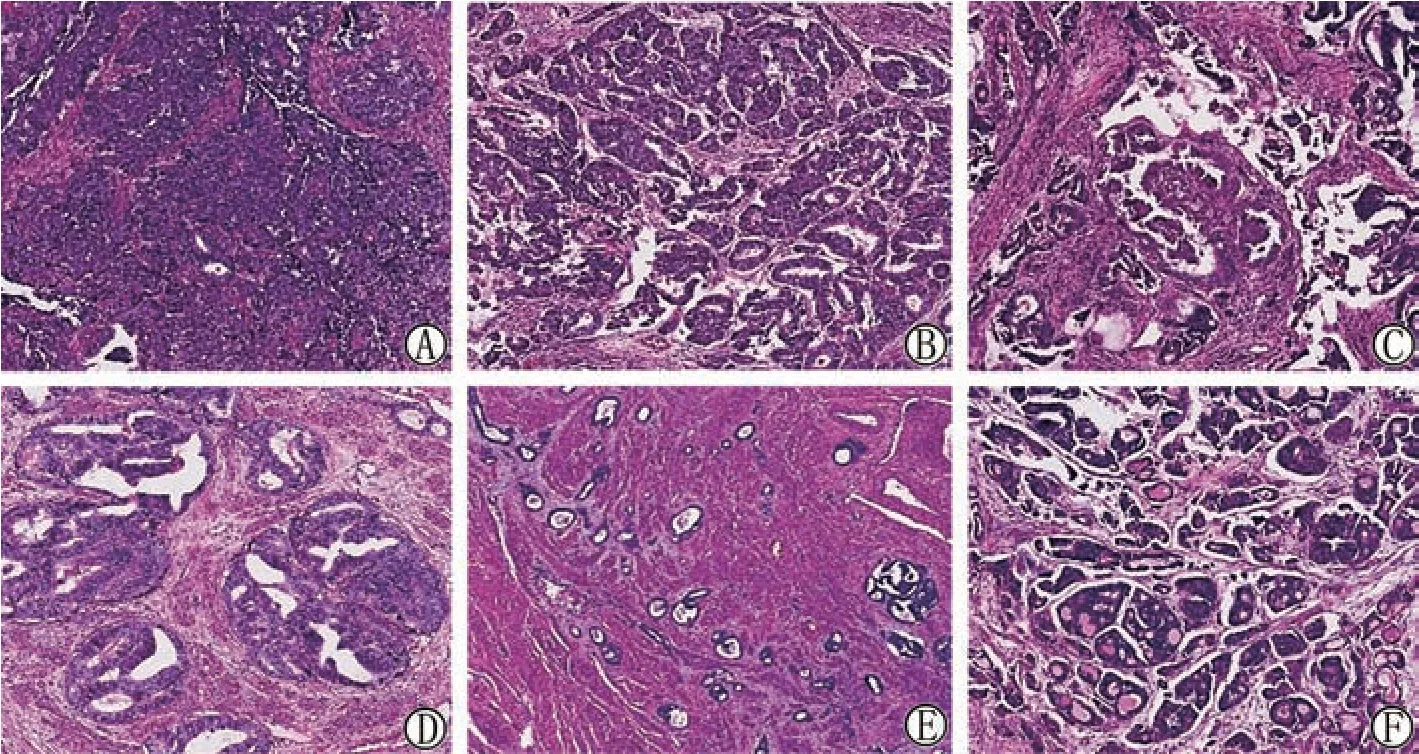
图1 子宫内膜中肾腺癌肿瘤组织镜下形态(HE染色,× 100)

图2 腹腔冲洗液中腺癌细胞巢团形态(HE染色,× 100)
免疫组织化学检查结果:肿瘤组织阳性表达CD10、PAX8、TTF-1 和 上 皮 膜 抗 原(epithelial membrane antigen,EMA),部分表达GATA-3、P16 和CK7;ER、PR、CK20、CDX2、NapsinA、CEA 的表达均为阴性,P53 表达呈野生型,错配修复蛋白(MLH1、MSH2、MSH6、PMS2)均阳性;Ki67阳性细胞约50%。详见图3。

图3 自子宫内膜中肾腺癌肿瘤组织中相关抗体的阳性表达情况(SP法,× 40)
KRAS基因检测结果显示,KRAS基因发生突变(c.183A > C p.Q61H)。
1.2 治疗及随访
患者经腹行广泛子宫 + 双附件 + 盆腔淋巴结清扫 + 腹主动脉旁淋巴结清扫术,术后先行“紫杉醇 + 卡铂”化疗2 周期,后进行盆腔放疗,因腹腔冲洗液中查见腺癌细胞,放疗期间及放疗后分别行“紫杉醇脂质体 + 卡铂“化疗1 周期”,随访至今20个月,患者病情稳定,未出现复发或转移。
2 讨 论
中肾管肿瘤是女性生殖道罕见的肿瘤,源于中肾管的残余。在常规子宫切除术中,20%的子宫颈可发现中肾管残余组织,因此,中肾腺癌通常发生在子宫颈,发病率占该部位所有恶性肿瘤的比例不足1%,很少发生在子宫体和卵巢[2],现将发生在子宫体的中肾腺癌总结如下。
2.1 临床特点
发生在子宫体的中肾腺癌与其他类型的子宫内膜腺癌的临床症状相似,以无明显诱因的子宫出血为主要症状,中位年龄为60岁(31 ~ 91岁),约半数患者发现时已处于晚期[(国际妇产科联合会(International Federation of Gynecology and Obstetrics, FIGO)分 期Ⅱ ~ Ⅳ期)],最常见的远处转移部位是肺[3-4]。
2.2 病理学特点
镜下肿瘤组织形态具有多样性,如小管状、腺管状、网状、实性、筛状、乳头状等,也可几种同时并存,最常见的是小管状和腺管状,管腔内充满嗜酸性物质,小管可以背靠背呈筛状或弥漫浸润生长。肿瘤细胞的异型性不大,核分裂像数目不一。肿瘤通常起源于子宫内膜,周围未见残余中肾管[5],通常侵及宫壁肌层,伴有脉管内癌栓[6]。在本例中肿瘤周围也未见中肾管残余,肿瘤侵及宫壁深肌层近浆膜面,脉管内亦查见癌栓。
文献报道,免疫组化标志物GATA-3 和TTF-1在诊断中肾腺癌中具有敏感性及特异性[7-8]。女性生殖道CD10 阳性(腔缘阳性),可以作为诊断中肾管残留及肿瘤的标志物,其他上皮性肿瘤CD10 阴性;另外PAX8亦是中肾管发育中重要的转录因子。因此,GATA3、TTF-1、CD10(腔缘阳性)和PAX8 的免疫组化可联合应用于中肾腺癌的诊断及鉴别诊断。在本例肿瘤组织中CD10(腔缘阳性)、PAX8、TTF-1表达阳性,GATA-3部分表达阳性。
研究发现,女性生殖道的中肾和中肾样癌的基因突变主要集中在KRAS 基因的12 号及13 号密码子[9],还 存 在ARID1A、PIK3CA、CTNNB1、TP53、MLL2和CDKN2A基因的突变[10]。在本病例中也存在KRAS 基因突变,突变位点为61 号密码子,这与以往的报道有所差别。既往的研究表明,KRAS 基因在17.89%的恶性实体肿瘤发生改变,KRAS Q61H 突变占所有恶性实体瘤的0.59%[11]。这从另一方面说明KRAS 基因61 号密码子的突变也可能发生在中肾腺癌中,但由于目前发现的中肾腺癌病例有限,还需要收集大样本资料对中肾腺癌中KRAS基因的突变情况进行分析总结。
2.3 鉴别诊断
2.3.1Ⅰ型子宫内膜癌 子宫内膜样癌的肿瘤细胞通常以腺管状、筛状及片状分布,需与该生长模式的中肾腺癌进行鉴别,前者常伴鳞化,浸润宫壁较浅,晚期出现浸润宫壁深层,后者通常浸润宫壁较深。免疫组织化学标志物ER、PR、Vimentin 在前者常呈阳性表达,而在中肾腺癌呈阴性。
2.3.2Ⅱ型子宫内膜癌 浆液性癌和透明细胞癌归为Ⅱ型子宫内膜癌,通常浸润宫壁较深。浆液性癌通常呈乳头状,可有或无砂粒体形成,有时呈腺样,细胞异型性明显,腺腔内没有嗜酸性物质,免疫组化WT-1 和P53 呈阳性表达,而中肾腺癌为阴性。透明细胞癌的肿瘤细胞呈透明状,鞋钉状,这与中肾腺癌的肿瘤细胞形态显著不同,且透明细胞癌的腺腔内也没有嗜酸性物质。透明细胞癌的免疫组化ER和PR多阳性,CDl0多阴性,HNF-1β在透明细胞癌中阳性较高,中肾腺癌未见阳性[12]。
2.3.3宫颈腺癌 颈管腺癌累及子宫内膜时需要与中肾腺癌鉴别,前者主要呈腺管状,管腔无嗜酸性物质,癌变区与颈管内膜及子宫内膜都有延续性。免疫组化ER、PR、CEA呈阳性表达,P16可弥漫阳性也可阴性,Vimentin、CD10均为阴性。
2.3.4子宫内膜间质结节及子宫内膜间质肿瘤两病变起源于子宫内膜间质,通常位于肌壁间,可累及或未累及子宫内膜,肿瘤细胞通常与间叶组织类似,故形态与中肾管癌易于区分。免疫组化CD10的表达方式也存在差异,在中肾腺癌CD10是腔缘阳性。
2.4 治疗及预后
虽然对于这种罕见病的最佳治疗尚无共识,但目前根治性手术被认为是局部病变的首选。该疾病恶性程度高,临床发现大都处于中晚期,手术后接受卡铂/紫杉醇化疗有一定疗效[2,13]。有关放疗在该病治疗中的作用有待于进一步探讨。因此类疾病大都存在KRAS基因突变,为今后应用针对KARS基因或其下游分子的靶向治疗提供了理论依据。
有关此类疾病的预后,Euscher 等[6]随访发现,肺是最常见的转移复发部位,中位无进展生存期为18.2 个月,中位总生存期为70.6 个月。本例患者术后接受了卡铂/紫杉醇化疗及放疗,目前随访20个月无瘤生存。总之,此类疾病的预后较差,需总结更多的病例为后续治疗提供依据。
利益冲突所有作者均声明不存在利益冲突

