混合型肝细胞癌-胆管癌的临床病理学特征及研究进展
葛轩云,张苗苗,黄炳银,李杜娟
混合型肝细胞癌-胆管癌(combined hepatocellular carcinoma and cholangiocarcinoma, cHCC-CCA)是在同一肿瘤中同时具有肝细胞与胆管细胞分化特征的原发性肝癌(primary liver cancer, PLC),其发病率占PLC的0.4%~14.2%[1-2]。cHCC-CCA可发生于肝硬化或非肝硬化背景中,预后介于肝细胞癌(hepatocellular carcinoma, HCC)与肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)之间[2-3],治疗首选手术完整切除。cHCC-CCA组织学形态除有HCC与ICC成分,还存在形态学介于两者之间的中间表型,其无特殊免疫表型,病理诊断具有挑战性。本文现就cHCC-CCA的术语更新及相关研究进展作一综述,旨在提高对该肿瘤的认识水平。
1 cHCC-CCA概念的提出及更新
1903年,Wells[4]首次报道并描述了cHCC-CCA,提出肝细胞与胆管细胞共同的胚胎学细胞为其起源。1949年Allen等[5]将已发表的同时具有肝细胞与胆管细胞表型的癌分为三种类型:(1)HCC与ICC两种肿瘤分界清楚,各自独立生长;(2)HCC与ICC在生长过程中融合;(3)来自同一起源的肿瘤同时具有HCC与ICC特点。1985年Goodman等[6]通过检测24例具有肝细胞与胆管上皮分化的肿瘤进行组织学分析,再次提出分型:(1)碰撞型肿瘤,HCC和ICC肿瘤成分相邻,随着生长不断增大而碰撞融合;(2)移行型肿瘤,同一肿瘤内HCC和ICC两种成分同时存在,彼此混合,并可见移行过渡;(3)纤维板层型肿瘤,肿瘤的肝细胞成分类似于纤维板层状HCC,但伴黏液分泌的假腺样结构。WHO(2010)消化系统肿瘤分类将cHCC-CCA分为经典亚型与具有干细胞特征的亚型(表1),提高了对cHCC-CCA的识别,而在随后的实践中逐步发现表达干细胞标记的PLC并非只有cHCC-CCA,HCC与ICC均可表达。2018年由肝脏病理学家、放射科医师、外科医师与临床医师共同商讨形成的共识推荐,将cHCC-CCA的诊断术语中不同组织成分及比例分别列出,如cHCC-CCA、混合型肝细胞癌-细胆管癌(combined hepatocellular carcinoma and cholangiolocarcinoma, cHCC-CLC)、混合型肝细胞癌-胆管癌-细胆管癌(combined hepatocellular carcinoma and cholangiocarcinoma with cholangiolocarcinoma, cHCC-CCA-CLC)、混合型肝细胞癌-胆管癌-中间细胞癌(combined hepatocellular carcinoma and cholangiocarcinoma with intermediate cell carcinoma, cHCC-CCA-INT)等,如观察到干/祖细胞特征时,可在诊断中指出“存在干/祖细胞特征”。WHO(2019)消化系统肿瘤分类标准不再强调干细胞的亚型,将cHCC-CCA定义为同一肿瘤中具有明确的肝细胞与胆管细胞分化的PLC。cHCC-CCA的病理诊断以组织形态学为主要标准,免疫组化为辅助诊断标准[7-8]。
2 细胞起源
cHCC-CCA的细胞起源尚不明确,有研究表明其可能为肝脏干/祖细胞(hepatic progenitor cells, HPC)或成熟肝细胞、胆管细胞起源。
2.1 HPC起源HPC生理情况下是位于肝脏Hering管的双能干/祖细胞,也称为卵圆细胞,属于成体干细胞,可以分化为成熟的肝脏细胞与胆管细胞,维持组织更新与损伤状态下的组织修复[9-10]。许多研究表明cHCC-CCA高表达HPC标记,如CD117、EpCAM、Nestin、CD56等[11-14]。研究显示经动脉化疗栓塞(transarterial chemoembolization, TACE)治疗导致的低氧环境增加HCC干细胞标记及纤维间质的表达,同时经TACE治疗后的HCC发生cHCC-CCA的频率增加[15-16]。总之,HPC在cHCC-CCA中发挥重要作用,并为其可能是起源细胞提供了线索(图1)。
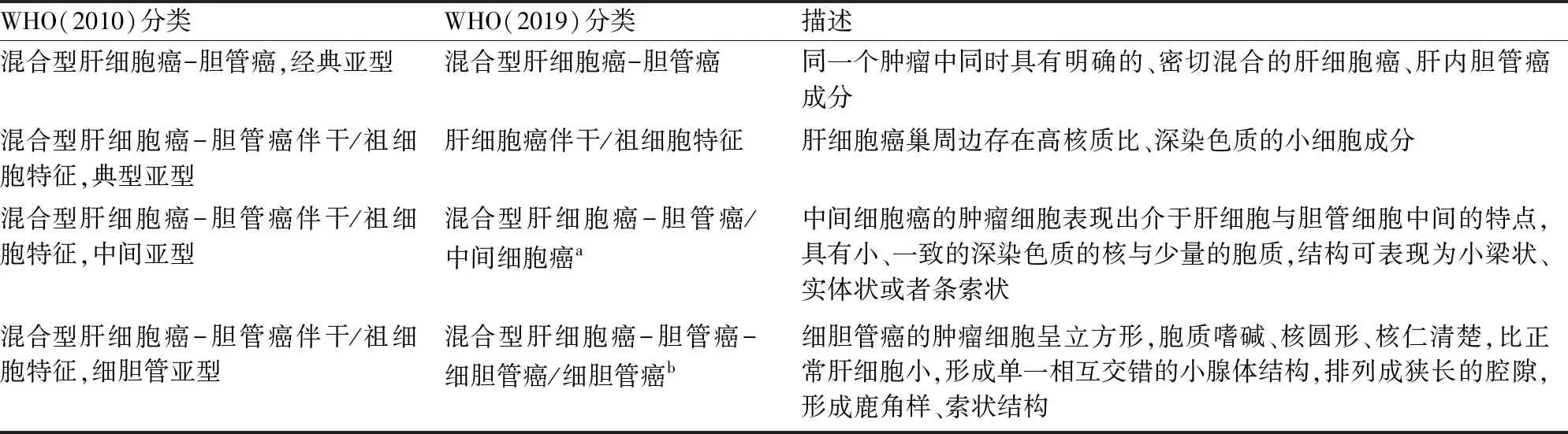
表1 WHO(2010 vs 2019)混合型肝细胞癌-胆管癌的不同分类及描述
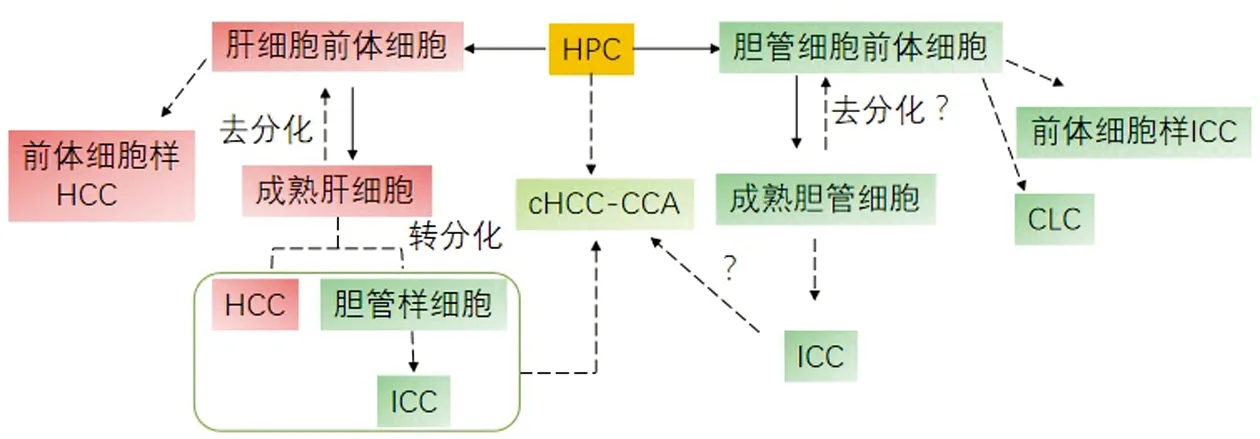
图1 混合型肝细胞癌-胆管癌的细胞起源
2.2 成熟肝细胞起源成熟肝细胞具有易塑性,可转分化为胆管上皮细胞并进一步发展为ICC[17](图1)。另外,p53通过sp1/3转录因子依赖方式对Nestin的转录抑制,限制肝癌细胞的可塑性与肿瘤发生,而TP53基因失活促进成熟肝细胞去分化为Nestin阳性的祖细胞样细胞获得谱系突变后产生PLC[18]。Nancy等[19]研究表明,cHCC-CCA的HCC样区域与ICC样区域均存在TERT、TP53、细胞周期蛋白等分子改变,这与HCC的分子改变相同。Akihiro等[20]在具有胆管表型的PLC中进行全基因组测序分析,结果显示慢性肝炎背景下的肿瘤类型基因组取代模式有60个与HCC重叠,而在肝炎阴性的肿瘤背景中与HCC不同。Xue等[13]对cHCC-CCA的分类根据Allen和Lisa分型进行研究,结果显示HCC样区域与ICC样区域拥有相似基因表达谱,且存在更多的异生物质代谢与胆汁酸代谢通路,这与HCC更相似。成熟肝细胞的易塑性为cHCC-CCA起源提供理论基础,并在临床研究中进一步得到证实。
2.3 胆管细胞起源目前,胆管细胞起源的cHCC-CCA研究较少,且缺乏基础实验作为支持,尽管Cazals-Hatem等[21]研究表明cHCC-CCA可能在遗传学上更接近于胆管癌,但由于病例数较少仍存在争议(图1)。
3 临床特点
近年cHCC-CCA的发病率逐年增加,其临床症状不典型,通常伴腹部疼痛、纳差、黄疸、发热等症状。根据SEER数据库对2000~2014年cHCC-CCA病例的流行病学研究发现,发病率增加3.84%,中位年龄62.6岁,以男性和白种人居多。cHCC-CCA的1、5年生存率分别为41.9%、17.7%,中位生存期为8个月[22-23]。cHCC-CCA无独特的影像学特点,与HCC或ICC相似或介于两者之间,治疗主要参照HCC,有手术切除、肝移植术、TACE、放疗、免疫调节治疗、联合治疗、系统治疗等。目前,手术完整切除仍然是治疗首选。临床研究显示,cHCC-CCA的手术切除预后比HCC差,与ICC相似或更差[24];肝移植术与手术切除效果相似,早期肝移植可使患者获益[25]。由于cHCC-CCA存在低血流供应,使其TACE效果不如HCC显著[26];对于不能手术切除的进展期患者,索拉菲尼治疗与细胞毒性药物化疗效果差异无统计学意义[27];免疫调节治疗可能为cHCC-CCA患者带来新的曙光[28]。
WHO(2019)消化系统肿瘤分类中cHCC-CCA与ICC采用相同的TNM分期,肿瘤最大径、单发/多发肿瘤、血管浸润、淋巴结/远处转移是重要的分期标准[8]。研究显示,肝脏储备功能差、无HBV感染、疾病晚期与低肿瘤内浸润淋巴细胞是预后不良的重要因素。当TNM分期处于Ⅲ/Ⅳ期时,cHCC-CCA与HCC、ICC的无进展生存期和总生存期差异无统计学意义[2]。临床血清学检测中,AFP升高多见于HCC,CEA、CA199升高多提示为ICC,cHCC-CCA可同时发现AFP、CEA、CA199血清学标记升高。有研究表明,CEA的血清水平是影响cHCC-CCA预后的独立性因素[29-30]。
4 病理特征
cHCC-CCA大体检查需对不同质地、颜色的肿瘤区域进行充分取材,镜下确认是否为cHCC-CCA及HCC、ICC成分在肿瘤中的占比。有学者建议以两种肿瘤成分占比分别≥30%作为cHCC-CCA病理诊断标准。目前尚无统一标准。因此,建议在cHCC-CCA病理诊断时对两种肿瘤成分的比例加以标注,以供临床评估肿瘤生物学特性和制定诊疗方案时参考。镜下cHCC-CCA组织学形态可由HCC、ICC、细胆管癌、中间细胞癌成分组成,各成分比例不定,可相互混合或移行。HCC成分主要有粗梁型、假腺样、小梁状、实性模式,常常多种组织学亚型同时存在,细胞形态有透明细胞样、脂肪变性、气球样变等,嗜酸性胞质丰富。ICC成分常形成腺管样结构,细胞呈立方形,圆/椭圆形核,纤维结缔组织将腺管样结构分隔开。细胆管癌的瘤细胞呈立方形,胞质嗜碱、核圆形、核仁清楚,比正常肝细胞小,形成单一相互交错的小腺体结构,排列成狭长的腔隙,呈鹿角样、索状结构。中间细胞癌的瘤细胞异型性小,小卵圆形,核浓染,呈小梁状、实体状或条索状,细胞巢可由多量纤维结缔组织分隔,无黏液分泌,同时具有肝细胞与胆管细胞的中间特征,免疫表型可同时表达肝细胞与胆管细胞分化标志[1,7]。Motoko等[31]研究表明cHCC-CCA中的中间细胞癌成分在肿瘤内占比与肿瘤最大径及HCC分化程度呈正相关,可能表现出肿瘤更强的侵袭性,而细胆管癌在肿瘤内占比与肿瘤最大径及HCC分化程度呈负相关,可能与肿瘤的低级别相关。肝细胞分化成分标记通常有Hepatocyte、Glypican-3、Arginase-1、AFP、CD10、polyclonal CEA、白蛋白RNA原位杂交,胆管细胞分化成分标记有CK7、CK19、EMA,干/祖细胞标记有CK19、CD56、CD117、EpCAM、Nestin、SALL4、OCT4[32]等。Hepatocyte在高分化HCC中比Arginase-1敏感,AFP在高分化HCC中通常阴性,EMA表达模式为小胆管型ICC或细胆管癌中腔缘阳性,大胆管型表现为胞质阳性。
cHCC-CCA鉴别诊断:(1)硬化型HCC:肿瘤由肝细胞分化成分组成,部分肿瘤细胞表现为细胞小、核深染,往往有丰富的纤维基质,免疫组化标记Arginase-1和Glypican-3阳性,同时腺癌标记部分阳性,组织形态学无腺管分化区域。(2)纤维板层型HCC:多发生于青年人,非肝硬化背景,患者多数预后好。肿瘤在镜下排列成板层状结构的纤维围绕肿瘤性肝细胞,细胞呈多角形、胞质重度嗜酸性,胞质内可见“苍白小体”。(3)ICC:主要与小胆管型ICC鉴别,后者免疫组化标记CD56、CK7、CK19、EMA阳性,无肝细胞分化区域。由于cHCC-CCA中的HCC分化区域腺样标记可能阳性且肝细胞标记阴性,此时需以组织学形态为主要诊断标准,当观察到肿瘤内存在梁状、实性巢状等生长方式,细胞胞质嗜酸或透明、胆汁分泌等肝细胞分化特征同时伴腺管分化时,应诊断为cHCC-CCA。(4)转移性腺癌:通常具有原发部位的独特免疫组化标记,其中需注意肝样腺癌,原发部位多位于消化系统,易转移至肝脏,常同时伴肝样分化与普通腺癌成分,免疫组化标记AFP、Glypican-3、SALL4、CK19等阳性。
5 分子病理学特征
近年,分子病理学发展迅速,各种分子标记用于肿瘤的诊断与预后预测。cHCC-CCA的分子病理研究主要通过全外显子测序、全基因组测序、二代测序及RNA测序等方式获得基因表达谱阐明其克隆起源、信号通路、分子标记。
TGF-β、Wnt/β-catenin和Notch信号是cHCC-CCA激活的主要信号,TGF-β信号通路的激活与胆管癌样区域形成纤维基质相关,也促进了成熟肝细胞通过转分化机制形成胆管上皮系统,Wnt/β-catenin通路的激活与cHCC-CCA胆管分化形态学密切相关,Notch信号活化认为是在肝损伤时导致成熟肝细胞转分化为胆管样细胞,进而成为胆管样癌的因素[33-35]。目前,cHCC-CCA的基因改变尚未完全阐明,不同的研究表现出与HCC或ICC相似的基因/分子遗传学改变,包括3p与14q染色体的杂合性缺失、TP53基因失活、KRAS突变、IDH1/2突变、ARID1A突变、TERT启动子突变、CCND1、CCNE1等[13,19-20]。
6 总结与展望
该文回顾了cHCC-CCA的命名与更新、细胞学起源、临床病理学特征、分子特征及相关研究进展,提示cHCC-CCA为具有独特生物学特征的PLC。虽然cHCC-CCA的细胞学起源尚存争议,但是其单克隆起源已被多个研究证实,区别于多克隆起源的碰撞瘤。因此,临床工作中需要关注此类肿瘤,为进一步阐明其分子特征及靶向治疗提供依据。
多项研究显示cHCC-CCA比HCC更具侵袭性,其有更高的微血管浸润和淋巴结转移率,预后介于HCC与ICC之间。WHO(2019)消化系统肿瘤分类中建议将cHCC-CCA的TNM分期采用ICC分期系统,而在日常工作中cHCC-CCA不同成分的组织学亚型、比例、分化程度、生长方式等病理学特征均存在较大差异,其生物学行为、临床预后、TNM分期等需要积累更多病例进一步分析。

