肝细胞癌中Semaphorin5A及Ki-67的表达及其临床意义
姜晨霞,章小霞,张 曙,王 燕
肝癌是人类常见的肿瘤,全球每年新增病例超过84万例,死亡超过8万例[1]。其中75%~80%的患者属于肝细胞癌(hepatocellular carcinoma, HCC),其破坏力强,5年总生存率低[2]。目前,HCC主要的治疗方式仍为手术切除,术后的转移率及复发率较高[3]。信号素(semaphorin, SEMA)也称为神经引导分子,可调节轴突的功能活动。SEMA5A作为SEMA家族的成员之一,在多种病理、生理过程中发挥重要作用[4],既可控制细胞迁移、导向轴突生长锥,还在机体免疫、血管生成及肿瘤细胞的生长、转移等过程中发挥作用[5]。研究表明,SEMA5A在多种肿瘤中具有促进和抑制肿瘤的双重作用[6]。文献报道肝脏中SEMA5A、TNNT3和HOXA5等被归类为差异甲基化基因,有望成为肝组织特异性的生物学标志物[7]。目前,SEMA5A在人HCC中的表达、Ki-67的关系及其临床意义国内尚未有报道。本文检测神经导向分子SEMA5A及Ki-67在HCC中的表达,探讨两者的相关性及其对HCC恶性生物学行为及患者预后的影响,为临床与病理医师提供参考。
1 材料与方法
1.1 临床资料收集2009年8月~2012年12月南通大学附属医院收治的168例HCC组织及相应癌旁正常组织(癌旁>2 cm),其中男性128例,女性40例;年龄26~81岁,平均(55.25±11.07)岁。纳入标准:病理均证实为HCC;均未伴发其他恶性肿瘤及严重的基础性疾病;术前未行任何抗肿瘤治疗等。患者的临床及病理资料均完整,可经电话等追踪随访,无失访(截至日期2017年12月31日)。TNM分期采用国际癌症控制联盟(UICC)以及美国癌症联合委员会(AJCC)推荐的第8版TNM分类。本实验经南通大学附属医院伦理委员会批准,患者或家属均签署知情同意书。
1.2 生物信息学分析利用UALCAN数据库(http://ualcan.path.uab.edu/analysis.html)中的“TGCA Gene analysis”,分析SEMA5A基因在HCC中的表达,利用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)分析其表达与HCC患者总生存率的关系。
1.3 免疫组化标本均经10%中性福尔马林固定,石蜡包埋,常规4 μm厚连续切片,附于载玻片上,经65 ℃烤片1.5 h。鼠抗人SEMA5A、Ki-67一抗及HRP标记二抗,均购自美国Invitrogen公司。免疫组化EnVision法试剂盒,购自北京中杉金桥公司。用PBS代替一抗作为阴性对照。
1.4 结果判断SEMA5A蛋白定位于细胞质和(或)细胞膜,Ki-67蛋白定位于细胞核,以呈棕黄色或黄褐色颗粒为阳性。两位高年资病理医师采用双盲法进行判断。SEMA5A蛋白的判读标准:随机选取热点区5个高倍视野(×400),根据阳性细胞染色程度和阳性细胞百分比进行评分。(1)根据阳性细胞染色程度计分:未着色为0分、浅黄色为1分、浅褐色为2分、褐色为3分;(2)根据阳性细胞百分比计分:阳性细胞数<5%为0分、5%~25%为1分、26%~50%为2分、>50%为3分。将两项评分相加:0~3分为低或不表达,4~6为高表达。Ki-67蛋白判读标准:高倍镜下随机选取10个视野,每个视野计数100个细胞,计算阳性细胞占镜下细胞的百分比,阳性细胞数≥10%为高表达,﹤10%为低或不表达。

2 结果
2.1 生物信息学分析UALCAN数据库分析显示:HCC(n=371)中SEMA5A 基因表达量低于正常肝组织(n=50),差异有统计学意义(P=4.875500E-02,图1A)。Kaplan-Meier Plotter数据库分析显示:SEMA5A高表达组患者的总生存率高于低或不表达组患者(HR=0.64,P=0.01,图1B)。上述结果提示SEMA5A在HCC中表达量低,且与患者的生存率呈正相关。
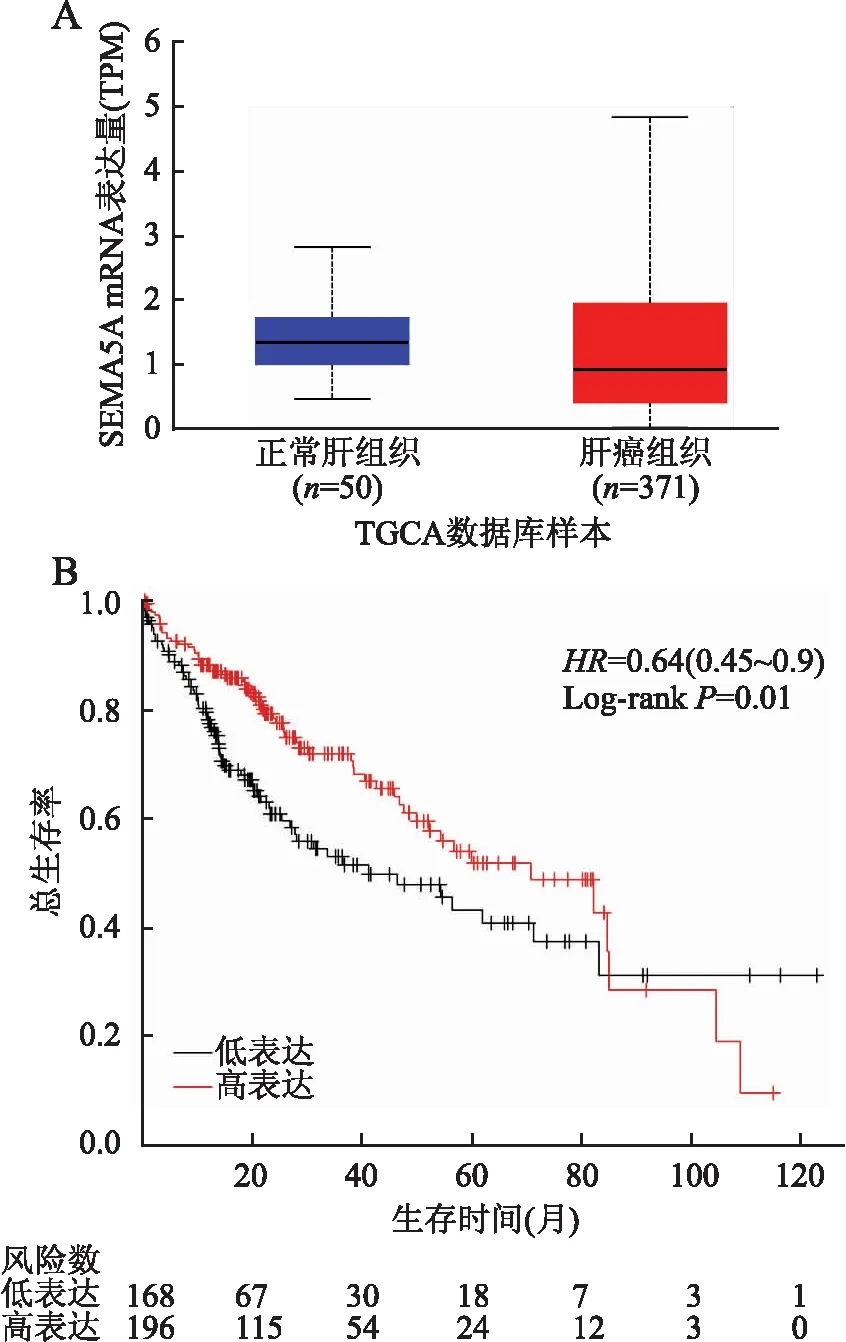
图1 SEMA5A在肝细胞癌中的生物信息学分析:A.UALCAN数据库分析SEMA5A基因在肝细胞癌中的表达;B.Kaplan-Meier Plotter数据库分析SEMA5A表达与肝细胞癌患者的关系
2.2 HCC、癌旁正常组织中SEMA5A、Ki-67的蛋白表达HCC的病理切片镜下显示:正常的肝组织结构破坏,癌细胞为圆形或多角形,呈巢状或者条索状排列,索间有丰富的血窦,细胞核大、深染,核仁明显(图2A)。癌旁肝组织结构正常,细胞未见明显异型(图2B)。
免疫组化显示:在HCC组织中SEMA5A蛋白表达降低,Ki-67表达增高(图3)。HCC中SEMA5A蛋白的高表达率为44.6%(75/168),低于癌旁正常组织(70.2%,118/168),差异有统计学意义(χ2=22.510,P<0.001,表1)。Ki-67在HCC中的高表达率为72.0%(121/168),高于癌旁正常组织(40.5%,68/168),差异有统计学意义(χ2=33.971,P<0.001,表1)。

表1 肝细胞癌、癌旁正常肝组织中SEMA5A蛋白的表达[n(%)]
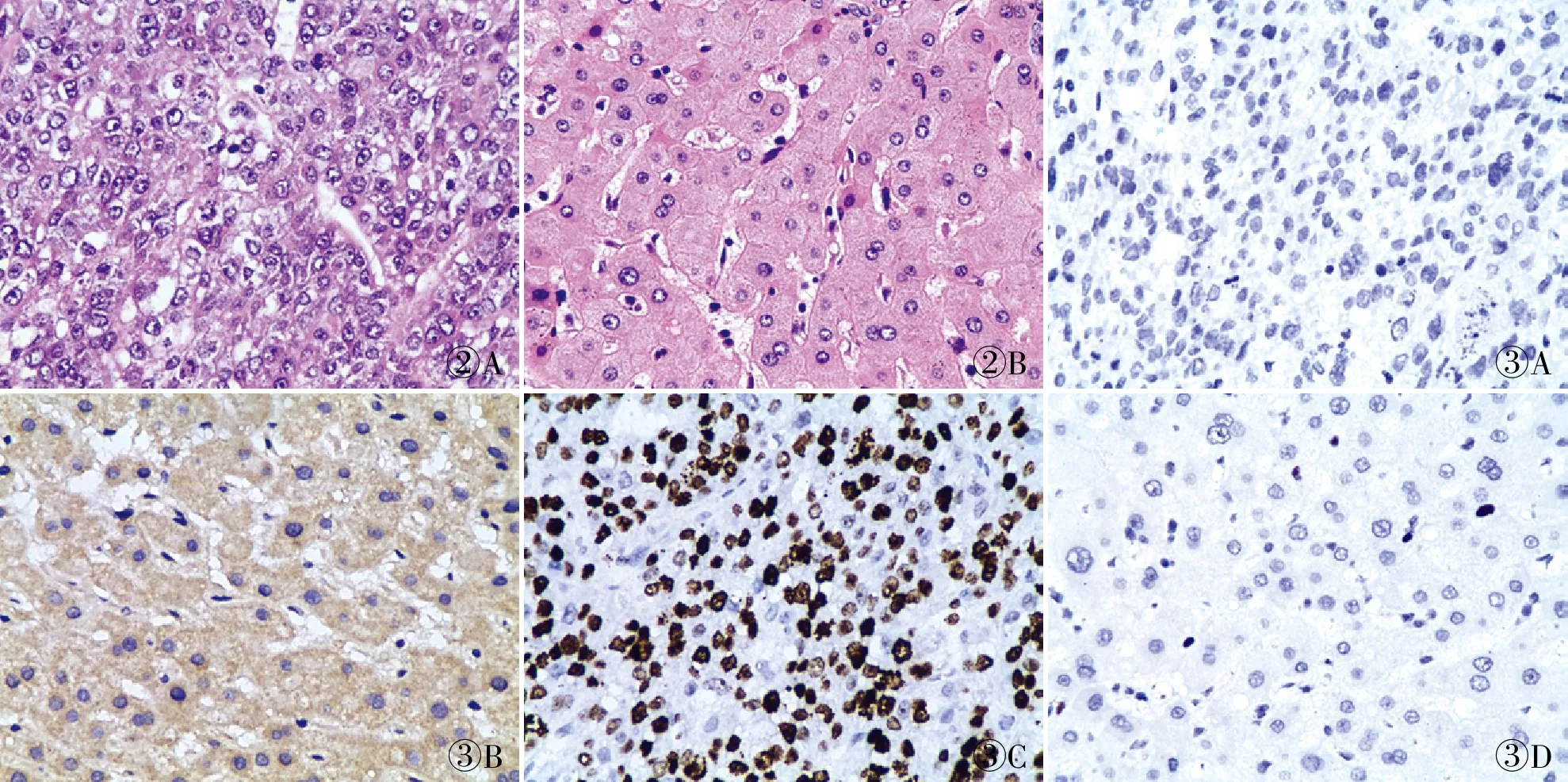
②A②B③A③B③C③D
2.3 HCC中SEMA5A蛋白表达与Ki-67蛋白表达的相关性HCC中Ki-67低或不表达组中SEMA5A高表达率为75.4%,Ki-67高表达组中SEMA5A高表达率为33.1%。Spearman相关分析显示,SEMA5A与Ki-67表达呈负相关(r=-0.374,P<0.001,表2)。

表2 肝细胞癌中SEMA5A与Ki-67蛋白表达的相关性分析[n(%)]
2.4 HCC中SEMA5A、Ki-67蛋白表达与临床病理特征的关系HCC患者中SEMA5A蛋白高表达率在肿瘤大小(χ2=6.744,P=0.009)、肿瘤数目(χ2=4.895,P=0.027)、分化程度(χ2=7.332,P=0.026)及TNM分期(χ2=14.809,P=0.001),差异有统计学意义。Ki-67蛋白高表达率在肿瘤分化程度(χ2=39.072,P<0.001)及TNM分期(χ2=7.991,P=0.018,表3),差异有统计学意义。
2.5 SEMA5A、Ki-67蛋白表达与HCC患者生存和预后的关系Kaplan-Meier生存曲线显示:SEMA5A高表达组患者的总生存率高于低或不表达组(χ2=74.244,P<0.001,图4A),Ki-67高表达组患者的总生存率低于低或不表达组(χ2=52.710,P<0.001,图4B),HCC患者的总生存率随着TNM分期增高而降低(χ2=32.381,P<0.001,图4C)。
Cox单因素、多因素比例风险回归分析显示:SEMA5A高表达、Ki-67低或不表达及TNM低分期显著降低患者的死亡风险,可作为HCC患者独立的预后因子(表4)。
3 讨论
肝癌是肝硬化患者死亡的主要原因[8],5年生存率仅为18%[9],其发生、发展的分子机制仍不清楚[10]。目前,晚期HCC的主要治疗是药物靶向治疗,疗效不理想,且耐药性与不良反应对药物的持续使用有所限制[11]。因此,寻找HCC分子靶点及预测靶向治疗效果的临床研究势在必行。
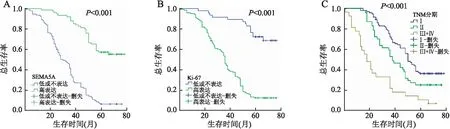
图4 Kaplan-Meier生存曲线:A.SEMA5A蛋白表达与肝细胞癌患者总生存期的关系;B.Ki-67蛋白表达与肝细胞癌患者总生存期的关系;C.TNM分期与肝细胞癌患者总生存期的关系

表3 肝细胞癌中SEMA5A、Ki-67蛋白表达与临床病理特征的关系[n(%)]

表4 Cox单因素和多因素分析SEMA5A、Ki-67蛋白表达与预后的关系
SEMA5A是Semaphorin家族的V类,定位于人染色体5p15.2上,全长51.8 kb,是一种完整的膜蛋白,包含1个SEMA结构域、1个特征性结构域“TSP-1”和1个短胞质结构域,TSP-1可激活TGF-β1,而TGF-β1的表达与肿瘤的侵袭和转移及患者的预后密切相关[12],其膜结合结构域和裂解的胞外结构域在肿瘤中可能发挥不同作用[13]。
SEMA5A可驱动先天性和获得性免疫反应,慢性自发性荨麻疹中IL-17的表达与SEMA5A的表达量有关[14],SEMA5A可参与APC引起的抗原呈递作用,下调受体plexinB3的表达,参与Th1极化[15]。SEMA5A也可作为促血管生成因子,诱导内皮细胞增殖、迁移,抑制凋亡,是细胞迁移和癌症器官特异性归巢细胞转移过程中的必要分子[4],但其在不同的细胞及功能的不同阶段发挥作用并不相同[5]。SEMA5A在不同类型的癌症中作用相反[16],SEMA5A可通过调节GFAP的表达及干扰素信号通路发挥抑制人神经胶质瘤[5]和肺腺癌[13,16]的作用,而对胰腺癌[6]、胃癌[17-18]、膀胱癌[19]、多发性骨髓瘤[20]、子宫内膜癌[21]及黑色素瘤[22]SEMA5A则起促进作用,该作用可能与TGF-β1及PI3K/Akt通路在肿瘤侵袭和转移上的作用密切相关。对慢性丙型肝炎患者的血清研究发现,SEMA5A可视为慢性丙型肝炎肝损伤的标志物之一,但其在HCC中的表达水平及具体的作用尚不清楚。
本组生物信息学分析发现SEMA5A在HCC中表达量降低,且与癌症患者的术后总生存率密切相关。由此,我们推测SEMA5A的表达水平的高低可能与HCC的发生、发展有关。Ki-67是一种核蛋白,已作为增殖细胞标志物广泛应用于临床,其表达高低与肿瘤细胞的增殖活跃程度、分化程度、恶性程度(浸润、转移)及患者预后密切相关[23]。为了进一步验证SEMA5A在HCC中的作用,本组采用免疫组化检测168例HCC患者中SEMA5A蛋白的表达及与患者预后的关系,结果显示SEMA5A蛋白在HCC中的高表达率低,且与Ki-67蛋白的表达呈负相关,SEMA5A蛋白的高表达率在肿瘤的大小、数目、分化程度及TNM分期,差异有统计学意义。Kaplan-Meier生存分析及预后分析显示:SEMA5A蛋白的表达水平与HCC患者的生存及预后显著相关,可独立作为患者预后的预测因子。根据以上结果,我们推测SEMA5A可能通过抑制HCC癌细胞的分裂和增殖,抑制癌症的发生、发展、侵袭和转移,最终影响患者的生存和预后。
综上所述,SEMA5A在HCC中的低或不表达,其可评估HCC的恶性生物学行为及患者的预后,但具体的作用及分子机制需要在细胞学及分子生物学水平进一步分析。

