基于TCGA数据库的食管鳞状细胞癌差异表达焦亡相关基因的筛选及GSDMC基因的验证
苗婷婷,胡浇浇,郑士耀,孙 畅,杨 铭,曹玉文,,王良海,,胡建明,,沈西华,杨 兰,
食管癌是消化系统最常见的恶性肿瘤,主要有两种组织学类型:食管腺癌和食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)[1-2]。我国食管癌主要以ESCC为主,患者预后差[3-5]。目前,靶向治疗为ESCC的治疗带来了希望,但其预后效果仍然不佳。因此,寻找ESCC患者新的预后生物学标志物可能会为靶向治疗提供新思路。细胞焦亡也称为炎症性死亡,是一种由半胱天冬氨酸蛋白酶-1(caspase-1)介导激活,并通过切割gasdermin(GSDM)家族蛋白,使质膜穿孔,同时伴随炎性分子释放和免疫系统激活的细胞死亡方式[6-7]。有文献报道,细胞焦亡相关基因(pyroptosis-related genes, PRG)在多种肿瘤的进展和预后中起重要作用[8-9]。然而,关于PRG在ESCC组织中的表达及预后的研究较少。本文通过生物信息学法分析ESCC组织和正常食管黏膜组织中差异表达的PRG,探讨其与ESCC患者预后的关系,并运用体外实验对与ESCC患者预后相关的差异表达PRG基因进行验证和功能研究,为ESCC患者诊断、鉴别诊断及预后提供理论依据。
1 材料与方法
1.1 数据来源从TCGA数据库(https: // portal. gdc. cancer. gov/)和GTEx数据库(http: // www. gtexportal. Org / home/)中获取82例人ESCC组织和82例人正常食管黏膜组织的转录组数据及患者的临床资料,包括ESCC患者ID号、性别、年龄、生存状态、生存时间、临床分期和肿瘤分级等。
1.2 细胞系及试剂人ESCC细胞系(KYSE-30、Eca-109、EC9706、KYSE-150、TE-1、KYSE-410)、人食管上皮细胞系HET-1A,均购自中国科学院上海细胞库。KYSE-30专用培养基购自武汉普诺赛公司,RPMI-1640培养基、胎牛血清均购自美国Gibco公司。GSDMC siRNA和阴性对照siRNA(negative control siRNA, NC siRNA)质粒,由上海吉玛基因公司设计和合成。转染试剂Lipofectamine 2000购自美国Thermo Fisher公司;RNA提取试剂盒购自美国Omega公司;逆转录试剂盒为美国Thermo Fisher公司;实时定量PCR试剂盒购自德国凯杰生物公司;CCK-8试剂盒购自日本同仁化学研究所。
1.3 差异表达PRG的筛选从Pubmed、中国知网和万方等数据库中下载并阅读细胞焦亡相关文献[10-14],合计有33个PRG。用R软件“Limma”和“DESeq2”提取ESCC和正常食管黏膜组织中PRG的转录组数据,筛选差异表达的PRG,同时以log2FC>0.5和P<0.001为筛选标准,进一步绘制热图和条形图。
1.4 差异表达PRG和ESCC患者预后分析运用R软件“Limma”从TCGA数据库中提取ESCC患者的生存时间和生存状态(95例患者有64例生存,31例死亡)。用R软件“Survival”对差异表达的PRG与ESCC患者的生存时间进行Cox单因素、多因素回归分析,获得ESCC患者不良预后的独立危险因素,并绘制森林图。
1.5 细胞培养及转染KYSE-30细胞使用专用细胞基,其余细胞系均使用含10%胎牛血清的RPMI-1640培养基,在37 ℃、5% CO2的细胞培养箱中进行培养。收集对数生长期的KYSE-30细胞,按照每孔4×105个细胞的数量接种于6孔板。待细胞融合度约为60%时,采用Lipofectamine 2000转染试剂分别将GSDMC siRNA和 NC siRNA转染到细胞中,7 h后更换培养基,48 h后收集细胞用于后续实验。GSDMC-Homo-960、GSDMC-Homo-1740和GSDMC-Homo-1244合计3对siRNA及1对无任何靶基因的NC siRNA,引物均由上海吉玛基因公司合成(表1)。

表1 GSDMC siRNA候选序列
1.6 qRT-PCR检测按照RNA提取试剂盒说明书提取RNA,并测定RNA浓度,通过逆转录得到相应的cDNA,随后进行qRT-PCR检测,每个样本同时扩增3个复管,并连续进行3次重复实验,采用2-△△Ct法计算目的基因表达量,引物由上海吉玛公司合成(表2)。

表2 qRT-PCR引物序列
1.7 CCK-8法检测细胞活力常规培养si-GSDMC组和si-NC组KYSE-30细胞,选取生长状态良好的两组细胞以每孔3×103个细胞接种于96孔板,37 ℃、5% CO2培养箱常规孵育过夜,收集1~5天的细胞,在避光条件下每孔加入10 μL CCK-8溶液,将培养板置于培养箱内孵育2 h,酶标仪检测450 nm处的吸光度(OD)值。
1.8 平板克隆实验检测细胞增殖将细胞以每孔 2×103个分别接种于6孔板,用KYSE-30细胞专用培养基在37 ℃、5% CO2培养箱中常规培养,10天后PBS清洗3次。经4%多聚甲醛固定30 min,PBS清洗3次;用0.1%结晶紫染色20 min,PBS清洗;采集图像并计数平板克隆形成数。
1.9 肿瘤免疫评估资源(TIMER)数据库分析使用TIMER数据库分析差异表达PRG的表达水平,与食管癌免疫微环境中免疫细胞浸润水平的相关性。

2 结果
2.1 ESCC组织中PRG的表达从TCGA和GTEx数据库下载82例ESCC组织和82例正常食管黏膜组织的转录组数据,筛选并分析33个PRG的mRNA表达,从中选出23个差异表达的PRG。其中,GSDMC、CASP5、NLRP6、IL-1β、TNF和PYCARD等13个基因在ESCC组织中表达上调,PRKACA、PLCG1、NOD1和GSDMD等10个基因在ESCC组织中表达下调(P<0.001,图1)。

图1 差异表达的PRG:A.差异表达的PRG热图,红色代表高表达,绿色代表低表达;B.差异表达的PRG条形图;***P<0.001
2.2 差异表达PRG与ESCC患者预后分析Cox单因素回归模型分析:差异表达PRG中的CASP5(HR=4.065 3,95%CI: 1.477 3~11.187 5,P=0.006 6)和GSDMC(HR=1.096 0,95%CI: 1.036 6~1.158 8,P=0.001 3)基因的表达水平与ESCC预后相关(图2A)。Cox多因素回归模型分析:GSDMC(HR=1.080 1,95%CI: 1.022 3~1.141 2,P=0.006 0)基因是ESCC患者不良预后的独立危险因素(图2B)。

图2 差异表达PRG与食管鳞状细胞癌患者预后分析:A.Cox单因素回归模型分析;B.Cox多因素回归模型分析
2.3 ESCC细胞株中GSDMC mRNA的表达qRT-PCR检测显示,与正常食管上皮细胞HET-1A(1.15±0.62)相比,GSDMC mRNA表达水平在食管癌细胞株EC9706(4.13±1.00)、Eca-109(5.01±2.17)、KYSE410(12.98±1.49)、TE-1(3.81±0.96)、KYSE-150(9.78±3.51)和KYSE-30(25.01±4.09)细胞中上调(P均<0.001,图3),其上调趋势与TCGA数据库中的RNAseq数据一致。由于GSDMC基因在KYSE-30细胞系表达相对较高,故选择其进行下一步实验。
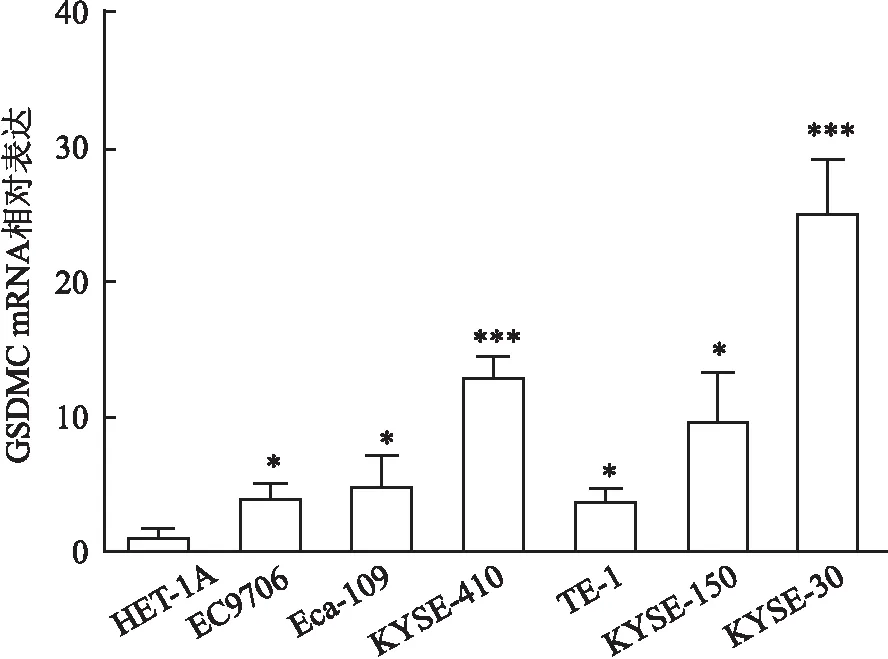
图3 qRT-PCR实验检测GSDMC mRNA在正常食管上皮细胞和食管鳞状细胞癌细胞中的表达:*P<0.05,***P<0.001
2.4 敲低GSDMC mRNA对ESCC细胞活力、克隆形成能力和凋亡的影响
2.4.1si-GSDMC筛选 qRT-PCR检测显示,转染GSDMC-Homo-960、GSDMC-Homo-1740及GSDMC-Homo-1244 siRNA的KYSE-30细胞中GSDMC mRNA表达量有不同程度的降低,与si-NC(1.00±0.08)相比,其中转染GSDMC-Homo-1244(0.27±0.11)的抑制效果最明显(t=9.355,P<0.001,图4),将其用于后续实验。

图4 qRT-PCR实验检测敲低GSDMC mRNA的KYSE-30细胞中GSDMC mRNA表达水平:***P<0.001
2.4.2转染si-GSDMC检测ESCC细胞活力、平板克隆能力和凋亡 本组CCK-8、平板克隆实验及qRT-PCR检测显示,与si-NC组相比,si-GSDMC组ESCC细胞活力在转染后第1~5天均降低,其中第4天降低最明显[OD值:(1.73±0.07)vs(1.10±0.09),t=13.55,P<0.001] ,si-GSDMC组ESCC细胞克隆形成能力降低[克隆形成数目:(686±94.30)vs(377±77.31),t=4.389,P<0.05,图5、6),凋亡能力增强[Bax:(1.00±0.08)vs(6.43±0.75),t=12.51;BCL-2:(1.05±0.06)vs(0.26±0.12),t=10.06,P均<0.001,图7]。
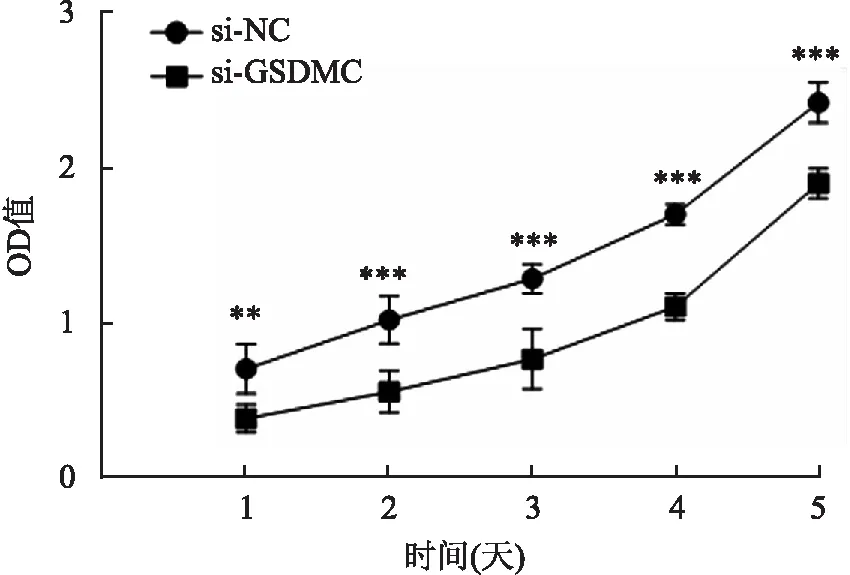
图5 CCK-8实验检测敲低GSDMC对KYSE-30细胞增殖能力的影响:**P<0.01,***P<0.001
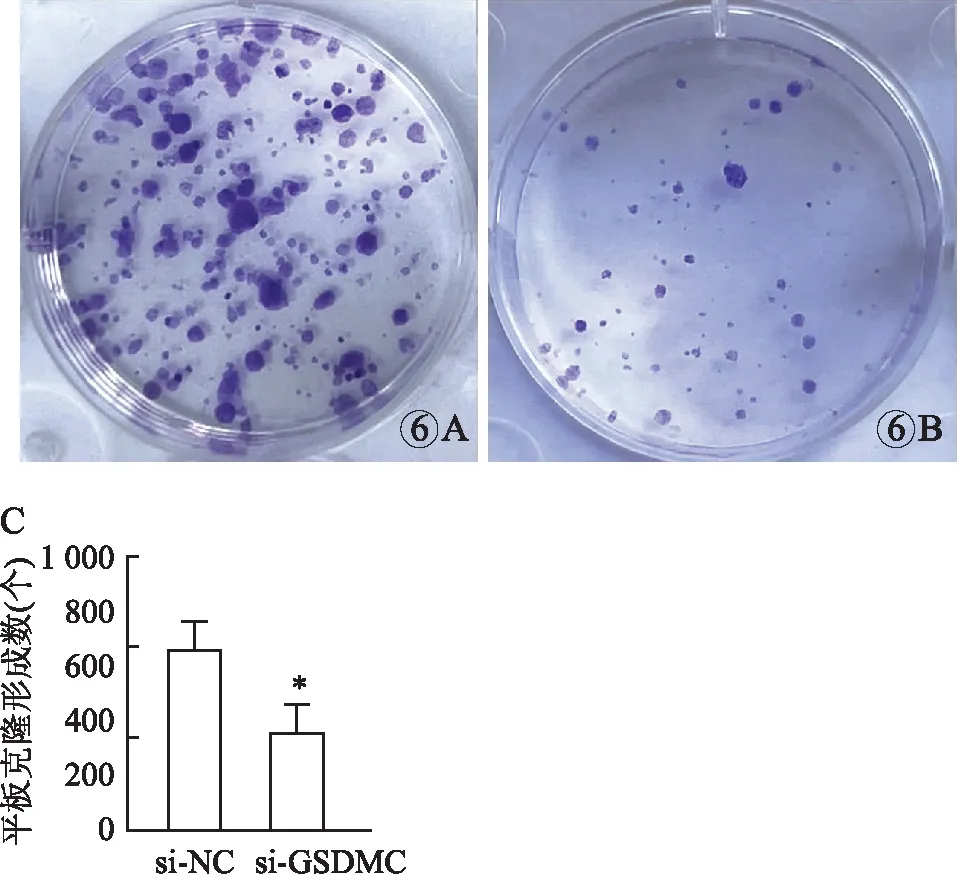
图6 平板克隆实验检测敲低GSDMC对KYSE-30细胞克隆形成能力的影响:A.转染si-NC后,KYSE-30细胞的克隆形成能力;B.转染si-GSDMC后,KYSE-30细胞的克隆形成能力;C.敲低GSDMC后,KYSE-30细胞克隆形成能力的统计图,*P<0.05

图7 qRT-PCR实验检测敲低GSDMC对KYSE-30细胞中Bax和BCL-2表达的影响:***P<0.001
2.5 TIMER数据库分析运用TIMER数据库初步分析GSDMC mRNA表达与食管癌免疫细胞浸润水平之间的相关性。结果表明:GSDMC的mRNA表达与B细胞(r=-0.317,P=1.58e-05)、巨噬细胞(r=-0.252,P=6.48e-04)、CD8+T细胞(r=-0.15,P=4.44e-02)的浸润程度呈负相关,与树突状细胞(r=0.353,P=1.16e-06)、中性粒细胞(r=0.287,P=9.40e-05)的浸润程度呈正相关(图8)。
3 讨论
细胞焦亡是近期发现的一种程序性细胞死亡方式[15]。有文献报道,PRG与多种恶性肿瘤具有相关性[12]。如Feng等[16]研究发现,黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)炎性小体在胃癌组织和细胞中高表达,且促进胃癌细胞的增殖和迁移。此外,有文献报道GSDMD蛋白在非小细胞肺癌中表达上调,是肺腺癌的独立预后标志物,与肿瘤大小、TNM分期等有关[17]。本实验通过查阅文献获得33个PRG,并以此为基础展开分析。首先,对TCGA和GTEx数据库下载的ESCC和正常食管黏膜组织中33个PRG的mRNA表达水平进行分析,获得23个差异表达基因;提示这些差异表达PRG在ESCC中起重要作用。其次,进一步对差异表达PRG进行Cox单因素回归分析,结果发现GSDMC和CASP5基因与ESCC患者预后相关。最后,Cox多因素回归分析表明,GSDMC是ESCC患者的独立预后生物学标志物。
GSDMC是GSDM家族中的一员,广泛表达于食管、胃、肠、气管和皮肤中,其N端结构域能够诱导细胞发生焦亡[18]。有研究报道GSDMC在多种肿瘤的发生和预后中发挥重要作用,如GSDMC过表达能诱导乳腺癌细胞焦亡,且与乳腺癌患者生存期低有关[19]。在结直肠癌细胞中,GSDMC可能通过抑制TGF-β Ⅱ型受体的活性促进细胞增殖和肿瘤形成[20]。Yan等[21]研究表明在胰腺癌组织中GSDMC表达上调,与患者预后不良相关。此外,在胃癌细胞中GSDMC可能是一种潜在的肿瘤抑制因子,能够抑制胃癌细胞生长[22]。本组通过体外实验发现GSDMC在ESCC细胞中高表达,敲低GSDMC后能够抑制ESCC细胞的增殖和克隆形成能力,促进凋亡。
最近研究表明肿瘤细胞发生焦亡时,释放多种趋化因子和炎症因子,产生强烈的炎症反应,参与肿瘤免疫微环境的调节[23]。Xu等[24]通过生物信息学分析和实验验证,发现在乳腺癌中GSDMC高表达与乳腺癌患者的不良预后和免疫浸润细胞相关。此外,有研究者在肝细胞癌中发现GSDME能够促进CD8+T 细胞和B细胞的浸润,为肿瘤提供炎性微环境,从而参与肝细胞癌的抗肿瘤免疫[25]。本组运用TIMER数据库进一步分析GSDMC基因表达与食管癌免疫微环境的关系,结果显示GSDMC基因表达水平与食管癌B细胞、CD8+T细胞和巨噬细胞浸润程度呈负相关,提示GSDMC高表达的食管癌患者体液免疫和细胞免疫过程减弱。故推测高表达GSDMC的ESCC患者预后不良,可能是由于抗肿瘤免疫水平减弱导致的。
本文通过TCGA和GTEx数据库运用生物信息学筛选出与ESCC患者预后相关的差异表达PRG,并通过体外实验进一步验证了相关基因在ESCC细胞中的表达和生物学功能。结果显示:GSDMC基因在ESCC组织和细胞中高表达,与ESCC患者预后不良相关,且高表达GSDMC的ESCC患者免疫细胞浸润水平降低。GSDMC基因有望成为ESCC新的预后生物学标志物,并参与免疫细胞的浸润,为ESCC患者的靶向治疗及预后提供参考。

