TGF-β1通过介导上皮-间叶转化促进甲状腺乳头状癌的侵袭和淋巴结转移
李玲玉,彭戴君,杨海生,朱绚丽,张雯雯,官 兵
甲状腺癌(thyroid carcinoma, TC)是内分泌系统最常见的恶性肿瘤[1],以甲状腺乳头状癌(papillary thyroid carcinoma, PTC)最常见,约占TC总数的80%[2]。尽管PTC具有惰性生物学行为,早期诊断和手术治疗效果较好[3]。然而,TC一旦发生颈部淋巴结转移,则严重影响患者的预后,复发的风险也随之增加[4]。因此,探讨PTC发生淋巴结转移的机制具有重要意义。上皮-间叶转化(epithelial-mesenchymal transition, EMT)[5]是近年肿瘤领域的研究热点,与肿瘤侵袭和转移的机制相关[6-7]。TGF-β/Smad信号通路因与EMT密切关联,而备受关注[8]。TGF-β超家族在调节细胞的生长、分化、凋亡、细胞外基质合成与沉积、胚胎发生、炎症反应和器官纤维化中起重要作用[9]。其中,TGF-β1的含量最高,活性最强,并且在细胞侵袭、转移的相关研究中应用较多[10-11]。本文着重分析TGF-β1介导的EMT在PTC增殖和侵袭中的作用,为临床防治PTC发生淋巴结转移提供新思路。
1 材料与方法
1.1 临床资料收集2016~2021年上海市第六人民医院金山分院存档的44例PTC石蜡包埋标本,其中合并颈部淋巴结转移的标本26例,无淋巴结转移的标本18例。患者均经两名病理医师确诊,均无糖尿病、高血压、脑血管病等。患者术前均无其他系统恶性肿瘤,标本病理类型均为经典型乳头状癌亚型。
1.2 试剂人PTC细胞系BCPAP购自上海细胞库;诱导因子rh-TGF-β1和rh-BMP7购自美国R&D公司。一抗E-cadherin(CST-14472, 1 ∶50)、vimentin(CST-5741, 1 ∶100)、TGF-β1(Santa Cruz, sc-146, 1 ∶100)、Smad2/3(Santa Cruz, sc-8332, 1 ∶50)、E-cadherin(CST-14472, 1 ∶1 000)、vimentin(Abcam,Ab92547, 1 ∶2 000)、N-cadherin(Abcam,Ab76011, 1 ∶5 000)、p-Smad2/3(Abcam-Ab254407, 1 ∶1 000)、Smad7(Proteintech, 2584-1-AP, 1 ∶1 000)、GAPDH(Proteintech, 60004-1-Lg, 1 ∶10 000)和IgG二抗(Beyotime, A0208, 1 ∶1 000);引物设计与合成由上海生工公司完成;CCK-8试剂盒购自上海碧云天公司;TRIzol试剂购自美国Invitrogen公司;qRT-PCR试剂盒和ECL发光试剂盒购自美国Thermo公司;RIPA裂解液、BCA蛋白定量试剂盒,购自北京天根生化公司;RPMI 1640培养基和Transwell小室购自美国Corning公司。
1.3 方法
1.3.1免疫组化 标本均经10%中性福尔马林固定,石蜡包埋、切片,其中PTC 44张、癌旁正常组织(normal tissues, NT)44张和有癌转移淋巴结(metastatic lymph nodes, MLN)26张。免疫组化采用EnVision法染色,烤片,切片脱蜡及水化,EDTA抗原修复,阻断内源性过氧化物酶,孵育一、二抗,DAB显色,苏木精复染,自来水返蓝,梯度乙醇脱水干燥,树胶封固。
1.3.2结果判读 E-cadherin以细胞膜呈棕黄色颗粒为阳性,TGF-β1、vimentin以细胞质呈棕黄色颗粒为阳性,Smad2/3以细胞质或细胞核呈棕黄色颗粒为阳性。同时由两名资深病理医师根据阳性细胞的百分比和阳性细胞着色强度进行判读。(1)根据阳性细胞百分比计分:阳性细胞数<1%为0分;1%~25%为1分;26%~50%为2分;51%~75%为3分;76%~100%为4分。(2)根据阳性细胞着色强度计分:未着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。两项评分结果相乘:0~1分为阴性(-);2~4分为弱阳性(+);5~8分为强阳性();9~12分为强阳性()。
1.3.3细胞培养与诱导因子处理 BCPAP细胞系用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基,置于37 ℃ 5% CO2的培养箱中培养,实验细胞均处于对数生长期。待细胞长到70%~80%融合状态时,换无血清细胞培养基继续培养24 h,添加诱导因子分为空白对照组(NC,PBS代替诱导因子)、rh-TGF-β1组(rh-TGF-β1浓度为10 ng/mL)、rh-TGF-β1+rh-BMP7组(10 ng/mL rh-TGF-β1+5ng/mL rh-BMP7)继续培养48 h。
1.3.4CCK-8细胞增殖实验 细胞铺于96孔板,每孔铺100 μL细胞,每个样品设7个复孔,边缘孔加入100 μL无菌水或者PBS。37 ℃ 5%CO2培养箱中培养。检测前加入10 μL的CCK-8于孔中,2 h后,酶标仪于450 nm波长处检测吸光度(optical density, OD)值。
1.3.5Transwell细胞侵袭实验 收获细胞,计数,调整细胞浓度为每毫升6×104个;在下室(即24孔板底部)加入700 μL含10%血清的培养基,上室加入500 μL细胞悬液,继续在CO2培养箱培养24 h。取出小室,吸干上室液体,移到预先加入约800 μL多聚甲醛的孔中,室温固定30 min。取出小室,吸干上室固定液,移到预先加入约800 μL结晶紫染液的孔中,室温染30 min。用清水冲洗浸泡数次,取出小室,吸去上室液体,擦去上室底部膜表面细胞。用小镊子揭下膜,底面朝上晾干,移至载玻片上用中性树胶封固。显微镜下取10个随机视野计数,并进行统计。
1.3.6qRT-PCR 总RNA由TRIzol提取,通过逆转录试剂盒完成逆转录反应。引物Smad2上游引物:5′-TTCAGTTCCGCCTCCAATCG-3′,下游引物:5′-GCAAGCCACGCTAGGAAAAC-3′;Smad3上游引物:5′-ATGTCATCTACTGCCGCCTG-3′,下游引物:5′-TAGGGATTCACGCAGACCTC-3′;Smad7上游引物:5′-CCTTAGCCGACTCTGCGAA-3′,下游引物:5′-CCCTGTTTCAGCGGAGGAA-3′;N-cadherin上游引物:5′-GCCCAAGACAAAGAGACCCA-3′,下游引物:5′-TGGCCACTGTGCTTACTGAA-3′;vimentin上游引物:5′-AGTCCGCACATTCGAGCAAA-3′,下游引物:5′-AACTTACAGCTGGGCCATCG-3′;E-cadherin上游引物:5′-CCCAGGAGCCAGACACATTT-3′,下游引物:5′-TTAGGGCTGTGTACGTGCTG-3′。以互补DNA为模板,按照qRT-PCR说明书行定量PCR检测,以GAPDH作为内部对照。采用2-ΔΔCt法分析qRT-PCR的数值;统计数据采用GraphPad PRISM 8.0软件进行分析。
1.3.7Western blot实验 用含有蛋白酶抑制剂的RIPA试剂,裂解BCPAP细胞提取总蛋白。应用NanoDrop 2000分光光度计测定所提取蛋白样品的纯度和浓度。取50 μg蛋白样品进行SDS-PAGE凝胶电泳,转移到聚偏氟乙烯(PVDF)膜。用PVDF膜进行染色、封闭、孵育一、二抗,采用高灵敏ECL发光试剂盒进行显色,化学发光成像分析系统曝光并采集图片。

2 结果
2.1 不同甲状腺组织中EMT标志物和TGF-β1、Smad2/3的表达本组对44例PTC、44例NT和26例MLN进行E-cadherin和vimentin的免疫组化检测,E-cadherin在NT、PTC和MLN中表达水平评分平均值分别为12.00、5.60、5.52;vimentin在NT、PTC和MLN中表达水平评分平均值分别为4.00、9.00、9.52;与NT相比,PTC和MLN中E-cadherin表达水平下降,vimentin表达水平升高(图1)。与NT相比,35例PTC中E-cadherin表达减少,并同时伴vimentin表达增加(79.5%,35/44),21例MLN中E-cadherin表达减少(+),并同时伴vimentin表达增加(~)(81%,21/26),上皮标志物E-cadherin和间叶标志物vimentin的表达呈负相关,提示与正常甲状腺滤泡相比,PTC和淋巴结转移癌中均发生EMT现象。在PTC中TGF-β1和Smad2/3的阳性率分别为70.5%(31/44)和65.9%(29/44),明显高于NT中TGF-β1和Smad2/3的阳性率[20.5%(9/44)和18.2%(8/44)],两者相比差异有显著性(P<0.01)。MLN中TGF-β1和Smad2/3的阳性率进一步升高,分别为76.9%(20/26)和69.2%(18/26),但与PTC相比差异无统计学意义(图1)。在31例TGF-β1阳性的PTC中有29例同时Smad2/3阳性,而在TGF-β1阴性的组织中Smad2/3也呈阴性,提示Smad2/3与TGF-β1的表达一致(Kappa=0.895,P<0.001)。
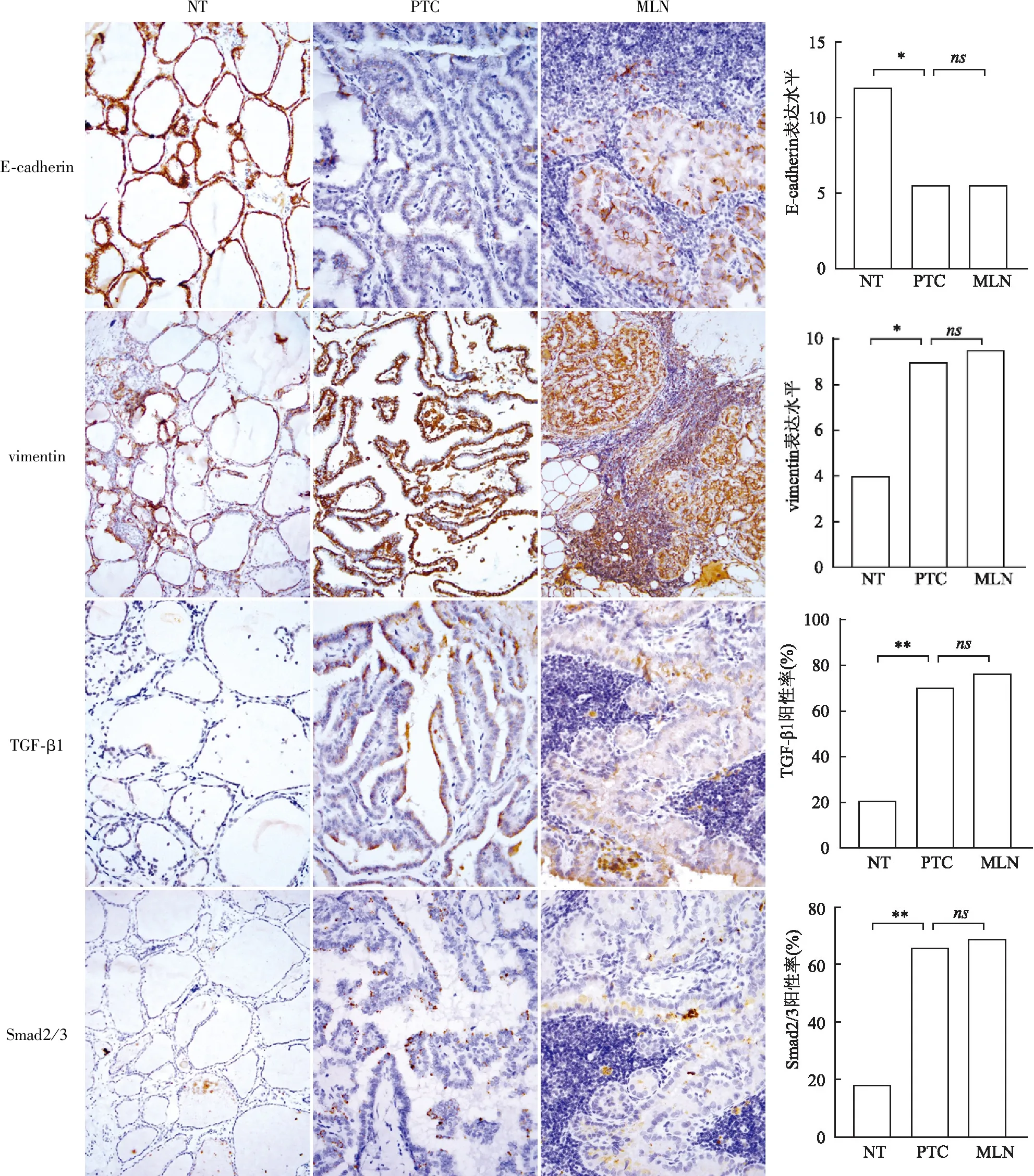
NTPTCMLNE-cadherinvimentinTGF-β1Smad2/3
2.2 TGF-β1对PTC细胞形态的影响三组细胞培养48 h后,用倒置显微镜观察细胞形态学变化,与NC组相比,rh-TGF-β1组细胞间隙增大,细胞变得松散,离散成单个的细胞呈梭形、纺锤形,细胞由上皮样形态向间叶形态发生转变(图2A)。
2.3 TGF-β1对PTC细胞增殖的影响三组细胞同时培养0、24、48、72 h后经CCK-8检测,酶标仪检测OD值。结果显示:与NC组相比,rh-TGF-β1组细胞增殖能力明显增强,rh-BMP7可以抑制TGF-β1的促细胞增殖能力,48 h的OD值为0.154、0.185、0.163,72 h的OD值为0.189、0.244、0.207,差异均有统计学意义(P<0.01,图2B)。
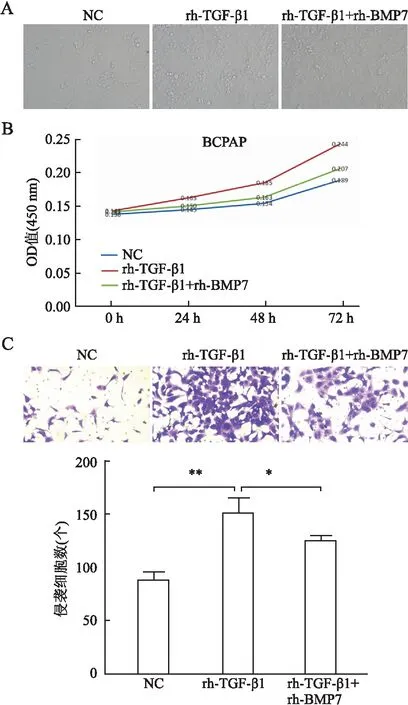
图2 TGF-β1对甲状腺乳头状癌细胞形态、增殖和侵袭的影响:A.镜下示rh-TGF-β1组细胞由上皮样形态向间叶细胞形态转变;B.CCK-8实验示rh-TGF-β1组细胞增殖能力增强;C.Transwell实验示rh-TGF-β1组细胞穿过小室基膜的细胞数增加;NC.空白对照组;*P<0.05,**P<0.01
2.4 TGF-β1对PTC细胞侵袭的影响与NC组相比,添加rh-TGF-β1组BCPAP细胞穿过小室基膜的细胞数量明显增加(P=0.000 2),说明TGF-β1可以明显促进PTC细胞的侵袭。同时,添加rh-TGF-β1和rh-BMP7组细胞穿过基膜的数量比rh-TGF-β1组明显减少(P=0.024 2),提示BMP7可以抑制TGF-β1的促细胞侵袭作用,差异均有统计学意义(图2C)。
2.5 TGF-β1对PTC细胞EMT标志物和TGF-β/Smad信号通路标志物在mRNA水平表达的影响qRT-PCR结果显示:TGF-β1可以增加TGF-β/Smad信号通路标志物Smad2(1.229±0.016)、Smad3(2.208±0.084)的表达,BMP7可以抑制Smad2(1.016±0.171)、Smad3(1.080±0.185)的表达,上调Smad7(1.729±0.084)的表达(P<0.05,图3A)。TGF-β1可以诱导上皮标志物E-cadherin(0.525±0.029)的下调和间叶标志物vimentin(1.974±0.194)、N-cadherin(1.590±0.166)的上调,而BMP7可以抑制TGF-β1促EMT作用(P<0.05,图3B),
2.6 TGF-β1对PTC细胞EMT标志物和TGF-β/Smad信号通路标志物在蛋白质水平表达的影响Western blot实验结果显示:TGF-β1可以增加p-Smad2/3(0.669±0.022)的表达,BMP7可以抑制p-Smad2/3(0.551±0.032),上调抑制性蛋白Smad7(1.106±0.088)的表达(P<0.05,图3C)。TGF-β1可以诱导上皮标志物E-cadherin(0.254±0.009)的下调和间叶标志物vimentin(0.473±0.062)、N-cadherin(0.404±0.018)的上调,BMP7可以抑制TGF-β1促EMT作用(P<0.05,图3D)。

图3 TGF-β1对甲状腺乳头状癌细胞EMT标志物和TGF-β/Smad信号通路标志物表达的影响:A.qRT-PCR检测TGF-β1与TGF-β/Smad信号通路标志物Smad2、Smad3的关系;B.qRT-PCR检测TGF-β1与上皮标志物E-cadherin和间叶标志物vimentin、N-cadherin的关系;C.Western blot法检测TGF-β1与Smad7、p-Smad2/3表达的关系;D.Western blot法检测TGF-β1与上皮标志物E-cadherin和间叶标志物vimentin、N-cadherin的关系;NC.空白对照组;ns.差异无统计学意义;*P<0.05,**P<0.01
3 讨论
PTC是TC中最常见的病理类型,约占TC的80%。PTC虽然具有惰性生物学行为,经过合理的诊断和治疗预后良好,但仍有较多的PTC患者,尤其是合并淋巴结和远处转移的患者,易复发且预后不良,严重影响患者的生活质量[12]。淋巴结转移作为PTC高侵袭性的临床病理特征之一,与PTC的局部复发和远处转移密切相关[13],研究PTC侵袭和转移的分子机制,对于早期识别合并淋巴结转移的PTC,及时确定其有效的诊断和治疗措施具有重要意义。
EMT是指具有极性的上皮细胞发生表型改变,转化为具有游走能力的间叶细胞的过程,因此认为EMT与细胞的侵袭和转移密切相关[14]。EMT的主要分子学标志是上皮标志物E-cadherin的表达下降和间叶标志物vimentin、N-cadherin等的表达上调[15]。本组首先收集PTC患者的石蜡标本,检测其EMT标志物的表达,实验结果显示与NT相比,PTC和MLN中分别有79.5%(35/44)和81%(21/26)病例中E-cadherin的表达减少,并伴vimentin的表达增加,提示PTC中存在EMT现象。本组检测石蜡切除标本中TGF-β1和Smad2/3的表达,实验结果显示:与NT相比,PTC和MLN中TGF-β1和Smad2/3的阳性率明显升高,提示TGF-β1和Smad通路蛋白在PTC的淋巴结转移中发挥重要作用。
Kaimori等[16]将体外培养的小鼠肝细胞中加入TGF-β1诱导因子,发现小鼠肝细胞向间充质细胞的形态改变,并且检测到其上皮标志物E-cadherin的表达下降,而间叶标志物vimentin、FSP-1等的表达升高,提示TGF-β1可以在体外诱导细胞发生EMT。国内外关于EMT的研究多将TGF-β1作为诱导因子[17-19]。由于TGF-β/Smad通路与EMT过程密切相关[20-23],本组将TGF-β/Smad通路作为TGF-β1诱导PTC细胞发生EMT的主要信号转导途径进行分析。TGF-β/Smad信号转导途径[24]:TGF-β与细胞膜上的TβRⅡ结合,激活TβRⅠ,TβRⅠ使细胞内质核转导分子Smad2/3磷酸化,磷酸化后的Smad2/3与Smad4形成三聚体复合物进入细胞核,与其他信号转导分子共同调节目的基因转录。Smad7是抑制型Smad,能够抑制Smad2/3的磷酸化,阻断R-Smads的信号转导[25]。BMP7与TGF-β1在结构上有诸多相似[26],可通过阻断TGF-β/Smad信号通路的转导过程,增加Smad7的表达抑制TGF-β1的作用[27]。因此,本实验中将BMP7用作TGF-β/Smad信号通路的抑制因子。本课题组在体外细胞实验中设置NC组、rh-TGF-β1组和rh-TGF-β1+rh-BMP7组,采用CCK-8法检测细胞增殖能力,应用Transwell实验检测细胞侵袭能力,用qRT-PCR和Western blot法检测EMT标志物E-cadherin、N-cadherin、vimentin的表达变化和Smad通路标志物Smad2、Smad3、Smad7、p-Smad2/3的表达水平。实验结果显示:TGF-β1可诱导BCPAP细胞由上皮样形态向间叶形态转变,明显增强其增殖和侵袭能力,并且诱导上皮标志物E-cadherin的下调和间叶标志物vimentin、N-cadherin的上调,从而促进细胞发生EMT,BMP7可以抑制TGF-β1促细胞增殖、侵袭及EMT的作用。TGF-β1可以促使Smad2、Smad3及p-Smad2/3的水平升高,BMP7可以抑制Smad2、Smad3的表达及Smad2/3蛋白的磷酸化,增加抑制型蛋白Smad7的表达,提示BMP7通过作用于TGF-β/Smad信号通路抑制TGF-β1。本实验结果只在一种PTC细胞系中得到验证,后续需进一步在多细胞系和实验动物中验证。
综上所述,PTC及其淋巴结转移标本发生EMT现象且TGF-β1和Smad2/3呈高表达;TGF-β1通过TGF-β/Smad信号通路介导EMT,促进PTC的侵袭和淋巴结转移。本组结果对早期诊断有淋巴结转移和侵袭性倾向的PTC患者具有重要的临床意义,也为寻找预防和治疗PTC转移的新靶点提供理论依据。

