原发性肝脏指状突树突细胞肉瘤临床病理特征
陈鸿远,董 辉,俞 花,朱玉瑶,余秋凤,钱尤雯
指状突树突细胞肉瘤(interdigitating dendritic cell sarcoma, IDCS)是一种极为罕见的组织细胞/树突细胞肿瘤,起源于骨髓源性树突状细胞。目前,国外文献报道仅100多例[1],淋巴结是最常受累部位,表现为孤立性肿块。淋巴结病变与结外病变的比例约为1.96 ∶1。肝脏是结外IDCS的常见部位[2],软组织、肠系膜和口腔偶尔也会受累[3],患者主要为40岁以上中年人,男女比为(1.38~1.65) ∶1。本文着重探讨肝脏IDCS的组织学形态、免疫表型及分子检测,分析其发生机制,旨在提高临床与病理医师对该肿瘤的认识水平。
1 材料与方法
1.1 临床资料2例患者均为女性,分别为39和67岁,于剖宫产和体检时发现肝占位。血生化检查、肿瘤指标、肝肾功能等均在正常范围。影像学示肝左叶和肝门部实性占位,CT示肝癌可能性大,MRI示盆腔转移可能。术中见肿瘤位于肝实质内或突出于肝门部,质中,考虑盆腔转移者与网膜组织粘连较密。
1.2 方法
1.2.1免疫组化 标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,HE染色,镜下观察。免疫组化采用EnVision两步法检测,应用Leica BOND-MAX全自动染色仪染色。一抗vimentin、S-100、Fascin、CD68、CD163、CD4、CD1a、Langerin(CD207)、CD21、CD23、CD35、CD30、CD45、CD34、MPO、CD117、HMB-45、SOX-10、Melan A、CK(AE1/AE3)、EMA、Ki-67、MLH1、PSM2、MSH2、MSH6,购自福州迈新公司或北京中杉金桥公司。所有标记均设阴、阳性对照。
1.2.2分子检测 微卫星不稳定性(microsatellite instability, MSI)检测采用PCR-毛细管电泳法,选择肿瘤及切缘肝组织,采用德国Qiagen公司的DNA提取试剂盒,美国Promega公司的MSI检测试剂盒特异性扩增NR27、NR21、BAT25、NR24、Mono27、BAT26位点,美国ABI公司Applied Biosystems 3130对扩增产物进行检测。留取部分肿瘤组织送二代测序(next-generation sequencing, NGS)高通量测序(厦门艾德公司),对与肿瘤诊断及治疗(靶向、免疫、化疗)密切相关的116个靶点基因的重要功能域序列进行检测。
1.3 结果判断vimentin、S-100、Fascin、CD68、CD163、CD4阳性信号定位于细胞质,呈弥漫性中~强着色,Ki-67、MLH1、PSM2、MSH2、MSH6阳性信号定位于细胞核。
2 结果
2.1 眼观灰白色实性肿物,例1大小为4.2 cm×3.5 cm×3.0 cm,例2大小为11 cm×11 cm×7 cm,周边附少量正常肝组织,分界较清,切面实性质中,可见出血、坏死。
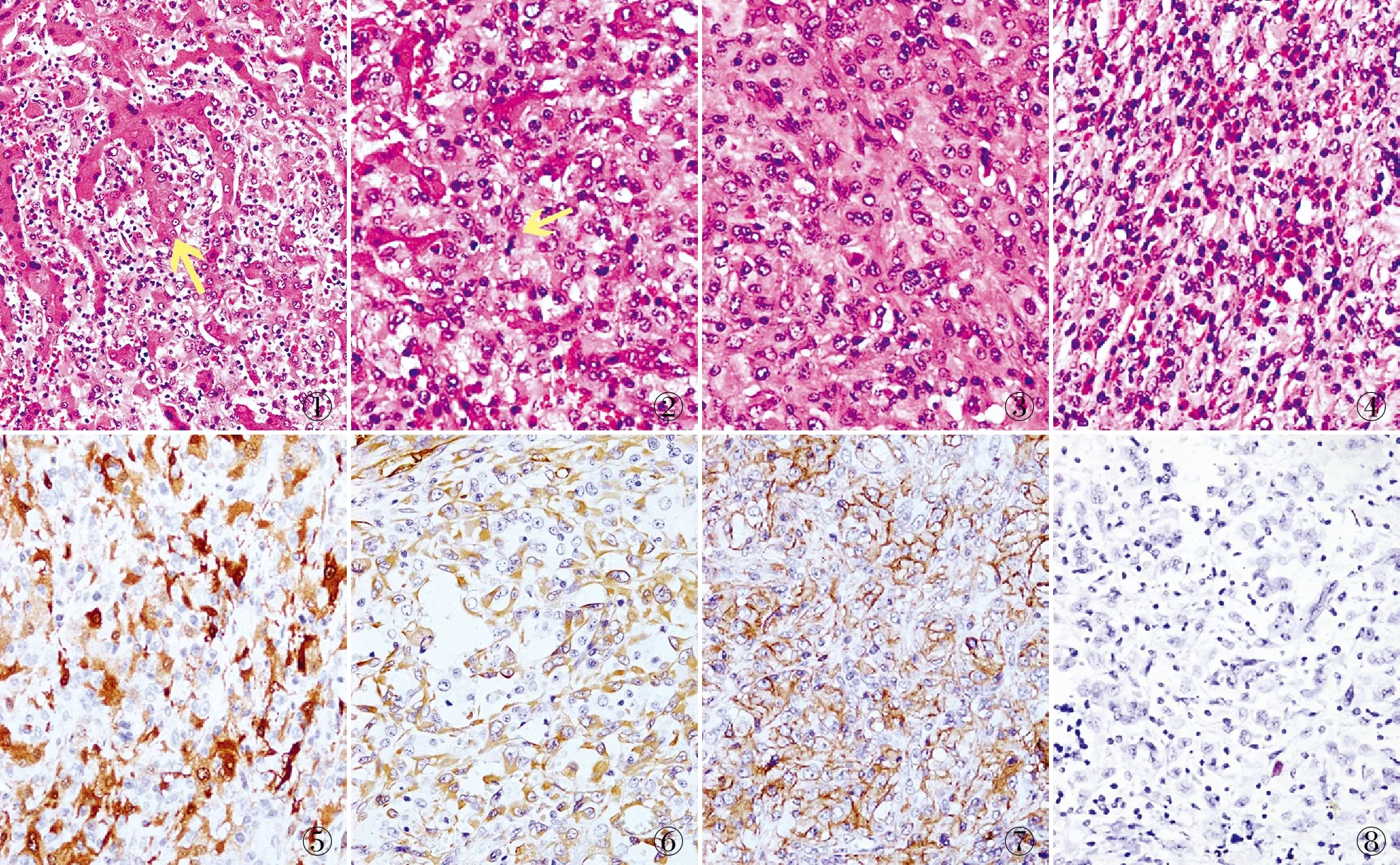
2.2 镜检肿瘤组织呈片、巢状排列,与周边肝组织分界不清,对周边肝窦有侵犯(图1);局灶可见肿瘤性凝固性坏死;细胞异型性明显,圆形或卵圆形,细胞胞界不清,胞质淡染或嗜酸性,核大空泡状,染色质细腻,核膜明显,局灶可见核沟,核分裂易见(>5个/10 HPF),可见一至数个中等大小核仁(图2、3);病灶内有大量嗜酸性粒细胞及淋巴细胞浸润(图4)。
2.3 免疫表型肿瘤细胞vimentin、S-100(图5)、Fascin(图6)、CD68、CD163和4个错配修复基因(MLH1、PSM2、MSH2、MSH6)均阳性,CD4部分阳性(图7),Ki-67增殖指数为10%~30%;其他组织细胞/树突细胞肿瘤、淋巴造血系统肿瘤、黑色素瘤及上皮等标志物均阴性,即CD1a、Langerin(CD207)、CD21、CD23、CD35、CD30、CD45、CD34、MPO、CD117、HMB-45、SOX-10、Melan A、CK(AE1/AE3)、EMA均阴性。
2.4 分子检测2例EBER原位杂交检测均阴性(图8),均未检测到B细胞及T细胞基因克隆性重排。在石蜡标本中进行PCR-毛细管电泳法检测,6个位点检测均显示:与患者正常组织对比,肿瘤组织为微卫星稳定型(图9);对与肿瘤诊断、治疗密切相关的116个药物靶点基因的重要功能域序列进行NGS高通量测序,其中例1发现ERBB2基因27号外显子存在错义突变(c.3610G>A, p.A1204T),IDH1基因4号外显子存在错义突变(c.394C>T, p.R132C),FGFR3基因18号外显子存在错义突变(c.2310C>G, p.Y770),KRAS基因2号外显子存在错义突变(c.35G>A, p.G12D;例2发现ERBB2基因21号外显子存在错义突变(c.2524G>A,p.V842I),BRAF基因15号外显子存在错义突变(c.1799T>A, p.V600E),CREBBP基因26号外显子存在错义突变(c.4336C>T, p.R1446C)。
①②③④⑤⑥⑦⑧
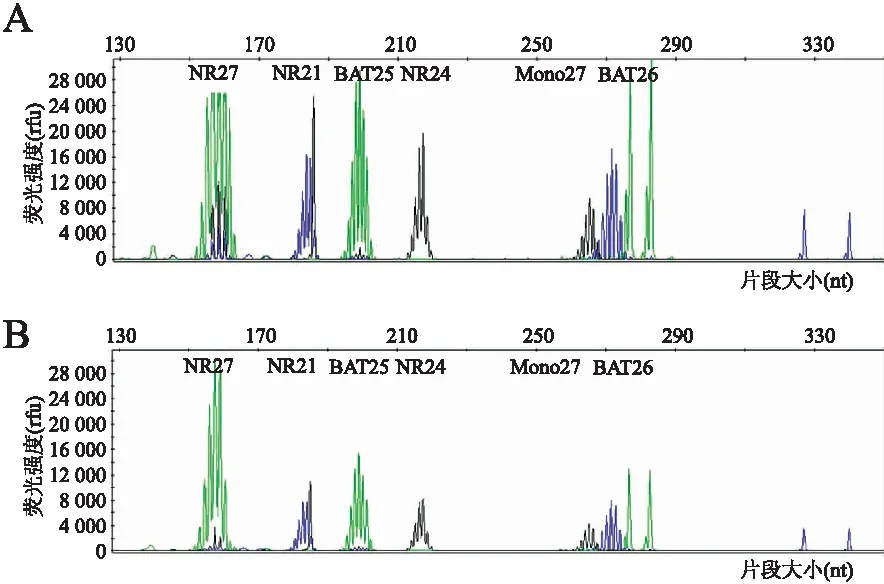
图9 PCR-毛细管电泳法检测:A.同源正常组织;B.肿瘤组织检测为微卫星稳定型
2.5 病理诊断肝脏指状突树突细胞肉瘤。
2.6 治疗与预后2例患者肿瘤切除后接受全身化疗(环磷酰胺+阿霉素的AC化疗方案),分别于术后35和12个月死亡。
3 讨论
3.1 临床特征研究显示起源于肝脏的IDCS极为罕见,WHO(2022)淋巴造血肿瘤分类结构中将组织细胞/树突细胞肿瘤分为四大类,分别为浆细胞样树突细胞肿瘤、朗格汉斯细胞肿瘤、组织细胞/巨噬细胞肿瘤及指状突树突细胞肿瘤。检索英文文献,原发部位为肝脏的IDCS迄今报道20余例。一项关于127例IDCS的大宗文献报道中[1],患者诊断时的中位年龄为58岁(3个月~88岁),男女比为1.38 ∶1~1.65 ∶1[4],男女患者发病年龄无明显差异。患者通常表现为颈部、上颌或纵隔淋巴结肿大,也可出现结外受累。症状无特异性,可出现疲劳、发热、盗汗等,临床需与结核、结节病、淋巴瘤或白血病进行鉴别。本组2例均为女性,分别为剖宫产和体检时发现肝占位,实验室检查均正常,影像学均考虑为恶性肿瘤。
3.2 组织学特征与免疫表型组织学评估是IDCS的诊断基础,镜下见肿瘤组织呈束状或漩涡状排列,细胞胖梭形或卵圆形,胞质通常丰富、轻微嗜酸,胞界模糊。细胞核呈梭形至卵圆形,并可出现核沟;偶尔可见多核细胞。染色质常为泡状,核仁大小不等,核分裂通常<5个/10 HPF,但组织形态学的非典型性存在个体差异,本组1例患者病灶内存在少量肿瘤性坏死,伴多少不等的淋巴细胞和浆细胞浸润,也可见嗜酸性粒细胞。IDCS形态学与骨髓间充质干细胞来源的滤泡树突细胞肿瘤常难以鉴别,免疫组化检测有助于精确诊断,肿瘤细胞S-100和vimentin强阳性,其中S-100染色呈胞质特征性的树突状阳性,Fascin、CD68、Lysozyme和CD45通常呈弱阳性。滤泡树突状细胞标志物CD21、CD23和CD35均阴性;朗格汉斯细胞标志物CD1a、Langerin均阴性;淋巴造血系统肿瘤标志物如MPO、CD34、B细胞和T细胞相关抗原、CD30均阴性;黑色素瘤标志物如HMB-45、SOX-10、Melan A均阴性;上皮标志物如EMA和CK等均阴性。Ki-67增殖指数通常为10%~20%。混杂的小淋巴细胞均为T细胞,B细胞罕见。电镜超微结构显示肿瘤细胞表面有细长的指状突起相互嵌接,胞质内含散在Lysosome,无Birbeck颗粒与桥粒连接。
3.3 肿瘤起源、发病机制与分子遗传学特征20世纪70年代在识别单核吞噬细胞系统中的树突状细胞取得了重大进展,Veldman等[5]首次报道在富含T细胞的淋巴结副皮质区内的指状突树突细胞,占造血细胞群的0.1%~1.6%。超微结构显示:指状突树突细胞具有非典型的奇异扭曲细胞核,且胞膜有较多指状突起;无吞噬和迁徙能力、抗原呈递能力较差,但具有以下3种生理功能:(1)与幼稚B淋巴细胞相互作用,使其在IL-13诱导下分泌产生IgM发生表型转换[6];(2)在非炎症环境中参与致敏反应[7];(3)刺激淋巴结皮质旁区域的外周血幼稚T淋巴细胞[8]。
目前,起源于指状突树突细胞的IDCS发病机制仍不清楚。文献报道[1]127例IDCS中约1/5病例患有其他淋巴造血系统(主要为慢性淋巴细胞白血病/小淋巴细胞淋巴瘤和B细胞淋巴瘤)或非血液系统的恶性肿瘤,中位间隔时间分别为12、42个月。继发于淋巴造血系统恶性肿瘤或免疫抑制状态下的B细胞功能紊乱,可能参与了IDCS的疾病进展,推测与以下原因有关:(1)IDCS与B细胞淋巴瘤的发病间隔较短,仅12个月;(2)恶性B细胞具有转化为指状突树突细胞的能力[9];(3)在一些IDCS病例中发现B细胞淋巴瘤的2个关键突变—Ig基因和MYC基因重排[10-11],推测两者可能具有共同的祖细胞。
文献报道在IDCS中发现BRAF V600E突变[12-13]。本组2例肝脏IDCS中首次发现ERBB2基因(即HER-2基因)的错义突变,该基因作为表皮生长因子受体家族成员之一,通常在消化道恶性肿瘤、乳腺癌和肺癌中高表达,可导致细胞内Ras-MAPK和PI3K/Akt信号转导通路活性上调,从而使肿瘤细胞获得较强的增殖和抗凋亡能力,且更易复发和转移。查询NCBI的ClinVar人类基因组变异数据库,本组例2为ERBB2的21号外显子错义突变(c.2524G>A, p.V842I),该突变位于ERBB2的酪氨酸激酶结构域,突变功能预测表明p.V842I对蛋白构象和功能有影响,可能为致病性突变,该突变曾在胆囊癌、胰腺癌、胃癌、结直肠癌、子宫颈癌等肿瘤中出现。本组例1中ERBB2的27号外显子p.A1204T错义突变发生于ERBB2 N末端的临近PIK3C2B结合区,尽管该突变对蛋白构象影响不明显,但推测可能通过改变ERBB2与下游信号分子的亲和能力,对细胞增殖相关信号通路产生影响。此外,例2中还发现与文献报道一致的BRAF V600E的突变,该基因的突变可导致肿瘤对化疗缺乏积极的治疗反应。本组还检测到IDH1、CREBBP、FGFR3和KRAS基因突变,其中IDH1、CREBBP、FGFR3均与急性髓系白血病相关[14-16],而KRAS基因突变在恶性肿瘤中较为普遍。因此,经靶向ERBB2基因的肿瘤免疫生物治疗有望成为IDCS治疗的新手段,但还需更多的循证医学证据给予支持。
3.4 鉴别诊断
3.4.1组织细胞肉瘤 组织细胞起源于骨髓造血干细胞,在血液中称为单核细胞,在淋巴组织和各组织器官内称为组织细胞或巨噬细胞,其产生的肿瘤细胞胞体宽大、单形性或多形性,黏附性差,胞质丰富嗜酸,核泡状至多形性。PGM1(CD68)和CD163是其较为特异性的免疫组化标记,S-100往往呈弱阳性或灶阳性,电镜下细胞表面有短绒毛,但无指状突起[17]。
3.4.2Langerhans细胞肉瘤 朗格汉斯细胞起源于骨髓造血干细胞,指状突树突细胞可能部分来源于朗格汉斯细胞,两者均具有向T淋巴细胞进行抗原递呈的免疫辅助功能和较强的ATP酶活性,而无组织细胞的吞噬功能。肿瘤细胞S-100、CD1a及Langerin阳性,电镜下见Birbeck颗粒[18]。
3.4.3滤泡树突细胞肉瘤 起源于骨髓间充质干细胞,由卵圆形或梭形细胞排列呈席纹状或编织状,细胞异型性不如IDCS明显,其炎性假瘤样亚型好发于肝脏,病灶内常常富含淋巴细胞和浆细胞,CD21、CD23和CD35为其特征性的免疫表型,电镜下见桥粒连接[19]。
3.4.4转移性黑色素瘤 肿瘤组织形态多样,细胞大小不一,核仁明显,少数病例较难在肿瘤细胞内找到黑色素颗粒[20]。免疫组化标记S-100阳性、BRAF V600E突变,但其他黑色素瘤免疫组化标志物HMB-45、Melan A、PNL2也呈阳性,可资鉴别。
3.4.5肉瘤样癌 在诊断肝脏IDCS前,需排除低分化肉瘤样癌的可能,如分化差的肝内胆管癌,免疫组化上皮标记可辅助诊断。
3.5 治疗及预后诊断IDCS具有挑战性,平均确诊中位时间约3个月,约15%的病例最初被误诊为低度恶性淋巴瘤或慢性炎症,其是一种侵袭性生长的高度恶性肿瘤。肝脏IDCS首选外科手术切除,但易复发,约50%的患者在确诊1年内死亡。尽管放、化疗效果不佳,但化疗仍是肿瘤晚期的唯一治疗方式(最常用的化疗方案是CHOP和ABVD),随着分子病理检测方法的普及,靶向药物有望成为提高患者生存期的新方向。
——以渤海湾盆地渤海BZ25油田新近系明化镇组下段为例

