3种海桑属濒危红树植物的种群结构与动态特征
张孟文钟才荣 吕晓波 方赞山 程 成
(海南省林业科学研究,海南省红树林研究院,海口 571100)
全球生物多样性的丧失正在以前所未有的速度发生[1]。栖息地丧失和破碎化、过度开发、外来物种入侵等都是濒危植物资源数量锐减的重要原因[2-3]。濒危植物的种群结构与动态趋势在很大程度上取决于它们在自然栖息地的天然更新能力[4]。掌握濒危植物的种群结构往往是对物种和生境实施有效保护和管理策略的先决条件[5]。径级结构、动态量化分析、生存分析、静态生命表、存活和死亡率等曲线是研究植物种群结构及其动态特征的重要手段,不仅可以揭示种群的分布现状和自然更新策略,还可以对其未来的发展趋势进行预测,有利于濒危植物种群的保护与更新复壮[6-8]。
红树林是生长在热带与亚热带海岸潮间带,由红树植物为主体的常绿乔木或灌木组成的木本植物群落[9]。作为海岸湿地生态系统中唯一的木本植物,红树林在人类生命防线、物种基因库、蓝碳、海洋净化器等方面扮演重要角色[10]。中国红树植物种类约占全世界的1/3,在世界红树植物多样性保护中占有重要地位[11]。目前已有学者对秋茄(Kandelia obovata)、桐花树(Aegiceras corniculatum)和海榄雌(Avicennia marina)等红树植物的种群结构与动态特征进行了研究,结果认为红树植物的种群结构与动态不仅与其所在群落的演替阶段息息相关,还受到自身繁殖特性、生境因子等多种因素的调控[12]。但前人研究多针对的是常见的红树林植物,而对受人为干扰影响较大的红树林濒危植物的种群结构研究却不多见。
我国有近50%的红树植物表现为不同程度的濒危状态,其中海桑属(Sonneratia)红树植物的濒危种数量最多[13]。海桑属植物是红树植物的重要组成部分,具有重要的生态价值、经济价值和社会价值,其果实具有药食同源特性,含有具有药用价值的化学物质[14]。海桑属植物主要分布于热带的东非和马达加斯加,印度—马来亚地区向北延伸到中国和日本,澳大利亚的东北部以及西太平洋的密克罗尼西亚和美拉尼西亚等岛屿[8]。在我国,海桑属植物自然分布于海南岛,包括6 个物种,即海桑(Sonneratia caseolaris)、海南海桑(S.×hainanensis)、杯萼海桑(S.alba)、拟海桑(S.×gulngai)、卵叶海桑(S.ovata)和钟氏海桑(S.×zhongcairongii)[15-16]。受人类活动的影响,海南海桑、拟海桑、卵叶海桑的生存状态变得极其严峻,各种群处于不同程度的濒危状态,其中海南海桑和卵叶海桑为极危种,拟海桑为濒危种,且都被列入《海南省省级重点保护野生植物名录》[13]。近几年来学者对其分布现状[16]、遗传多样性[17-18]、繁殖系统[19-22]以及化学成分[23]等进行研究,但关于其种群的数量特征与变化趋势方面的研究还鲜见报道。本文拟以海南岛清澜港红树林保护区自然分布的3 种海桑属濒危植物种群为研究对象,对其径级结构与动态特征进行定量研究,旨在揭示3种海桑属濒危植物种群结构及其动态变化特征,阐明其种群的天然更新能力,并提出种群扩大对策,以期为海桑属濒危植物种群的保护和恢复提出科学的策略。
1 研究区域与方法
1.1 研究区概况
此次调查区域位于海南省文昌市清澜港省级红树林自然保护区八门湾片区(19°37′58″—19°37′11″N,110°48′35″—110°53′8″E)。该区地处热带海洋性季风气候,年平均气温为24.3 ℃,历史极端最高气温39.1 ℃,极端最低气温4.7 ℃。年平均降水量为1 975.2 mm,年平均日照时间为1 922.5 h,年均总蒸发量约为1 892.4 mm。该区域的潮汐类型为不规则的全日潮,平均潮差0.75 m,最大潮差2.06 m。目前保护区总面积2 914.6 hm2,其中核 心 区884.1 hm2、缓 冲 区966.6 hm2、实 验 区1 063.9 hm2,保护了面积约为1 444.5 hm2的红树林植被[24]。
1.2 样地设置与样方调查
2021 年1 月,根据各种群分布面积,在调查区域共设置34 个10 m×10 m 样地,调查面积总计为3 400 m2,其中,海南海桑样地有16个,拟海桑样地10 个,卵叶海桑样地8 个(见表1)。调查时将每个样地划分为4 个5 m×5 m 的样方,记录各样方内所有胸径≥1 cm 的海南海桑、拟海桑和卵叶海桑个体的胸径、树高、枝下高和冠幅等指标,并统计各种群幼苗植株数量。

表1 样地基本情况Table 1 Basic situation of the sample plot
1.3 数据统计与分析
1.3.1 径级划分
对于木本植物尤其濒危物种而言,大多数学者认为在数量较少,较难获取其年龄的情况下,可用径级结构代替其年龄结构[6]。本研究采用胸径大小(DBH)作为标准划分径级结构,以此代替年龄结构分析海桑属濒危植物的种群结构特征。根据海桑属濒危植物的生活史特征和野外调查数据的特点,并参考前人研究的方法[12],将其种群划分为11 个径级:Ⅰ级(0≤DBH<5 cm)、Ⅱ级(5 cm≤DBH<10 cm)、Ⅲ级(10 cm≤DBH<15 cm)、Ⅳ级(15 cm≤DBH<20 cm)、Ⅴ级(20 cm≤DBH<25 cm)、Ⅵ级(25 cm≤DBH<30 cm)、Ⅶ级(30 cm≤DBH<35 cm)、Ⅷ级(35 cm≤DBH<40 cm)、Ⅸ级(40 cm≤DBH<45 cm)、Ⅹ级(45 cm≤DBH<50 cm)、Ⅺ级(50 cm≤DBH)。为了方便分析各种群的年龄结构,将Ⅰ级和Ⅱ级的个体划分为幼龄个体,将Ⅲ级、Ⅳ级和Ⅴ级的个体划分为中龄个体,Ⅵ级、Ⅶ级和Ⅷ级的个体划分为成龄个体,Ⅸ级、Ⅹ级和Ⅺ级的个体划分为老龄个体。
1.3.2 种群动态量化方法
对种群内两相邻龄级间个体数量变化动态(Vn)和整个种群年龄结构的数量变化动态(Vpi)进行计算[25],来描述海桑属濒危植物种群年龄结构龄级间和整体的数量变化动态。考虑到种群不可避免地受到随机的外部环境地干扰,则对(Vpi)进行修正得(V′pi)。公式分别如下:
式中:Sn与Sn+1分别为第n和第n+1 年龄级的个体数量,-1≤Vn≤1;k为种群年龄级数量。
1.3.3 静态生命表建立与生存分析
根据特定时间生命表的编制方法,编制海桑属濒危植物种群的静态生命表,并采用“匀滑技术”解决生命表绘制时出现死亡率为负的情况[26]。采用Hett 等[27]提出的2 种数学模型对种群存活曲线进行检验。同时引入生存分析中的4 个函数即生存率函数Sx、累计死亡率函数Fx、死亡密度函数fx和危险率函数λx,用于分析海桑属濒危植物的种群动态[28]。
1.3.4 种群时间序列分析
采用时间序列分析中的一次移动平均法对海桑属濒危植物种群的年龄结构进行预测,其计测方法如下[29]:
式中:n表示需要预测的时间(本研究为龄级时间);(1)表示1次移动平均;t代表龄级;Xk为k龄级内的个体数量;Mt(1)定义为经过未来n个龄级时间t龄级的种群数量。
1.4 数据处理与分析
采用Microsoft Excel 2007软件整理和分析数据,并利用Sigmaplot 10.0软件绘图。
2 结果与分析
2.1 3种海桑属濒危植物种群径级结构及动态量化分析
通过调查发现,海桑属濒危植物共531 株,其中,拟海桑种群有171 株,海南海桑种群有136 株,卵叶海桑种群有224株,它们在各龄级的个体数量(见图1)。结果表明,海南海桑和拟海桑种群结构均为不规则的“金字塔型”。种群个体数随着龄级的增加呈先增后降的趋势,并分别在Ⅳ和Ⅶ龄级有最大值,其中海南海桑种群主要集中在第Ⅲ—Ⅴ龄级,占比高达78.68%,拟海桑种群则集中在第Ⅵ—Ⅷ龄级,占比高达77.78%,说明海南海桑和拟海桑分别以中龄和成龄个体占优势,但它们的幼龄个体极少,占比分别仅为2.94%和0.58%。卵叶海桑种群结构是“倒J型”,种群个体数随龄级的增加逐渐降低,其中,Ⅰ—Ⅱ龄级个体数占比为72.77%,Ⅲ—Ⅴ龄级个体数占比为26.34%,Ⅵ—Ⅷ龄级和Ⅸ—Ⅺ龄级个体数占比分别为0.89%和0,说明卵叶海桑拥有大量的幼龄个体,但缺少成龄和老龄个体。
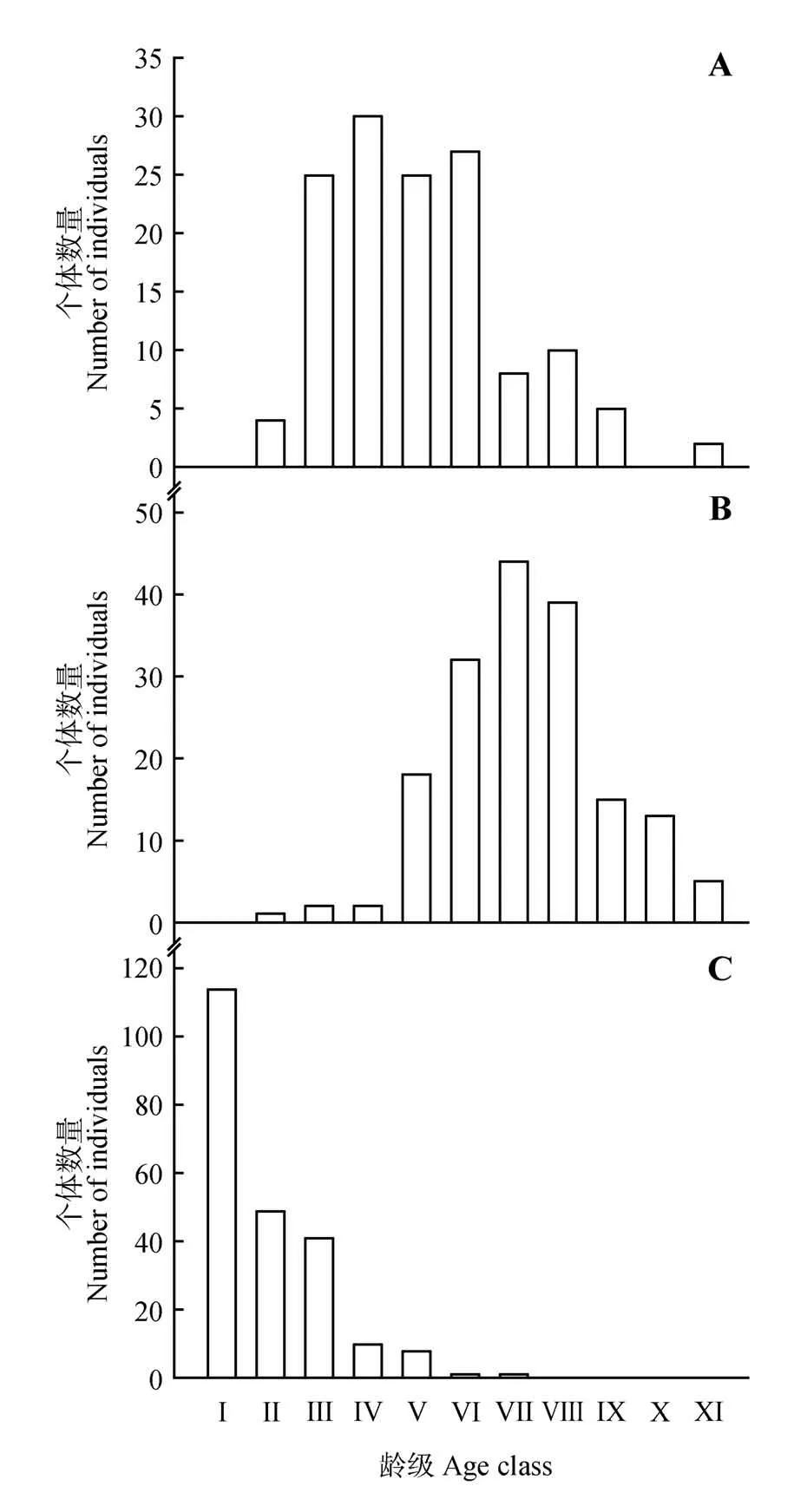
图1 3种海桑属濒危植物种群的径级结构A.海南海桑;B.拟海桑;C.卵叶海桑Fig.1 Age structure of three endangered mangrove species from genus SonneratiaA.S.×hainanensis;B.S.×gulngai;C.S.ovata
种群动态量化分析结果(表2)表明,海南海桑V1—V3、V5、V7、V10小于0,而V4、V6、V8、V9大于0,表现为“衰退—增长—衰退—增长—衰退—增长—衰退”的波动结构关系。拟海桑种群V1—V2、V4—V6小于0,V3等于0,而V7—V10大于0,表现为“衰退—稳定—衰退—增长”的波动结构关系。卵叶海桑种群V1—V5、V7大于0,而V6等于0,表现为“增长—稳定—增长”的波动结构关系。进一步分析种群数量动态变化指数Vpi和V′pi,海南海桑和拟海桑种群的Vpi虽然都大于0,但仅分别为9.56% 和11.77%,并且它们的V′pi也都极低,分别为0.44%和0.53%。由于它们的种群结构中幼龄个体极度缺乏,因此,海南海桑和拟海桑种群为衰退型。卵叶海桑种群Vpi>V′pi>0,并且Vpi和V′pi值都较大,表明卵叶海桑种群为增长型。

表2 3种海桑属濒危植物种群动态变化指数Table 2 Population dynamic index of three endangered mangrove species from genus Sonneratia
2.2 静态生命表与存活曲线、死亡率和消失率曲线
由静态生命表(见表3)可看出,随着龄级的增加,海南海桑和拟海桑种群的存活数量和生命期望总体表现为逐渐降低的趋势。卵叶海桑种群生命期望值总体呈先增后降的趋势,其中,Ⅴ龄级的生命期望最大。以龄级为x轴,以lnlχ、qχ、Kχ为y轴绘制各种群的存活曲线(见图2)和死亡率等曲线(见图3)。从存活曲线看(见图2),随着龄级的增长,各种群的lnlχ值逐渐减少,存活曲线总体表现为介于Deevey-Ⅱ和Deevey-Ⅲ之间。采用Hett等[27]的2 种函数方程分别对这3 种植物的存活曲线进行拟合检验,其中,海南海桑的拟合结果为y=7.865 7e-0.063x(R2=0.922,F=36.104,P<0.001)和y=8.002 6x-0.247(R2=0.724,F=23.578,P=0.001),拟海 桑 的 拟 合 结 果 为y=8.080 1e-0.073x(R2=0.939,F=38.292,P<0.001)和y=8.232 7x-0.287(R2=0.733,F=24.695,P=0.001),卵叶海桑的拟合结果为y=7.364 9e-0.1x(R2=0.953,F=137.090,P<0.001)和y=7.934 2x-0.423(R2=0.864 4,F=57.378,P<0.001)。模型检验结果显示,3 种植物的2 种模型的拟合结果均达到了极显著水平,而指数模型的R2均大于幂函数模型,且P更小,因此它们的存活曲线更趋近于Deevey-Ⅱ。从图3 中可知,各种群的死亡率曲线和消失率曲线的变化趋势一致,随着年龄的增长,各龄级呈波状上升趋势,其中海南海桑在Ⅴ、Ⅸ和Ⅺ龄级处有峰值,拟海桑在Ⅱ、Ⅴ、Ⅷ和Ⅺ龄级处有峰值,卵叶海桑在Ⅰ、Ⅲ和Ⅺ龄级处有峰值,说明3 种植物种群都易受到环境因子的影响,处于不稳定的状态。
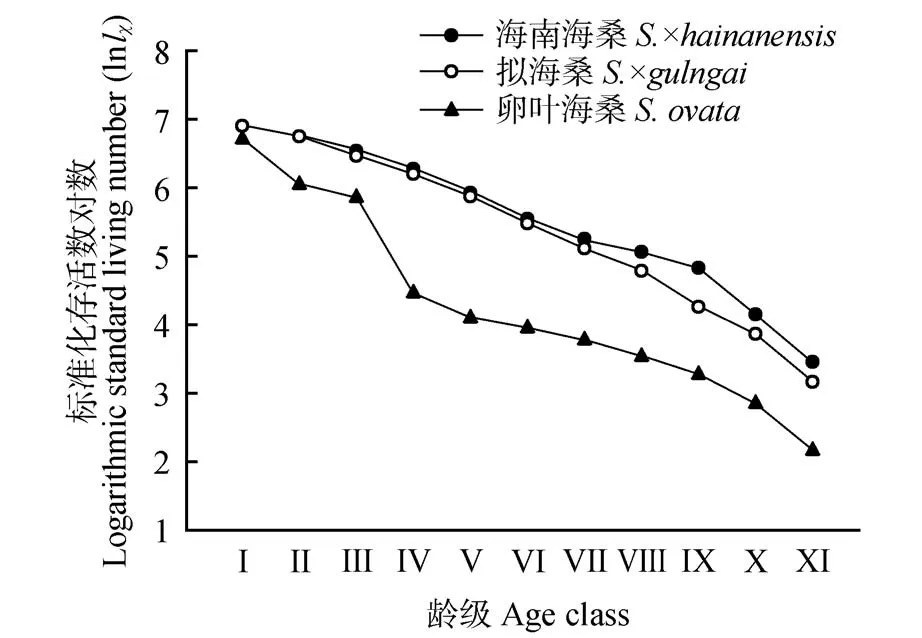
图2 3种海桑属濒危植物种群的存活曲线Fig.2 Survival curve of three endangered mangrove species from genus Sonneratia

图3 3种海桑属濒危植物种群的死亡率和消失率曲线A.海南海桑;B.拟海桑;C.卵叶海桑Fig.3 Mortality and vanish rate of three endangered mangrove species from genus SonneratiaA.S.×hainanensis;B.S.×gulngai;C.S.ovata

表3 3种海桑属濒危植物种群静态生命表Table 3 Static life table of three endangered mangrove species from genus Sonneratia
2.3 3种海桑属濒危植物种群的生存分析
由图4可知,海桑属各种群的生存率和累计死亡率均呈互补状态,随着龄级的增加,种群的生存率逐渐下降,累积死亡率逐渐上升,其中海南海桑和拟海桑种群在第Ⅲ龄级后达到平衡,卵叶海桑在第Ⅰ龄级后达到平衡,表明卵叶海桑比海南海桑和拟海桑更早进入衰退期。海南海桑和拟海桑种群的死亡密度曲线变化趋势在Ⅱ龄级后都比较平缓,危险率总体上保持逐渐上升的趋势。卵叶海桑对的死亡密度曲线和危险率曲线变化趋势一致,均在Ⅰ—Ⅲ龄级波动变化大,之后逐渐降低。说明这3种植物的种群稳定性都较差,其中海南海桑和拟海桑在整个生命周期均面临死亡危险,而卵叶海桑则在前期受到威胁。

图4 3 种海桑属濒危植物种群的生存率、累积死亡率、死亡密度和危险率曲线A.海南海桑;B.拟海桑;C.卵叶海桑Fig.4 Survival rate,cumulative mortality rate,mortality density and hazard rate of three endangered mangrove species from genus SonneratiaA.S.×hainanensis;B.S.×gulngai;C.S.ovata
2.4 三种海桑属濒危植物种群数量的时间序列分析
时间序列分析结果(见表4)显示,海南海桑和拟海桑种群分别为从Ⅴ和Ⅷ龄级开始之后有不同程度的增加,经过8 和10 个龄级时间,都开始降低并趋于稳定,海南海桑降低幅度较小,说明两者种群在过了自身的生理年龄后将开始衰退。Ⅱ—Ⅳ龄级阶段的海南海桑种群在经过2 个龄级时间后分别下降了50.00%、42.00%和8.33%,Ⅱ—Ⅷ龄级阶段的拟海桑在经过2 个龄级时间后分别下降了50.00%、25.00%、0、44.44%、21.88%和13.64%。说明海南海桑和拟海桑种群都严重缺乏幼龄个体,自我更新能力较差,未来种群数量逐渐衰退。卵叶海桑各龄级种群数量都呈逐渐增加的趋势,说明其幼龄个体数量充足,具有良好的恢复潜力,未来种群数量逐步增加,但由于种群个体数随龄级增加呈衰减趋势,若继续保持这种态势,将有可能导致龄级断层现象。
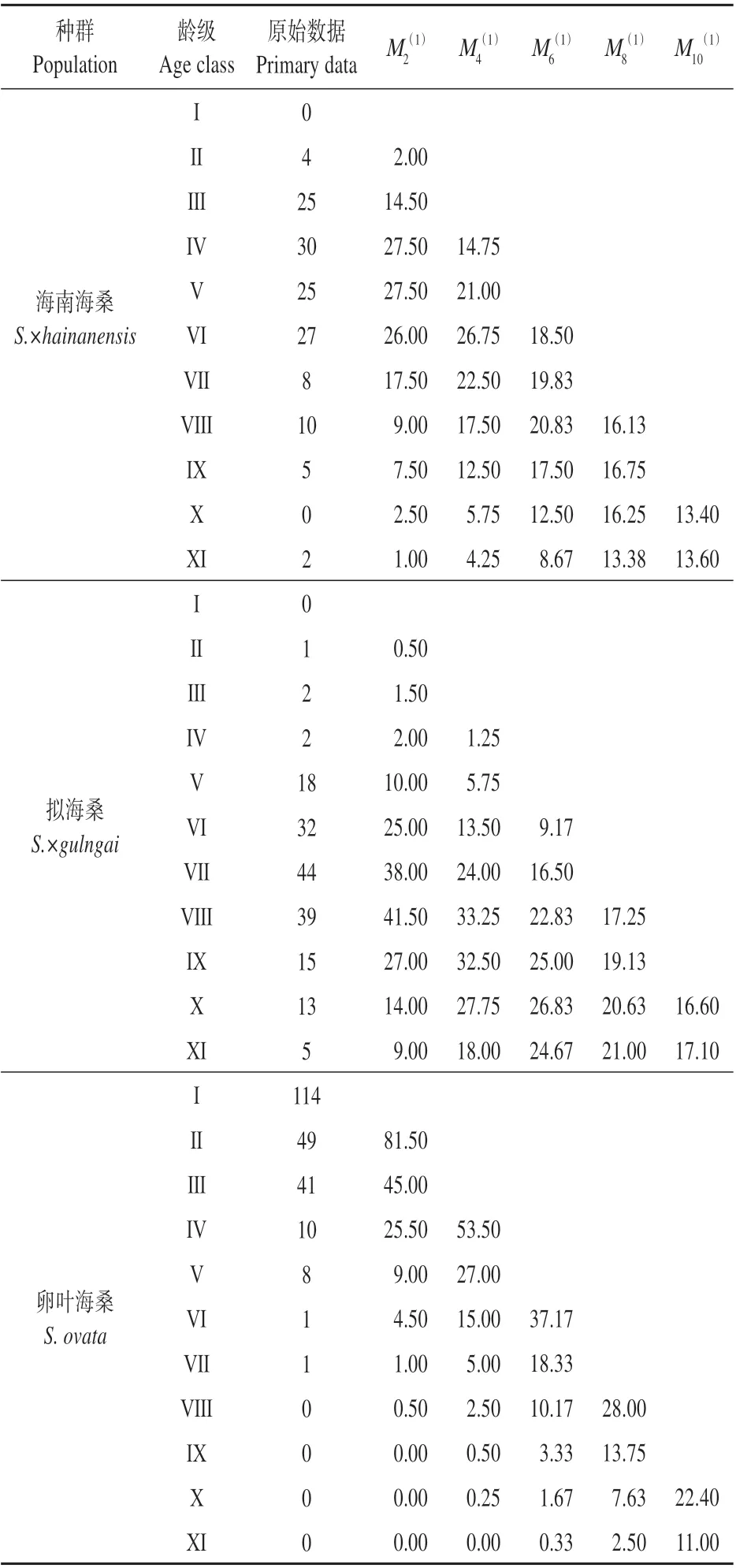
表4 三种海桑属濒危植物种群动态变化的时间序列分析Table 4 Time sequence analysis of three endangered mangrove plants of the genus Sonneratia
3 讨论与结论
3.1 3种海桑属濒危植物的种群结构
植物种群结构是植物对自然环境因子适应性的体现之一,能够反映种群内部个体生长发育的过程,并揭示种群的生存现状以及更新策略[30]。本研究认为3 种海桑属濒危植物具有不同的种群结构,其中,海南海桑和拟海桑均为不规则的“金字塔型”,种群动态指数也都显示为衰退型。这2个种群分别以中龄和成龄个体占优势,幼龄个体缺乏,种群结构不稳定,随时面临衰退的危险。导致海南海桑和拟海桑幼龄个体数量缺乏的原因可能是:(1)由于野生个体数稀少,加上果实极易受螃蟹等动物食用,导致种子产量低、品质差,向幼苗的转化率也低[22]。(2)林下光照不足、海水高盐度以及生境破坏引发的潮汐不规律等因素,在很大程度上限制了种子萌发[21]。濒危植物羽叶丁香(Syringa pinnatifolia)和红树植物海榄雌也表现出同样的种群结构,其中,前者种群的衰退与其自身繁殖受限有关,但后者种群的衰退则与其群落所处演替阶段息息相关[6,12]。卵叶海桑的种群结构表现为“倒J 型”,幼龄个体数量充足,属于增长型种群;其种群个体数随龄级的增加逐渐降低,并且在幼龄—中龄阶段降低幅度较大且存活率较低,导致成龄和老龄个体缺失。这与濒危植物云杉种群(Picea crassifolia)的研究结果[31]相类似。研究表明,卵叶海桑幼苗对光照、盐度、潮汐等环境因子的适应性高于海南海桑和拟海桑,这可能是其种群结构中幼龄个体占优势的主要原因[24]。此外,清澜港保护区是3种海桑属濒危植物天然分布区,50 年来,由于养殖业、旅游业或房地产业的不当开发和利用,造成栖息地被破坏,该区域内的红树林面积转化成养殖水面。在这个过程中,大量的红树林遭到破坏。如霞场村在2000年前有连片分布的卵叶海桑群落,后因挖塘破坏,使现存的卵叶海桑呈零星状分布[11]。这种现象也导致了卵叶海桑种群结构中成龄和老龄个体的大量缺失。因此,海桑属濒危植物的种群结构受到生物(人类活动、动物啃食、种内竞争等)与非生物(光照、盐度、潮汐等)诸多因素的共同影响。
3.2 3种海桑属濒危植物种群的动态特征
静态生命表是研究植物种群动态趋势的一种重要手段,结合生存分析,可直观地表达植物种群的动态变化,对珍稀濒危植物的保护和利用具有重要意义[32]。对于濒危植物而言,其存活曲线的表现形式并不是单一的,有的物种在不同的生境中具有不同的存活曲线[6-7],而有的物种则表现为相同的存活曲线[33]。本研究认为3 种海桑属植物种群均属于Deevey-Ⅱ型,各种群的死亡率曲线和消失率曲线的变化趋势一致,并随着龄级的增加呈波状上升趋势,其中海南海桑在Ⅴ、Ⅸ和Ⅺ龄级处有峰值,拟海桑在Ⅱ、Ⅴ、Ⅷ和Ⅺ龄级处有峰值,卵叶海桑在Ⅰ、Ⅲ和Ⅺ龄级处有峰值,说明3 种植物种群都易受到环境的影响,处于不稳定的状态,并且海南海桑和拟海桑种群的发展均在老龄阶段遇到了障碍,这可能是因为一部分老龄个体的生理生长到了极限,对光照、水分、土壤养分等环境资源的竞争力下降,因而逐渐衰老。濒危植物羽叶丁香和长柱红山茶(Camellia longistyla)也存在这种现象[6,34]。卵叶海桑则是幼龄个体的发展遇到了瓶颈,说明其幼龄个体数量虽然较多,但现有生境因子对幼龄个体的环境筛作用较强,因而也导致幼龄个体与中龄个体、成龄个体间较低的转化率。这与周公山峨眉含笑(Michelia wilsonii)天然种群的动态特征[35]比较相似。时间序列分析也认为海南海桑和拟海桑种群自我更新能力较差,未来种群数量逐渐衰退。卵叶海桑幼龄个体数量充足,具有良好的恢复潜力,未来种群数量逐步增加,但由于种群个体数随龄级增加呈衰减趋势,若继续保持这种态势,将有可能导致龄级断层现象。人类的养殖活动导致原有生境破碎化,产生了一系列不适宜种子萌发与幼苗生长的环境因子(光照、盐度、潮汐),这在很大程度上抑制了海桑属濒危植物种群的繁殖与自然更新。因此,要改变海南海桑和拟海桑种群衰退的现状,并保障卵叶海桑种群数量稳定增长,必须采取人为辅助措施,对其种群进行保护与恢复。
3.3 3种海桑属濒危植物种群的保护与恢复策略
针对3种海桑属植物的种群特征与濒危现状,可以从3个方面考虑其种群保护和恢复策略:
一是积极开展人工辅助育种工作,突破育种难题,从根本上解决其种源扩大问题。(1)由于海桑属濒危红树植物的母树个体较少,且分布不集中,因而导致其被迫进行同株异花传粉,最终出现雄蕊败育、落花、落果等自交退化现象[22],而采用异株异花人工辅助授粉可减少出现这种现象的频率,提高传粉效率和坐果率。(2)采用传统选育和分子育种等人工辅助育种技术,加强海桑属濒危红树植物的高效培育技术研究,提高优质种源数量及其萌发率。(3)建立一定规模的红树林苗圃,规模化生产优质种苗,并通过异地引种栽培来增强海桑属濒危红树植物对环境的适应性,提高幼苗的存活率。
二是要加大就地保护力度,营造适宜的生态环境。(1)目前海桑属濒危红树植物的自然居群都在保护区范围内,建议根据其适宜生长的生境范围划分重点保护小区。对于保护小区内的野生海桑属濒危红树植物资源进行编号登记保护,定期巡视观察。(2)对其现有生境进行改造和恢复,清理红树林内淤积,降低滩涂高程,恢复正常潮水浸淹频率,以利于其种群的正常更新。(3)加强人工抚育管理,合理配置群落结构,恢复其退化前的稳定而结构合理的生态系统,这也是保障其种群自然更新的有利措施。
三是优化迁地保护策略,科学实施野外回归。(1)确定海桑属濒危红树植物的迁地保护策略,通过详细测定海桑属濒危红树植物现有生境的气候、潮汐、土壤、植被和底栖生物等生态因子状况,结合其种子萌发和幼苗生长所需的适宜条件,确定合适的迁移地。(2)将达到出圃标准的幼苗经野外驯化后进行回归种植,种植后持续跟踪监测环境因子并及时调控,以减小致濒危因子的影响,提高幼苗的存活率。这些措施对于海桑属濒危红树植物的自我更新以及种群数量的扩大具有重要意义。

