miR-21-5p通过调控TGF-β1减轻2型糖尿病心肌病小鼠的心肌损伤
秦超师,陈蕊蕊,李泽霖,纪兆乐,刘鹏云(空军军医大学第二附属医院心血管内科,西安 710038;通讯作者,E-mail:pengyltdyy@126.com)
糖尿病及其并发症已成为备受关注的公共卫生问题。糖尿病患者死亡的主要原因是心血管疾病。既往研究也显示,即使血糖水平处于糖尿病前期的人群,其发生远期心血管事件和全因死亡的风险也显著增加[1,2]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病常见的心血管并发症,是糖尿病患者因代谢紊乱引起的非缺血性、非高血压性心肌病,其特点是心脏结构改变和左室功能障碍[3,4]。糖尿病心肌病的进展通过炎症、氧化应激和糖脂毒性等引起,从而导致糖尿病心脏的结构改变[5]。DCM已经被认为是糖尿病患者心力衰竭高发病率和高死亡率的主要因素。
microRNAs(miRNAs)是一类长度约为20~24个核苷酸的非编码单链内源性小RNA,在动植物中调控转录后的基因表达。miRNAs已被发现参与细胞分化、发育、组织生长和脂肪代谢等生理过程[6]。最近的研究表明,它们可以作为各种心血管疾病的潜在调节剂[7]。其中microRNA-21-5p(miR-21-5p)广泛存在于哺乳动物组织和器官中,Qiao等[8]报道miR-21-5p可以通过调节PTEN/Akt信号通路来增强血管生成和心肌细胞存活,从而促进心脏修复。并且本课题组前期研究结果也发现,miR-21-5p可显著改善阿霉素诱导的心脏毒性[9]。然而,miR-21-5p对2型糖尿病条件下的心肌细胞损伤的影响及作用机制有待进一步探究。
转化生长因子β(transforming growth factor-beta,TGF-β)是一种多功能细胞因子,可调节细胞生长、增殖、分化、迁移和凋亡[10]。人体内有3种TGF-β亚型,它们具有相似的生物学特征。其中,TGF-β1的存在比例最大,活性最高。它可通过自分泌和旁分泌途径发挥其调节作用,参与到炎症激活及活性氧(reactive oxygen species,ROS)的产生过程中[11]。本研究拟通过对db/db小鼠心肌miR-21-5p的表达进行增强和抑制处理,研究miR-21-5p对DCM小鼠心肌氧化应激、炎症和细胞凋亡的影响及miR-21-5p能否靶向TGF-β1发挥作用,以期为DCM所致的心肌损伤提供新的治疗靶点。
1 材料和方法
1.1 材料
1.1.1 实验动物 清洁级雄性db/db和db/m小鼠,8周龄,购自南京大学模式动物研究所。动物生产许可证号:SCXK(苏)2016-001,动物使用许可证号:SYXK(陕)2020-007。所有小鼠均在清洁级动物实验室中适应性饲养1周。动物实验通过空军军医大学动物伦理审查委员会的审批(审批号:DW-KYD2021-065)。
1.1.2 主要试剂 乳酸盐脱氢酶(lactate dehydrogenase, LDH)、肌酸激酶同工酶(creatine kinase-MB, CK-MB)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购自南京建成生物工程研究所;超氧化物阴离子荧光探针(dihydroethidium,DHE)购自美国Invitrogen公司;肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素1β(interleukin-1 beta,IL-1β)和白细胞介素6(interleukin-6,IL-6)ELISA检测试剂盒购自武汉默沙克生物科技有限公司;TUNEL检测试剂盒购自美国Roche公司;TRIzol试剂购自美国Merck公司;miR-21-5p、TGF-β1、NOX2、NOX4、U6和GAPDH的引物由上海生工生物科技有限公司构建;逆转录PrimeScriptTM RT reagent Kit试剂盒和PrimeScriptTM PLUS RT-PCR Kit试剂盒购自日本TaKaRa公司;双荧光素酶报告基因试剂盒购自美国Promega公司;miRNA NC、miR-21-5p agomir和miR-21-5p antagomir购自上海吉玛公司,miRNA NC序列为5′-CAGUACUUUUGUGUAGUACAA-3′,miR-21-5p agomir序列为5′-UAGCUUAUCAGACUGAUGUUGA-3′;miR-21-5p antagomir序列为:5′-UCAACAUCAGUCUGAUAAGCUA-3′;TGF-β1、NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase-recruitment domain, ASC)、cleaved Caspase-1、cleaved Caspase-3及GAPDH抗体购自美国Abcam公司;羊抗兔、羊抗鼠二抗购自北京中杉金桥公司。
1.2 方法
1.2.1 动物分组及处理 为了探究agomir和antagomir对心肌miR-21-5p表达水平的影响,将24只db/m小鼠随机分为正常对照组(Con组)、miRNA NC处理组(miR-NC组)、miR-21-5p agomir处理组(miR-agomir组)和miR-21-5p antagomir处理组(miR-antagomir组),每组6只。miR-NC、miR-agomir组和miR-antagomir组小鼠每3 d分别经尾静脉注射100 μl 10 nmol/L的miRNA NC、miR-21-5p agomir和miR-21-5p antagomir,共10次。Con组小鼠则在相同时间点经尾静脉注射同等剂量的生理盐水。完成末次尾静脉注射后1 d,处死小鼠并取材,采用qRT-PCR法测定各组小鼠心脏miR-21-5p mRNA表达水平。
为了探究miR-21-5p对2型糖尿病心肌病小鼠心肌损伤的影响及机制,将30只db/db小鼠随机分为模型组(DCM组)、模型+miR-21-5p agomir处理组(DCM+miR-agomir组)和模型+miR-21-5p antagomir处理组(DCM+miR-antagomir组),每组10只。另选取10只db/m小鼠作为正常对照组(Con组)。DCM+miR-agomir组和DCM+miR-antagomir组小鼠每3 d分别经尾静脉注射10 nmol/L的miR-21-5p agomir和miR-21-5p antagomir,共10次。Con组和DCM组小鼠则在相同时间点经尾静脉注射同等剂量的生理盐水。db/db小鼠继续给予高糖高脂饲料喂养,db/m小鼠则继续给予正常饲料喂养。
1.2.2 生化指标测定 ①LDH及CK-MB水平测定:采用眼眶取血法取血约1 ml,静置后留取上层血清。按照说明书使用试剂盒检测血清中CK-MB和LDH水平。②MDA、SOD、GSH和GSH-Px水平测定:将心脏组织置于预冷的生理盐水中漂洗后,按质量体积比为1 ∶10的比例用匀浆机匀浆。离心取上清,按照相应试剂盒说明书检测心肌组织中MDA、SOD、GSH和GSH-Px的水平。③TNF-α、IL-1β和IL-6水平测定:按照提供的ELISA试剂盒说明书检测小鼠TNF-α、IL-1β和IL-6的水平。用酶标仪测量相应波长下的光密度(OD)值。绘制OD值与浓度的标准曲线,根据标准曲线计算样品浓度。
1.2.3 超声心动图检测 小鼠腹腔注射1%戊巴比妥钠(0.05 ml/20 g)麻醉后固定四肢,脱去小鼠心前区毛发,使用超声探头进行检测。采用二维超声心动图检测左心室短轴部分,M型超声心动图检测左心室运动情况。所有数据在相同参数下处理,每个测量指标值为连续3个心动周期的平均值。通过计算得出左室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS),以评价左室心脏收缩功能。
1.2.4 心肌细胞凋亡检测 将心脏石蜡切片进行常规脱蜡、水合处理,磷酸盐平衡液(PBS)洗涤3次。玻片在20%正常胎牛血清中室温孵育30 min,将TUNEL反应混合物滴在切片上,37 ℃孵育1 h。PBS液洗涤3次后经3% H2O2甲醇溶液室温封闭10 min。最后用DAPI染液复染细胞核,激光共聚焦显微镜观察,凋亡细胞核显示为绿色。
1.2.5 qRT-PCR测定miR-21-5p、TGF-β1、NOX2、NOX4 mRNA表达水平 使用TRIzol试剂从组织和细胞中分离总RNA,使用逆转录试剂盒对总RNA进行反转录并进行cDNA扩增。反应参数:95 ℃变性5 min,94 ℃变性30 s,60 ℃退火30 s,共40个循环。引物序列见表1。miR-21-5p的表达量以U6为参照,TGF-β1、NOX2和NOX4的表达量以GAPDH为参照,数据采用2-ΔΔCt法计算。

表1 qRT-PCR分析引物序列Table 1 Primer sequences used for quantitative real-time PCR analysis
1.2.6 双荧光素酶报告实验 为了验证TGF-β1是否是miR-21-5p的有效靶点,我们将构建的野生型TGF-β1 WT 3′-非翻译区(untranslational region, UTR)和突变型TGF-β1 MuT 3′-UTR插入检测质粒中。H9c2细胞与含有TGF-β1 3′-UTR的质粒和miR-21过表达质粒通过Lipofectamine 2000共转染,以非靶向阴性对照RNA共转染作为对照。转染后48 h,利用双荧光素酶试剂盒检测细胞荧光强度,以萤火虫荧光素酶/海肾荧光素酶比值表示荧光素酶相对活性。
1.2.7 心肌组织ROS生成检测 迅速摘下心脏标本用冷冻切片机切成5 μm的切片,放置在冷冻的显微镜载玻片上。将二氢乙锭(DHE)染液滴加在玻片上,37 ℃的水浴箱中孵育30 min。PBS溶液洗片后用激光共聚焦显微镜观察,采用Image J软件对DHE荧光强度进行分析以表示ROS生成量的多少。
1.2.8 心肌组织蛋白表达测定 用裂解缓冲液提取心肌组织总蛋白,样品检测浓度后,按50 μg每孔的蛋白上样量用6%~15% SDS-PAGE凝胶分离,并转移到聚偏二氟乙烯膜上。用5%脱脂奶粉在室温下封闭膜2 h,然后膜与TGF-β1(1 ∶1 000)、NLRP3(1 ∶1 000)、ASC(1 ∶1 000)、cleaved Caspase-1(1 ∶1 000)、cleaved Caspase-3(1 ∶1 000)及GAPDH(1 ∶5 000)一抗抗体在4 ℃的温度下过夜孵育。次日,用含Tris 0.1% Tween 20缓冲液洗涤膜3次,与辣根过氧化物酶标记的二抗在室温下孵育1 h,采用增强化学发光法和生物特征凝胶成像系统检测蛋白水平,并以GAPDH作为内参。
1.3 统计学分析
所有数据均以平均数±标准差表示。使用SPSS 17.0软件进行数据处理。符合正态分布的两组数据间差异采用Student’st检验,单因素方差分析(ANOVA)加Tukey’s post hoc检验用于分析比较多组数据间的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-21-5p agomir和antagomir对miR-21-5p表达水平的影响
为了检验miR-21-5p agomir和miR-21-5p antagomir对小鼠心肌miR-21-5p表达改变的有效性,通过qRT-PCR结果发现,与Con组相比,miR-agomir组小鼠心肌miR-21-5p表达显著提高(P<0.01),而miR-antagomir组小鼠心肌miR-21-5p表达明显被抑制(P<0.01),并且miR-NC组与Con组小鼠心肌miR-21-5p表达的差异无统计学意义(P>0.05,见图1)。以上结果表明尾静脉注射miR-21-5p agomir和miR-21-5p antagomir能有效改变小鼠心肌miR-21-5p表达,而miRNA NC对小鼠心肌miR-21-5p表达无明显影响。

与Con组相比,**P<0.01图1 miR-21-5p agomir和antagomir对miR-21-5p表达水平的影响Figure 1 Effects of miR-21-5p agomir and antagomir on the expression level of miR-21-5p
2.2 各组小鼠心肌组织中miR-21-5p和TGF-β1表达水平比较
与Con组相比,DCM组小鼠心肌组织miR-21-5p的表达显著下降(P<0.01),TGF-β1表达明显升高(P<0.01,见图2)。与DCM组相比,DCM+miR-antagomir组小鼠心肌组织miR-21-5p的表达进一步减低(P<0.05),TGF-β1表达进一步增加(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠心肌组织miR-21-5p的表达则显著提高(P<0.01),TGF-β1表达明显降低(P<0.01,见图2)。

与Con组相比,**P<0.01;与DCM组相比,#P<0.05,##P<0.01图2 各组小鼠心肌组织中miR-21-5p和TGF-β1表达水平比较Figure 2 Comparison of expression of miR-21-5p and TGF-β1 in myocardial tissue among four groups
2.3 各组小鼠心功能及心肌损伤标志物表达水平比较
通过检测血清心肌损伤标志物LDH及CK-MB结果发现,与Con组相比,DCM组小鼠血清内LDH及CK-MB水平显著上升(P<0.01)。与DCM组相比,DCM+miR-antagomir组小鼠血清内LDH及CK-MB的水平进一步增加(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠血清内LDH及CK-MB的水平显著降低(P<0.01,见图3)。超声心动图检测心脏功能结果显示,与Con组相比,DCM组小鼠LVEF和LVFS值显著下降(P<0.01)。与DCM组相比,DCM+miR-antagomir组小鼠LVEF和LVFS值进一步减低(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠LVEF和LVFS值明显提高(P<0.01,见图3)。

与Con组相比,**P<0.01;与DCM组相比,##P<0.01图3 各组小鼠心功能及心肌损伤标志物表达比较Figure 3 Comparison of cardiac function and myocardial injury markers among four groups
2.4 各组小鼠心肌细胞凋亡情况比较
TUNEL染色结果显示,与Con组相比,DCM组小鼠凋亡心肌细胞数目明显增加(P<0.01),且诱导细胞发生凋亡的剪切蛋白cleaved Caspase-3表达显著上升(P<0.01)。与DCM组相比,DCM+miR-antagomir组小鼠心肌细胞凋亡数目进一步增加(P<0.01),cleaved Caspase-3表达进一步上升(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠心肌细胞凋亡数目明显减少(P<0.01),且cleaved Caspase-3表达显著下降(P<0.01,见图4)。

与Con组相比,*P<0.05,**P<0.01;与DCM组相比,##P<0.01图4 各组小鼠心肌细胞凋亡情况比较Figure 4 Comparison of cardiomyocyte apoptosis among four groups
2.5 各组小鼠心肌组织氧化应激水平比较
与Con组相比,DCM组小鼠心肌组织MDA含量及ROS生成量显著增加(P<0.01),NOX2和NOX4 mRNA表达显著上升(P<0.01),而SOD、GSH和GSH-Px的含量则明显下降(P<0.01,见图5和图6)。与DCM组相比,DCM+miR-antagomir组小鼠心肌组织MDA含量及ROS生成量进一步增加(P<0.01),NOX2和NOX4 mRNA表达进一步上升(P<0.01),而SOD、GSH和GSH-Px的含量则进一步下降(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠心肌组织MDA及ROS的生成显著降低(P<0.01),NOX2和NOX4 mRNA表达显著下调(P<0.01),同时SOD、GSH和GSH-Px的合成明显增加(P<0.01,见图5和图6)。

与Con组相比,**P<0.01;与DCM组相比,#P<0.05,##P<0.01图5 各组小鼠心肌组织MDA、SOD、GSH和GSH-Px水平比较Figure 5 Comparison of levels of MDA, SOD, GSH and GSH-Px in myocardial tissues among four groups

与Con组相比,**P<0.01;与DCM组相比,##P<0.01图6 各组小鼠心肌组织ROS生成及氧化应激相关分子表达比较(红色荧光显示切片ROS着色)Figure 6 Comparison of ROS generation and expressions of oxidative stress-related molecules in myocardial tissues among four groups
2.6 各组小鼠心肌组织炎症水平比较
与Con组相比,DCM组小鼠心肌组织IL-1β、IL-6和TNF-α水平显著增加(P<0.01),NLRP3、ASC和cleaved Caspase-1表达明显上升(P<0.01)。与DCM组相比,DCM+miR-antagomir组小鼠心肌组织IL-1β、IL-6和TNF-α水平进一步增加(P<0.01),NLRP3、ASC和cleaved Caspase-1表达进一步上升(P<0.01);而与DCM组相比,DCM+miR-agomir组小鼠心肌组织IL-1β、IL-6和TNF-α水平显著降低(P<0.01),NLRP3、ASC和cleaved Caspase-1表达显著下调(P<0.01,见图7)。
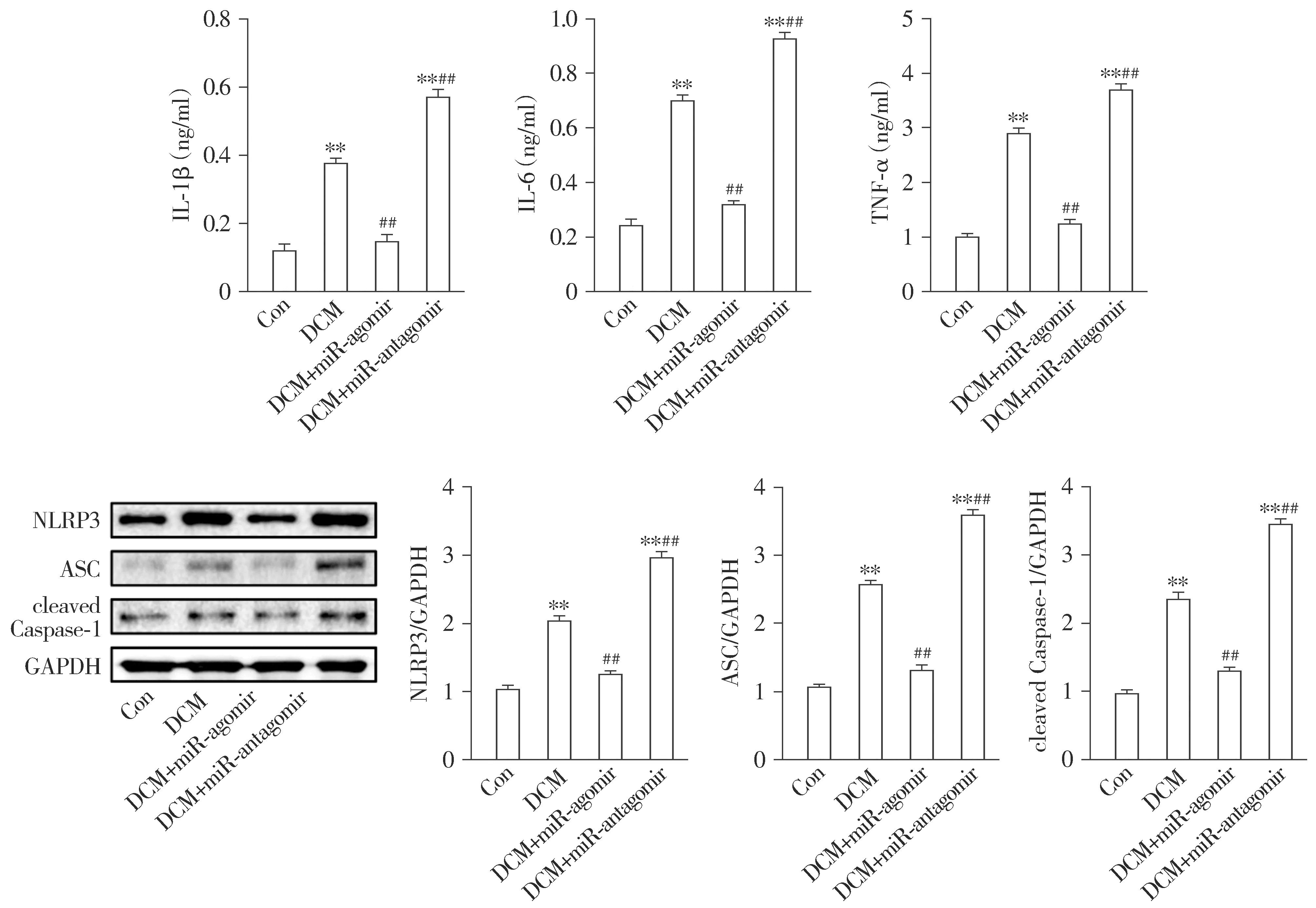
与Con组相比,**P<0.01;与DCM组相比,##P<0.01图7 各组小鼠心肌组织炎症水平比较Figure 7 Comparison of inflammation levels in myocardial tissues among four groups
2.7 miR-21-5p靶向调控TGF-β1的表达
为了进一步明确miR-21-5p和TGF-β1分子间的靶向调控关系,我们通过TargetScan数据库预测结果显示,TGF-β1是miR-21-5p的潜在靶基因(见图8)。双荧光素酶实验报告发现,过表达miR-21-5p显著抑制野生型TGF-β1的表达水平(P<0.01),而突变型组中过表达miR-21-5p对TGF-β1的表达水平差异无统计学意义(P>0.05,见图8),提示TGF-β1是miR-21-5p的靶基因。并且,与TGF-β1组相比,TGF-β1+miR-21-5p mimic组H9c2细胞中TGF-β1蛋白和mRNA水平均显著降低(P<0.01,见图9),进一步验证了TGF-β1是miR-21-5p的下游靶基因。

与NC组相比,**P<0.01图8 双荧光素酶实验报告miR-21-5p和TGF-β1分子间的靶向关系Figure 8 Targeted relationship between miR-21-5p and TGF-β1 by dual luciferase experiment

与TGF-β1组相比,**P<0.01图9 miR-21-5p靶向调控TGF-β1的表达Figure 9 MiR-21-5p targets the expression of TGF-β1
3 讨论
糖尿病是最常见的慢性疾病之一,给全世界的公共卫生带来了巨大的负担。现全球有4.51亿糖尿病患者,预计到2045年这一数字将上升到6.93亿[12]。
心血管并发症是与糖尿病相关的主要死亡原因,占死亡人数的50%~80%[2]。糖尿病心肌病是糖尿病患者因代谢紊乱引起的非缺血性、非高血压性心肌病,患病率约占糖尿病人群的17%[3]。与非糖尿病患者相比,2型糖尿病患者因糖尿病心肌病导致的心力衰竭、心律失常和猝死的发生率明显增加[13]。因此,有必要寻找有效的干预措施,以减轻糖尿病患者发生的心肌损伤。
相关研究已经证实,miR-21在心血管疾病的诊断和治疗中发挥了重要作用[14,15]。前期本课题组研究结果也发现,miR-21-5p可显著改善阿霉素诱导的心脏毒性[9]。更为重要的是,与非糖尿病对照相比,miR-21-5p及其外泌体在链脲佐菌素诱导的糖尿病大鼠心脏中的表达水平均显著降低[16]。同时,Zhao等[17]研究发现,激活GAS5/miR-21-5p轴可以减轻高糖诱导的人心肌样AC16细胞损伤。Han等[18]报道证实,miR-21-5p通过PTEN/Akt/FOXO3a信号通路减轻高糖/高脂引起的H9c2细胞损伤。然而,miR-21-5p是否同样能在在体动物水平上发挥改善糖尿病心肌损伤的作用及其潜在的分子机制仍需进一步探究。
本实验结果发现,与Con组相比,DCM组小鼠心肌组织miR-21-5p的表达显著下降。而miR-21-5p激动剂和拮抗剂的应用表明,与DCM组相比,上调miR-21-5p的表达可显著降低糖尿病心肌病小鼠血清内LDH及CK-MB的水平,明显提高心脏功能(LVEF和LVFS值显著上升),显著抑制心肌细胞凋亡及cleaved Caspase-3表达。以上结果提示,上调心肌miR-21-5p同样可以显著减轻糖尿病心肌损伤。
虽然DCM的确切病理生理机制尚未完全阐明,但线粒体功能障碍、氧化应激、炎症、心肌细胞凋亡或坏死、自噬、内质网应激、心肌纤维化、糖脂毒性等均参与其中[19]。在这些机制中,氧化应激和炎症对糖尿病心肌代谢障碍起着重要作用。氧化应激会诱导心肌细胞代谢稳态的失衡,导致葡萄糖耐受不良。反之这些用于产生能量的底物的改变导致脂肪酸摄取和氧化失衡,从而导致线粒体功能障碍并产生大量的活性氧物质。活性氧和氧化应激则可通过蛋白质氧化、脂质过氧化和DNA损伤等途径诱导细胞功能障碍和细胞损伤[20]。此外,2型糖尿病患者中慢性心肌炎症介导的心肌代谢改变会导致心肌细胞凋亡和钙处理受损,而介导的心脏结构变化则可继发心肌细胞肥大和心肌纤维化[21]。因此,有效抑制心肌氧化应激和炎症是改善糖尿病心肌病心肌损伤及延缓糖尿病心肌病向晚期心衰发生发展的关键措施。
大量研究报道,miR-21-5p具有显著的抗氧化应激和抗炎特性。Zhang等[22]的研究发现,在脓毒症诱导的急性肾损伤模型中,miR-21-5p表达的增强可改善肾功能和肾组织病理损伤,减轻血清炎症反应,降低肾组织的凋亡和氧化应激反应。Shen等[23]研究发现,MSC-EXOs通过miR-21-5p促进巨噬细胞极化为M2表型,从而减少炎症并促进心脏修复。Yuan等[24]研究发现,过表达miR-21-5p通过抑制自噬继而减轻氧化应激诱导的RSC96细胞凋亡。我们的实验结果同样发现,与DCM组相比,上调miR-21-5p的表达可明显减低糖尿病小鼠心肌组织MDA及ROS的生成,显著下调NOX2和NOX4 mRNA的表达,同时明显增加SOD、GSH和GSH-Px的水平。此外,与DCM组相比,DCM+miR-agomir组小鼠心肌组织IL-1β、IL-6和TNF-α水平显著降低,NLRP3、ASC和cleaved Caspase-1表达明显下降。以上结果表明,miR-21-5p可能通过调控氧化应激和炎症反应缓解糖尿病心肌病小鼠的心肌损伤。
为了进一步阐明miR-21-5p减轻心肌组织氧化应激和炎症的潜在分子机制,我们通过查阅文献发现,TGF-β1不仅在调控氧化应激和炎症中发挥了重要作用[25],也在调控糖尿病心肌病心肌损伤中扮演关键角色[10]。Wu等[26]报道表明,替米沙坦通过TGF-β1/Smad信号通路减轻糖尿病心肌病大鼠炎症反应和心肌细胞凋亡。Dugbartey等[27]报道证实,硫辛酸、格列齐特和雷米普利联合治疗可通过抑制TGF-β1/Smad通路预防糖尿病性心肌病的发生。更为重要的是,miR-21-5p与TGF-β1在相关研究中已证实具有潜在的调控关系。Wang等[28]研究发现,过表达miR-21可直接抑制TGF-β1介导的糖尿病肾病纤维化。雷磊等[29]研究发现,miR-21-5p通过靶向抑制TGF-β1的表达来减轻LPS诱导的脓毒症。史东东等[30]发现,miR-21-5p通过靶向下调TGF-β1的表达水平,促进大鼠H9c2心肌细胞增殖和抑制细胞凋亡。本研究结果显示,TGF-β1在DCM组中异常高表达,经miR-21-5p agomir处理后,TGF-β1蛋白表达水平显著降低。双荧光素酶结果显示,miR-21-5p与TGF-β1相互作用,在DCM小鼠心肌组织中miR-21-5p能靶向负调控TGF-β1。
综上所述,本研究首次发现,miR-21-5p通过靶向负调控TGF-β1的表达抑制心肌组织氧化应激损伤和炎症反应,减轻了细胞凋亡和心脏功能障碍,从而缓解了糖尿病心肌病小鼠的心肌损伤。miR-21-5p有望成为临床上糖尿病患者发生心肌损伤时的关键分子干预靶点。

