HILIC-MS/MS法检测动物源运动营养品中9种抗病毒药物残留
郭 巍
(焦作大学,河南 焦作 454000)
抗病毒药物是一类用于预防和治疗人和动物病毒感染的药物,常用的有阿昔洛韦、奥司他美金刚、奈韦拉平等[1-2]。由于抗病毒药物对畜禽的病毒性流感有一定的预防和治疗作用,且价格低廉,所以也常被用于畜禽养殖业[3-4]。但因缺乏相应的科学规范以及安全可靠的数据支持,将人用抗病毒药物移作兽用,会在动物体内造成药物残留,还可能会使病毒菌株发生变异,危害人类健康[5-6]。但是对抗病毒药物多组分的检测方法尚不完善,为了防止通过食物链引起中毒,尤其是动物源性运动营养品这类特殊食品,有必要建立一种快速检测这些目标组分的方法,加强动物源性运动营养品中抗病毒药物残留的监控。
运动营养品对产品的安全性要求较高,市场上以动物源为基质的运动营养品品种繁多,所占市场份额也越来越大。近年来,食品中兽药残留事件频频曝光,所以人们对这类特殊食品中的药物残留越来越重视,而抗病毒药物残留是研究的热点[7-9]。目前食品中抗病毒药物残留的检测方法主要有酶联免疫法[10-12]、高效液相色谱法[13-14]、液相色谱—串联质谱法[15-16]等。酶联免疫法由于仪器精度所限,检测灵敏度较低;高效液相色谱法较为常用,但是对于极性组分相近的物质,分离度较差;高效液相色谱—串联质谱法流动相中要使用离子对试剂,存在系统稳定性差以及抑制待组分电离的问题。亲水交互作用色谱(Hydrophilic interaction chromatgraphy,HILIC)是一种组分分离模式介于正相色谱和反相色谱之间的色谱技术,适用于分析强亲水性和强极性化合物,可解决样品中多种强极性组分分离难的问题[17-18]。目前,亲水交互作用色谱法在农产品抗病毒药物检测方面的应用较多,而对运动营养品中抗病毒药物检测方面的研究较少。研究拟通过固相萃取净化技术,结合亲水色谱分离技术对强极性较难分离的9种抗病毒药物组分进行提取,通过亲水交互作用色谱—串联质谱法(HILIC-MS/MS)检测动物源运动营养品中9种抗病毒药物组分的残留,以期为动物源运动营养品中抗病毒药物残留的分析和监控提供依据。
1 材料与方法
1.1 材料与仪器
高效液相色谱—串联质谱仪:Xevo TQ-S型,ZIC-HILIC色谱柱(4.6 mm×150 mm,3.5 μm),美国Waters公司;
InertSustain Amide色谱柱(3.0 mm×150 mm,3.5 μm)、TSKgel Amide-80色谱柱(3.0 mm×150 mm,2 μm):日本岛津有限公司;
Obelisc R色谱柱:4.6 mm×150 mm,5 μm,美国Sielc科技公司;
奈韦拉平(98.5%)、泛昔洛韦(99.2%)、阿比多(99.0%)、阿昔洛韦(99.0%)、咪喹莫德(99.5%)、美金刚(99.0%)、金刚烷胺(98.5%)、奥司他韦(99.2%)、吗啉胍(98.5%)标准品:上海安谱实验科学科技有限公司;
乙酸铵:分析纯,国药集团化学试剂有限公司;
甲醇:色谱纯,德国Merck公司;
MCX、MAX以及PRiME HLB固相萃取小柱:100 mg/3 mL,美国Waters公司;
动物源运动营养品(鸡胸肉源蛋白棒、牛肉源蛋白棒、乳清蛋白棒、鸡胸肉运动代餐粉、牛肉运动代餐粉、蛋白运动能量棒):市售。
1.2 试验方法
1.2.1 色谱条件优化 参照文献[19-20],选择4种色谱柱ZIC HILIC色谱柱(键合相为硅胶)、InertSustain Amide色谱柱(键合相为酰胺基)、TSKgel Amide-80色谱柱(键合相为酰胺基)以及Sielc Obelisc R色谱柱(键合相为含电荷的极性和非极性混合基团),比较9种抗病毒药物组分的分离效果。
1.2.2 质谱条件 采用正离子电离模式扫描;监测模式为多反应监测模式;离子源温度 200 ℃;脱溶剂气流量20 L/min;锥孔气流量2.0 L/min。
1.2.3 仪器条件 Obelisc R色谱柱,流速0.2 mL/min,柱温30 ℃,进样量2.0 μL;流动相A为10 mmol/L乙酸铵溶液(含0.1%甲酸),流动相B为乙腈,按表1进行梯度洗脱。
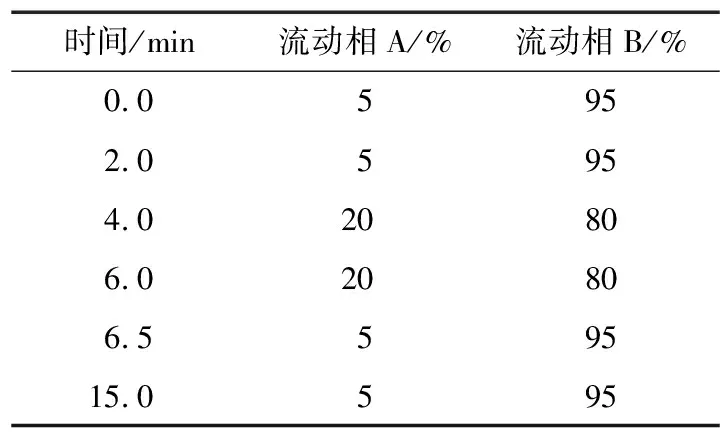
表1 流动相梯度洗脱步骤
1.2.4 样品前处理 称取混合均匀的样品(固体样品预先粉碎)2.0 g,加入20 mL提取液(分别比较乙酸铵缓冲溶液、三氯乙酸溶液,偏磷酸—甲醇溶液,乙酸—乙腈溶液4种提取液),涡旋30 s,使样品与提取液混合均匀,超声10 min,5 000 r/min离心5 min,过滤,取5.0 mL滤液上样,选择3种固相小柱(MCX、MAX以及PRiME HLB),固相萃取过程按照固相小柱操作步骤分别经活化、上样、淋洗、洗脱后收集滤液,过0.22 μm滤膜后上机检测。
1.2.5 标准曲线绘制 称取适量的9种抗病毒药物组分标准品,用甲醇超声溶解并配制成1 000.0 ng/mL的储备液,检测前以流动相配制成0.1~50.0 ng/mL质量浓度范围的标准混合溶液,经仪器进行分析,绘制标准曲线。
1.2.6 提取溶液的选择 参照文献[21-22],提取含50 μg/kg 阳性样品的目标组分,比较提取溶液Ⅰ:20 g/L乙酸铵溶液,提取溶液Ⅱ:1%乙酸溶液,提取溶液Ⅲ:1%乙酸—甲醇溶液(V乙酸∶V甲醇为9∶1),提取溶液Ⅳ:1%乙酸—乙腈溶液(V乙酸∶V乙腈为9∶1)对9种组分提取的影响。
1.2.7 固相萃取柱的选择 采用固相萃取法进行净化提取液,比较HLB、MCX、MAX 3种小柱对提取液的净化效果,以各组分加标回收的峰面积为比较依据。
2 结果与讨论
2.1 色谱条件优化
由图1可知,ZIC HILIC柱分离9种抗病毒药物组分效果不理想,目标组分出峰重叠,分离度较差;而TSKgel Amide-80柱在乙腈—1%甲酸为流动相梯度洗脱模式下,可以实现部分抗病毒药物组分的分离;在InertSustain Amide色谱柱上9种组分的保留效果较差,在前2 min内有6种待测组分基本分离出峰,而阿比多、阿昔洛韦、吗啉胍由于极性较大,在此色谱柱上未保留,整体分离效果也较差;而Sielc Obelisc R色谱柱由于含极性基团和非极性混合基团,所以对9种组分的分离效果较好,出峰时间适宜,各组分也有较好的分离度,故选用Sielc Obelisc R色谱柱。
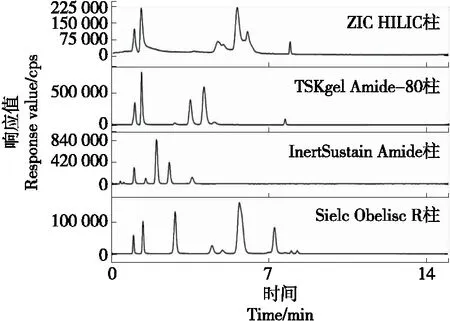
图1 4种色谱柱的分离效果比较
2.2 质谱参数选择
9种抗病毒药物组分结构中均含有胺基基团,在离子化过程中易与H离子结合后带有正电荷,所以采用正离子扫描模式对9种组分的混标溶液进行母离子和子离子的质谱扫描,并优化质谱参数,具体质谱分析参数见表2。
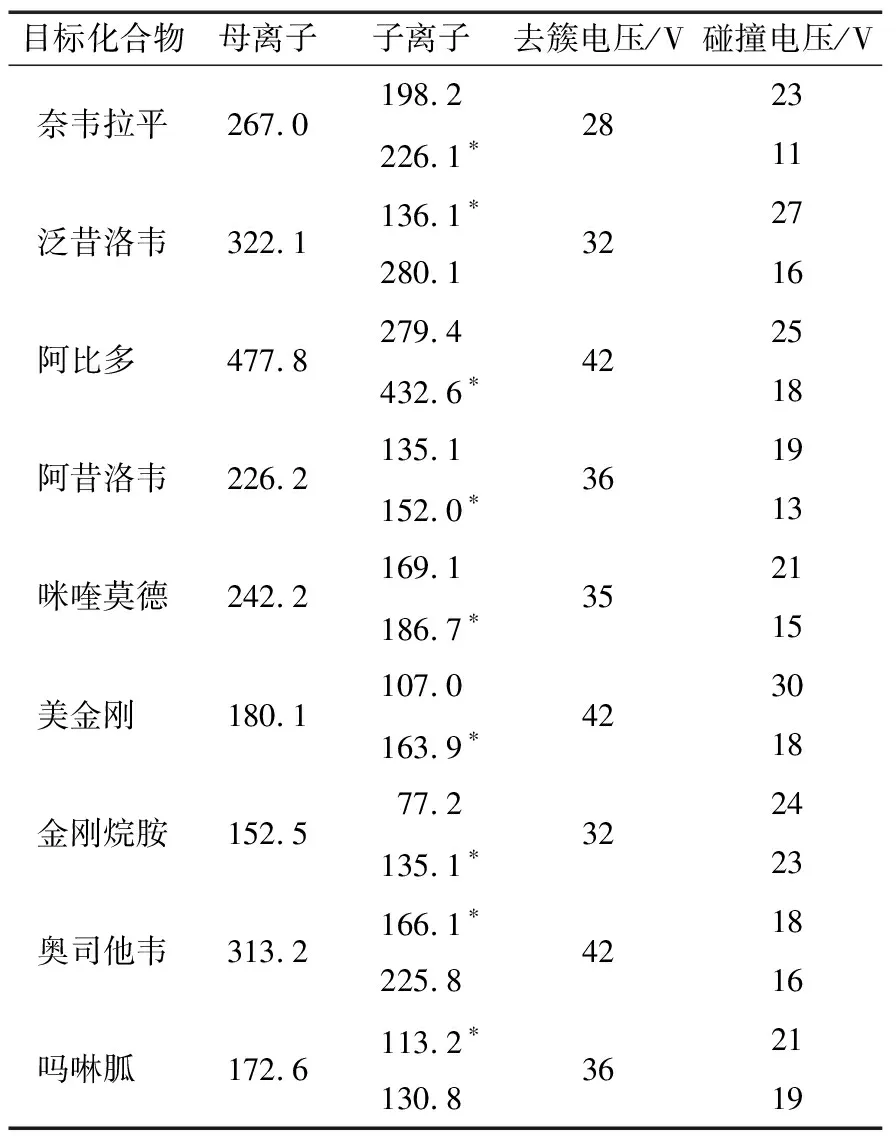
表2 9种组分的质谱参数†
2.3 流动相条件优化
甲醇—水、乙腈—水、乙腈—10 mmol/L乙酸铵溶液、乙腈—10 mmol/L乙酸铵溶液(含0.05%甲酸)、乙腈—10 mmol/L乙酸铵溶液(含0.1%甲酸)和乙腈—10 mmol/L乙酸铵溶液(含0.2%甲酸)等流动相在Sielc Obelisc R亲水色谱柱上的总离子流图见图2。由图2可知,流动相中含有一定比例的乙酸铵会维持流动相pH值的稳定性,能改善峰形,减少拖尾,洗脱效果最好;流动相中无甲酸存在的情况下,9种抗病毒药物组分的电离效果不理想,出现峰型不对称性等现象,将流动相中水更换为甲酸溶液后,流动相体系为酸性,待测组分电离更充分,分离情况得到改善。当流动相中含0.1%甲酸时,各组分的响应值最高,因此选择以乙腈—10 mmol/L乙酸铵溶液(含0.1%甲酸)为流动相,并以梯度洗脱模式,保证各组分有良好的峰形、分离度及较强的响应值。
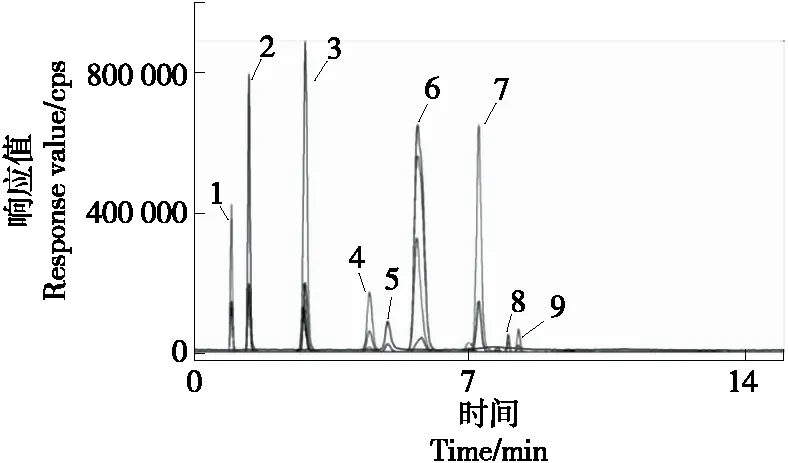
1.奈韦拉平 2.泛昔洛韦 3.阿比多 4.阿昔洛韦 5.咪喹莫德 6.美金刚 7.金刚烷胺 8.奥司他韦 9.吗啉胍
2.4 提取溶液的选择
由图3可知,1%乙酸—乙腈的提取效果整体优于其他3种提取溶液,能够有效提取9种组分,且不同提取溶液间提取效果差异显著(P<0.05)。这是因为在提取液偏酸且存在有机溶剂的溶液体系中,目标组分在提取液中的分配系数较高,样品中的干扰物易除去,实现较好的提取效果。结合流动相中含有乙腈组分,为了减少溶剂间的转化,因此选择1%乙酸—乙腈溶液作为样品的提取液。
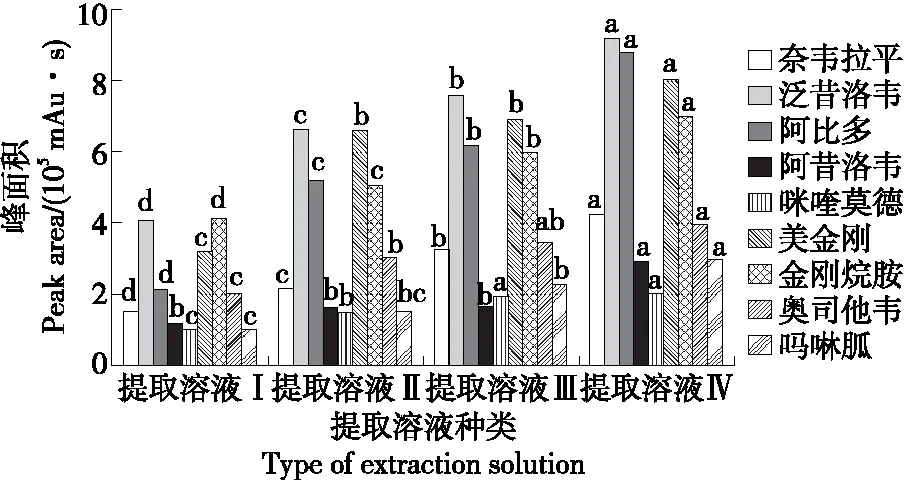
字母不同表示差异显著(P<0.05)
2.5 固相萃取柱的选择
由图4可知,HLB固相小柱的净化效果最好,各组分的峰面积最高,与其他两款固相小柱的效果差异显著(P<0.05)。这是因为HLB固相小柱适用范围广,特异性不强,适合大多数化合物,而MCX和MAX固相小柱特异性强,对部分抗病毒药物组分的保留性较差,因此选用HLB小柱进行净化提取液较合适。试验采用了新一代的PRiME HLB固相萃取柱,较传统HLB固相小柱,免去活化和洗脱步骤,缩短了试验时间,提高了效率,故选择PRiME HLB固相小柱。
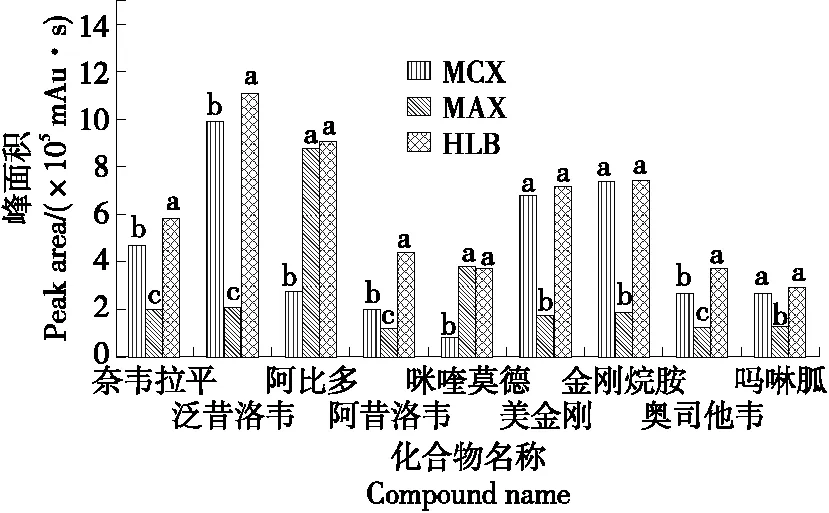
字母不同表示差异显著(P<0.05)
2.6 方法的线性范围与灵敏度
将9种抗病毒药物组分的标准混合溶液以乙腈—10 mmol/L 乙酸铵溶液(含0.1%甲酸)为流动相进行梯度洗脱,绘制标准曲线,结果见表3,9种组分在0.1~50.0 μg/mL 质量浓度范围内线性关系良好,检出限为0.1~0.5 μg/kg,定量限为0.3~1.5 μg/kg,方法灵敏度高。
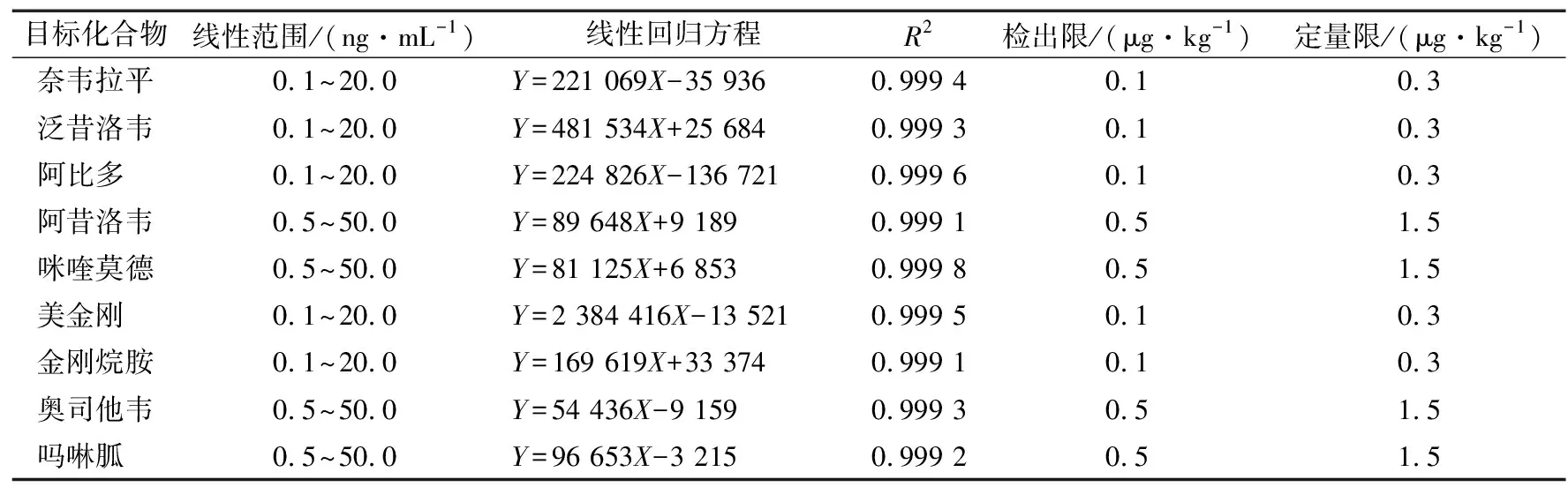
表3 9种组分的线性关系及相关系数
2.7 方法回收率与精密度
分别添加低、中、高3个水平的9种抗病毒药物标准品于样品中进行加标回收试验,结果见表4。
由表4可知,9种抗病毒药物组分的加标回收率为82.3%~95.7%,RSD为3.2%~5.9%,说明试验检测数据的准确度和精密度可靠。
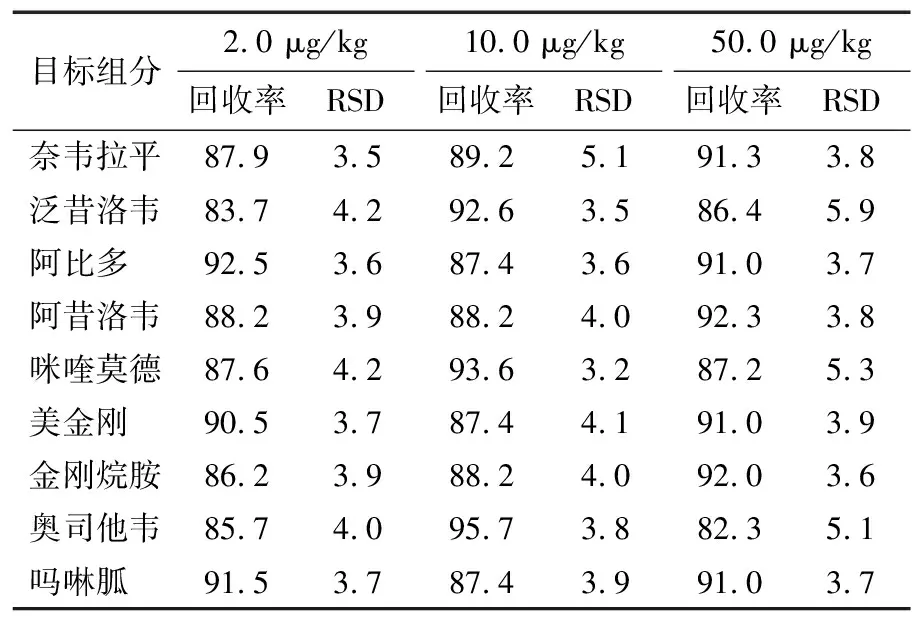
表4 回收率及相对标准偏差
2.8 实际样品分析
对10份不同品牌动物源运动营养品中9种抗病毒药物组分残留进行分析发现,9种目标物组分含量均未检出,结果良好,符合国家标准要求。为验证方法的适用性和可靠性,对阴性样品进行加标处理后(2.0,10.0,50.0 μg/kg),分别用标准方法(SN/T 4253—2015)和试验方法进行比较,结果见表5。由表5可知,试验方法所测定的结果与标准方法均在合理的误差范围内,表明试验方法适用于动物源运动营养品中9种抗病毒药物组分残留的测定。
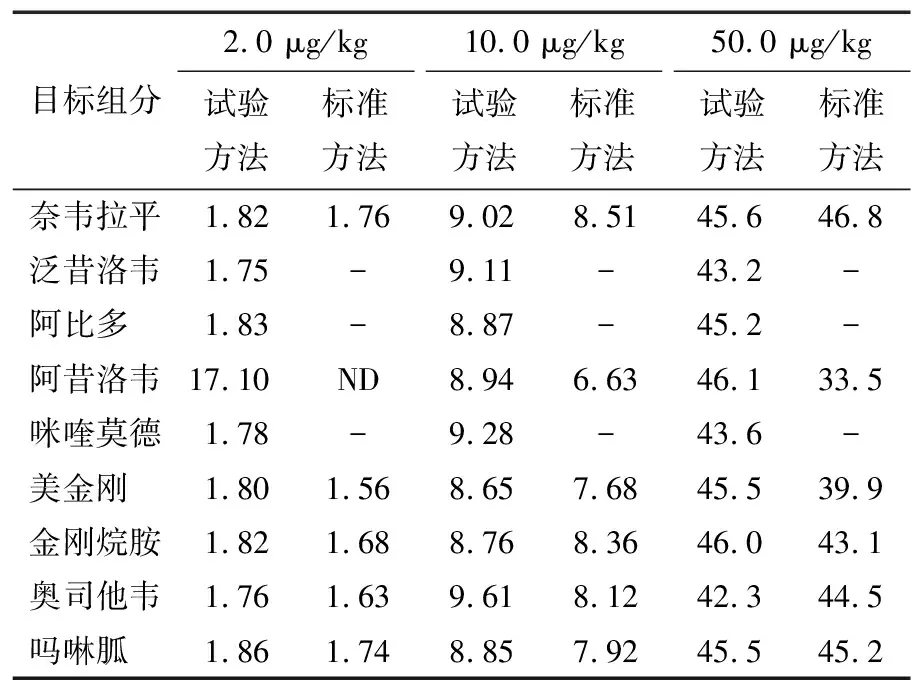
表5 方法的适用性†
3 结论
建立了一种亲水作用色谱—串联质谱法检测动物源运动营养品中9种抗病毒残留的分析方法。结果表明,样品经1%乙酸—乙腈溶液提取后,选择PRiME HLB固相小柱净化处理,可实现对动物源运动营养品中9种目标物组分的有效检测,且与目前的标准方法相比,在保证准确性好、灵敏度高的同时,尽可能省去了复杂的前处理,降低了检测成本,提高了检测目标种类和效率。

