不同肿瘤细胞减灭术式对晚期上皮性卵巢癌患者疗效、免疫功能、生存质量及预后的影响
余玉珍,吴坤英,皱芳
( 1.项城市中医院 妇产科,河南 项城 466200;2.郑州市妇幼保健院 妇科,河南 郑州 450000 )
卵巢癌为常见的妇科恶性肿瘤,其中上皮性卵巢癌(EOC)是卵巢癌中最常见类型,多发于中老年妇女,发病率约占卵巢癌患者70%,具有较高的致死率[1-2]。现阶段初始瘤细胞减灭术(PDS)是临床治疗EOC常用手段,虽能控制病情进展,但对于较大体积肿瘤或晚期发生大面积转移患者而言减瘤效果并不理想[3]。间歇性肿瘤细胞减灭术(IDS)是实施PDS后肿瘤减灭效果不佳患者的辅助性治疗手段,袁航等[4]研究指出,IDS能进一步切除原发病灶和转移病灶,提高肿瘤细胞减灭效果。为进一步探究PDS、IDS两种术式在晚期EOC治疗中的应用效果,本研究对EOC患者进行分组对照研究,现报道如下。
1 资料与方法
1.1 一般资料
以随机数字表法将2019年5月值2021年4月项城市中医院晚期EOC患者98例分为PDS组(n=49)和IDS组(n=49)。IDS组年龄36~64岁,平均(50.73±6.55)岁,体重指数18.9~25.7 kg/m2,平均(22.41±1.52)kg/m2;PDS组年龄37~66岁,平均(51.26±6.72)岁,体重指数19.4~26.5 kg/m2,平均(22.63±1.49)kg/m2,两组年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
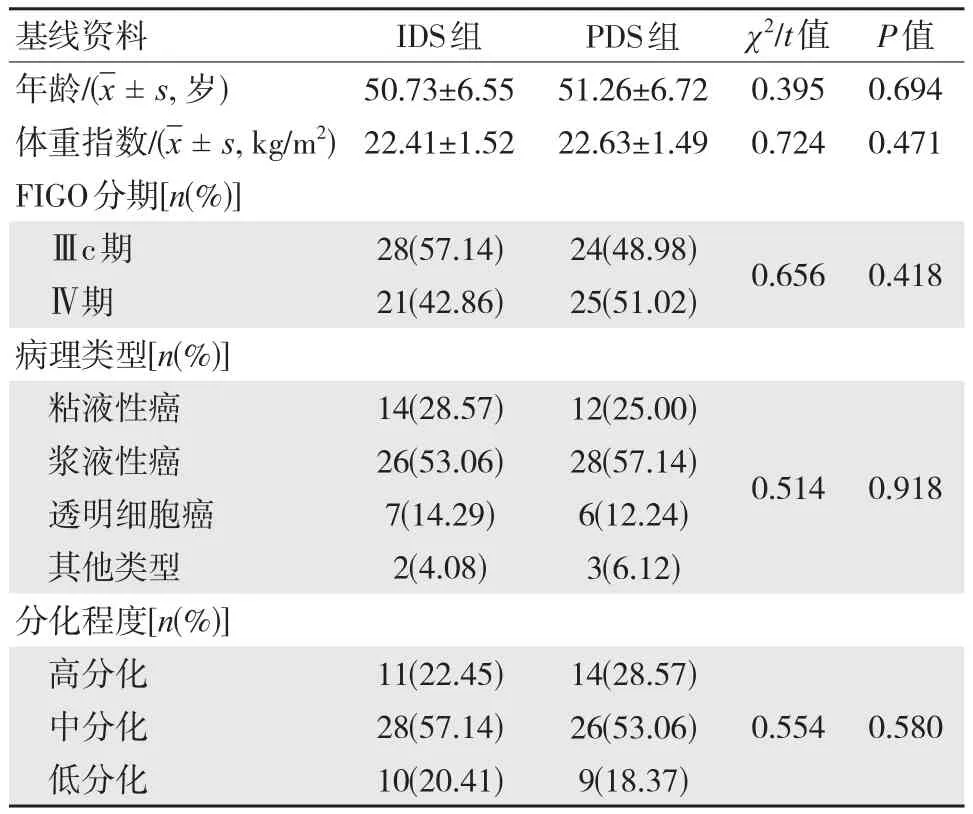
表1 两组一般资料比较 (n=49)
1.2 选例标准
1.2.1 纳入标准 ①符合《卵巢恶性肿瘤诊断与治疗指南》[5]中EOC诊断标准,且经病理检测、彩超确诊;②生存期预计超过8个月;③生命体征稳定且耐受化疗及手术;④患者签署知情同意书。
1.2.2 排除标准 ①有化疗及手术禁忌症者;②其他恶性肿瘤确诊者;③腹部手术史患者;④脏器功能严重障碍者;⑤认知功能异常者;⑥腹腔组织严重粘连者;⑦凝血功能、免疫功能异常者。
1.3 方法
术前两组均完成影像、血常规、脏器功能等相关检测。PDS组实施PDS治疗。具体操作:患者平卧,予以全身麻醉,铺无菌巾;根据探查情况切除肿瘤及肿瘤累及脏器,术后化疗6个疗程。化疗方案为奥沙利铂+表柔比星+异环磷酰胺。IDS组:于PDS术后3个月实施进行IDS手术,IDS手术范围按照PDS进行,最大程度切除原发和转移病灶,后再进行6个疗程化疗,化疗方式同PDS组。每3周为1个疗程。
1.4 疗效评估标准
完全缓解:可见病灶消失且维持时间超过4周;部分缓解:残余肿瘤病灶体积减小超过50%,且无新增病灶,维持时间超过4周;稳定:残余病灶体积增加<25%或减小低于50%,无新病灶出现,时间维持4周以上;进展:残余病灶最大径与最大垂直径乘积超过25%,有新病灶出现。完全缓解例数、部分缓解例数计入总有效率[6]。
1.5 观察指标
①治疗效果。②肿瘤标志物水平,采集两组治疗前后静脉血3 mL,室温凝固,离心取上层血清,冷藏待测。以化学发光法检测血清癌胚抗原(CEA)、人附睾蛋白(HE4)水平,试剂盒由赛默飞公司提供。③细胞免疫功能,以流式细胞仪(希森美康公司,型号:CyFlow Counter)检测治疗前后两组血清T淋巴细胞CD8+、CD4+、CD3+水平,试剂、试剂盒购自上海江莱生物公司。④生活质量,采用卡氏评分(KPS)进行评估,包含功能状况、病情改善情况、生活自理能力等方面,评分范围:0~100分。生存质量稳定:KPS评分变化幅度小于10分;生存质量下降:KPS评分降低超过10分;生存质量上升:KPS评分升高超过10分。⑤随访12个月比较两组生存率、复发率情况。
1.6 统计学处理
采用SPSS 22.0统计分析软件处理数据。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以百分率(%)表示,比较用χ2检验,等级资料以Ridit检验;均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗效果比较
IDS组总有效率(87.76%)高于 PDS组(65.31%),差异有统计学意义(χ2=6.874,P=0.009),见表 2。
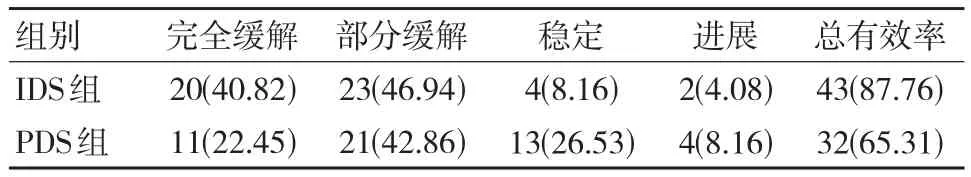
表2 两组治疗总有效率比较 [n=49, n(%)]
2.2 两组肿瘤标志物水平比较
治疗前两组血清CEA、HE4水平比较,差异无统计学意义(P>0.05);治疗后两组血清CEA、HE4水平较治疗前下降,且IDS组低于PDS组,差异有统计学意义(P<0.05)。见表3。
表3 两组肿瘤标志物水平比较 (n=49,±s)
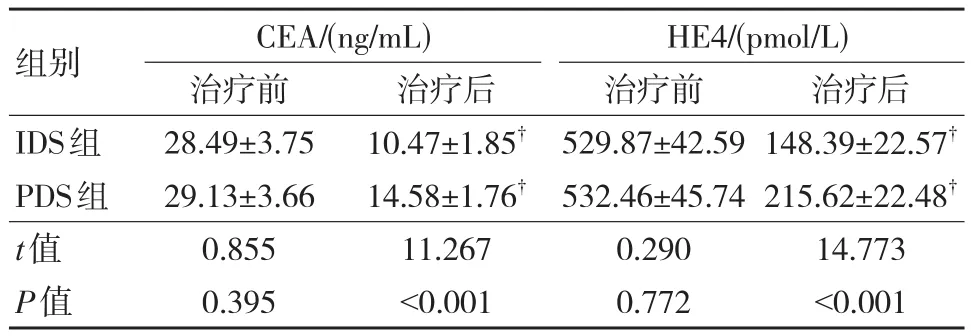
表3 两组肿瘤标志物水平比较 (n=49,±s)
注:†与治疗前对比,P<0.05。
组别IDS组PDS组t值P值CEA/(ng/mL)治疗前28.49±3.75 29.13±3.66 0.855 0.395治疗后10.47±1.85†14.58±1.76†11.267<0.001 HE4/(pmol/L)治疗前529.87±42.59 532.46±45.74 0.290 0.772治疗后148.39±22.57†215.62±22.48†14.773<0.001
2.3 两组细胞免疫功能比较
治疗前两组 CD3+、CD4+、CD8+、CD4+/CD8+对比,差异无统计学意义(P>0.05);治疗后两组CD3+、CD4+、CD4+/CD8+较治疗前降低,CD8+较治疗前升高,但 IDS 组 CD3+、CD4+、CD4+/CD8+高于PDS组,CD8+低于PDS组,差异有统计学意义(P<0.05)。见表4。
表4 两组细胞免疫功能比较 (n=49,±s)
注:†与治疗前对比,P<0.05。
组别IDS组PDS组t值P值CD3+/%治疗前50.39±4.72 51.28±4.49 0.967 0.339治疗后47.54±3.72†44.58±3.44†4.089<0.001 CD4+/%治疗前40.57±3.25 41.16±3.31 0.890 0.373治疗后37.52±2.95†35.71±2.68†3.179 0.002 CD8+/%治疗前27.58±1.21 27.26±1.15 1.282 0.203治疗后28.85±1.35†29.62±1.38†2.792 0.005 CD4+/CD8+治疗前1.47±0.12 1.50±0.15 1.093 0.277治疗后1.30±0.08†1.21±0.09†5.232<0.001
2.4 两组生存质量比较
治疗后IDS组生存质量优于PDS组,差异有统计学意义(μ=2.067,P=0.039)。见表5。

表5 两组生存质量比较 [n=49, n(%)]
2.5 两组生存率及复发率比较
IDS组生存率(85.42%)、复发率(6.25%)与PDS组(82.98%、8.51%)比较,差异无统计学意义(P>0.05)。见表6。
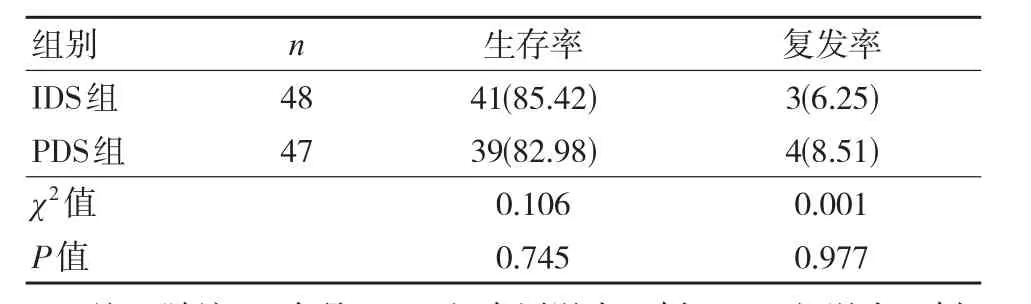
表6 两组生存率、复发率比较 [n(%)]
3 讨论
手术是晚期EOC主要治疗方式,临床主要通过肿瘤细胞减灭术切除病灶,减轻肿瘤负荷,以期改善预后[7]。由于晚期EOC肿瘤体积较大,一次性切除难度大,手术时间长,风险较高,同时对医生的技术水平有较高要求[8]。有研究指出,对于单独施行PDS手术不能有效切除肿瘤的患者,临床上会给予IDS手术以补救首次手术的不足从而获取满意的肿瘤减灭率,改善患者预后[9]。
EA为评估卵巢癌重要的抗原类肿瘤标志物,在EOC病情的评估中扮演重要角色[10]。HE4是新发现卵巢癌标志物,由恶性病变的上皮细胞分泌[11]。本研究显示IDS组总有效率高于PDS组,治疗后IDS组血清CEA、HE4水平低于PDS组,提示IDS+PDS+化疗能增强临床疗效,减轻肿瘤标志物表达。究其原因可能在于IDS能增强肿瘤切除效果,减缓肿瘤细胞转移;且对PDS手术未能切除的肿瘤进行二次切除,也使得肿瘤的减灭率得以提高,进而使肿瘤标志物水平降低。此外,张圆圆等[12]研究中观察组PDS+3疗程化疗+IDS+化疗取得显著疗效,而本研究IDS术前未进行化疗干预仍能取得满意疗效,主要考虑与患者PDS术后恢复效果及对手术耐受度较高有关。但本研究仍存在一定局限性,未能明确术前化疗对手术的影响,有待做进一步研究。
T淋巴细胞具有细胞免疫活性,是机体细胞免疫主要成分,在机体防御、免疫监视、免疫自稳具有重要作用,相关研究显示,机体免疫功能不仅与肿瘤患者术后恢复相关,且在一定程度上可反映癌症患者耐受程度[13]。T淋巴细胞CD3+、CD4+、CD8+在机体细胞免疫调解中具有重要作用,CD4+/CD8+则是反映机体T淋巴细胞亚水平变化情况,能提示机体调节能力[13-14]。当机体免疫功能遭受损伤,可引起T淋巴细胞水平发生变化,导致机体免疫机制紊乱,影响疾病治疗。本研究显示,治疗后IDS组T淋巴细胞水平、生活质量优于PDS组,说明IDS组治疗方式能降低创伤程度,减轻免疫功能损伤,预后生活质量较好。分析其作用机制可能是IDS给予化疗使肿瘤细胞进入“休眠”状态,为手术实施提供了良好的手术基础,有助于降低术中组织牵拉、挤压、血液流动导致的肿瘤细胞转移风险,免疫功能损伤较轻,且能增强肿瘤减灭率效果,降低肿瘤标志物水平,减轻肿瘤细胞对免疫功能抑制。本研究还显示,随访12个月两组的生存率、复发率比较,差异无统计学意义,考虑原因一方面可能是参与研究患者均是晚期患者,身体状态差,病情较为严重,机体耐受性低,另一方面可能与随访时间短,样本较少有关。
综上所述,两种肿瘤细胞减灭术均能达到一定的肿瘤减灭效果,但IDS治疗晚期EOC效果更佳,能抑制肿瘤标志物表达,改善免疫功能,有助于改善生活质量。而生存率和复发率有待进一步研究以获得更为科学准确的结论。

