红曲霉次级代谢产物及其在乳制品中的应用研究进展
伍忠玲,刘振民*
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
红曲,又名红曲米,是由大米为原料,经过红曲霉发酵而成的米曲。汉代王粲在《七释》中写道“西旅游梁,御宿素餐,瓜州红曲参糅相拌软滑膏润入口流散”,表明红曲在我国已经有上千年的历史[1-3]。红曲霉是一类丝状腐生真菌,在适当的条件下,红曲霉能够生成淀粉酶、酯化酶和糖化酶等初级代谢产物,也能生产红曲色素(Monascuspigments,MPs)、Monacolin K和γ-氨基丁酸(γ-aminobutyric acid,GABA)等有益的次级代谢产物[4-5]。随着研究的不断深入,发现红曲霉次级代谢产物具有食品发酵着色、降血压、降血脂、抗细菌真菌及抗癌在内的多种重要功能。目前已有研究显示红曲霉能够用于乳制品新产品的研发,包括红曲辅助发酵干酪、红曲着色的牛乳及红曲辅助发酵酸乳等相关产品,具有良好的风味及功能,但是红曲霉发酵过程会产生具有肾脏毒性的橘霉素,严重限制红曲霉在乳制品中的应用[5-8]。本文对红曲霉次级代谢产物的研究进展及其在乳制品中的应用进行总结,可为红曲霉在乳制品中的安全开发提供科学依据。
1 红曲霉次级代谢产物
1.1 MPs
MPs是由红曲霉发酵而成的优质天然食用色素,作为活性功能成分广泛应用于食品、化妆品和医药等行业[9]。MPs由橙色素、黄色素和红色素构成[10],其中橙色素包括红斑红曲胺和梦那玉红等化合物;黄色素包括红曲素和安卡红曲黄素等化合物;红色素包括红斑胺素、红曲红胺、N-戊二酰基红斑胺、N-戊二酰基红曲红胺、N-葡萄糖基红斑胺和N-葡萄糖基红曲红胺等化合物[11]。
1.1.1 合成途径
MPs的合成首先由1 分子乙酰辅酶A与3 分子丙二酰辅酶A在Ⅰ型聚酮合成酶(polyketone synthetase,PKS)催化作用下形成四酮体(丁烯酮),随后通过聚酮化合物合成反应形成己酮发色团,己酮发色团与脂肪酸合成途径产生的中长链脂肪酸形成橙色素,橙色素分别通过还原反应,以及与氨基酸进行氨化反应形成黄色素和红色素[8](图1)。
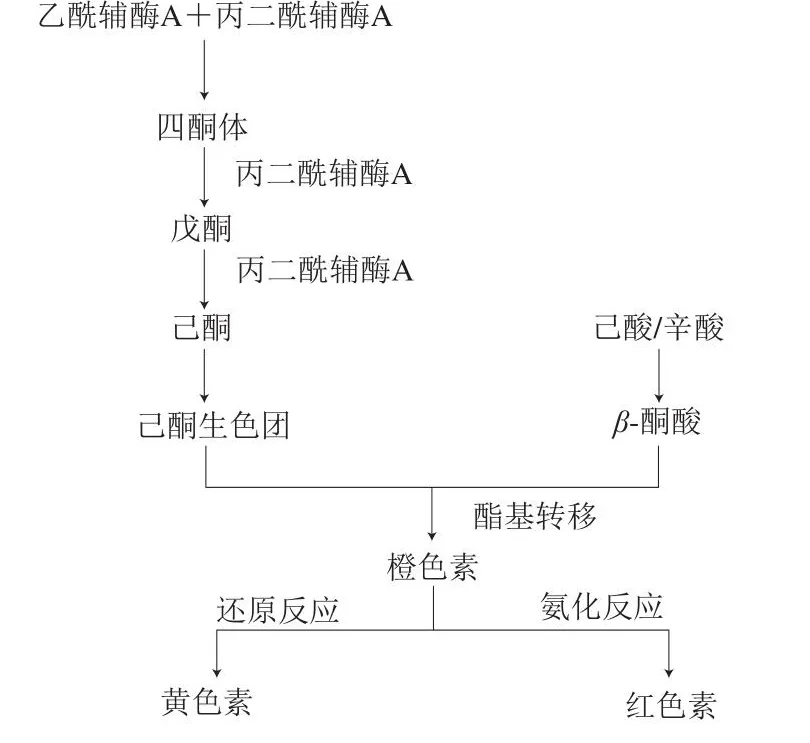
图1 MPs的合成途径Fig.1 Biosynthetic pathway of MPs
1.1.2 生物活性
目前研究发现MPs具有抗炎、抗细菌和抗肿瘤等生物活性。自然分离到的紫色红曲霉(Monascus purpureus)BCRC 38110菌株所产生的次级代谢产物具有抗炎活性[12]。MPs能够抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及环氧合酶-2的表达,抑制一氧化氮和前列腺素E2的形成,从而介导卵清蛋白诱导的人THP-1单核细胞炎症中的抑制作用[13]。M.purpureusNTU 568菌株所产生的黄色素和橙色素可以抑制iNOS蛋白水平,抑制肿瘤坏死因子、白细胞介素-1β和白细胞介素6的合成,从而抑制脂多糖诱导的鼠源巨噬细胞RAW 264.7炎症[14]。
由MPs产生的一些氨基酸衍生物具有抗细菌活性,研究发现,相比于对照组红曲素的最小抑菌质量浓度(minimum inhibitory concentration,MIC)32 μg/mL,由MPs产生的L(D)-苯丙氨酸及L(D)-酪氨酸衍生物抑制革兰性阴性菌和阳性菌的MIC为4~8 μg/mL。此外,MPs氨基酸衍生物也能够拮抗包括曲霉、青霉在内的真菌[11]。
大多数慢性疾病的发生与自由基的存在相关,例如癌症、糖尿病和心血管疾病等[15]。由红色红曲霉(Monascus ruber)CGMCC 10910菌株产生的黄色素具有较高的氧自由基清除能力,并且能够抑制人乳腺癌细胞系(michigan cancer foundation-7,MCF-7)的生长和迁移,抑制基质金属蛋白酶和血管内皮生长因子的表达,具有抗肿瘤活性[16]。此外,MPs及其衍生物可以通过有效抑制丙型肝炎病毒NS5B RNA聚合酶活性来抑制丙型肝炎病毒复制[17]。
1.2 Monacolin K
Monacolin K(又称Lovastati)是1979年日本学者远藤章教授从M.ruber发酵产物中分离出的一种可以降低胆固醇合成的生物活性物质。Monacolin K通过抑制3-羟-3-甲戊二酸单酰辅酶A还原酶的活性来抑制胆固醇的合成,从而具有降血脂的功能[18],因此,Monacolin K被逐渐应用于医药行业。
1.2.1 合成途径
Monacolin K的合成首先通过洛伐他汀十酮体合成酶(lovastatin nonaketide synthase,LNKS)和烯酰还原酶共同催化1 分子丙二酰辅酶A和9 分子乙酰辅酶A合成1 种九酮化合物二氢Monacolin L,并经过催化反应和氧化反应生成Monacolin J。此外,洛伐他汀二酮合成酶(Lovastatin dione synthetase,LDKS)催化1 分子丙二酰辅酶A和2 分子乙酰辅酶形成甲基丁酰辅酶A,与Monacolin J通过酯基转移形成Monacolin K(图2)[19]。
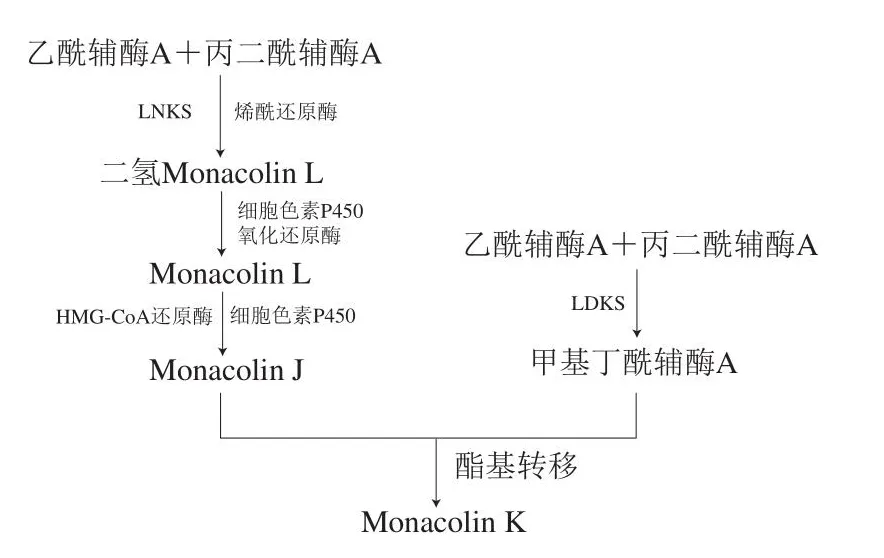
图2 Monacolin K的合成途径Fig.2 Biosynthetic pathway of monacolin K
1.2.2 生物活性
Monacolin K除了降血脂功能外,还具有抗炎、抗癌及神经保护的生物活性功能[18]。研究发现Monacolin K能够通过抑制甲羟戊酸合成相关基因的表达来抑制胆固醇合成,能够有效抑制小鼠肝癌肿瘤的生长[15,17]。Monacolin K可以减少HCT-116和HT-29人源结肠癌细胞的增殖,并诱导癌细胞的凋亡[20]。Monacolin K的衍生物对神经生长因子分化的PC12细胞具有保护作用[21]。在M.purpureusNTU 568菌株中产生的Monacolin K可以通过抑制小G蛋白介导的炎症来抑制Aβ1-40神经毒性[22]。此外,Monacolin K具有抗病原细菌和真菌的生物活性,研究发现,Monacolin K能够通过抑制病原真菌麦角甾醇合成基因ERG11和ERG3的转录水平来抑制其生长,从而起到抗病原真菌的效果[21]。
1.3 GABA
GABA是一种广泛存在于生物体中的非蛋白质氨基酸,具有降血压、抗氧化、抗肿瘤和抗焦虑等生物活性,许多微生物可以产生GABA,包括细菌和真菌[23]。
1.3.1 合成途径
生物体中GABA的合成主要通过谷氨酸脱羧途径进行,由谷氨酸在谷氨酸脱羧酶的作用下生成GABA[24]。
1.3.2 生物活性
目前关于GABA在神经保护、降血压、降血糖、抗癌等领域的作用逐渐被揭示,研究发现,GABA对神经毒性诱导的细胞凋亡具有保护作用,也可以保护神经内分泌PC-12细胞免受MnCl2诱导的损伤,提高细胞活力,减少乳酸脱氢酶的释放,GABA也可以抑制血管紧张素Ⅰ转化酶的活性,起到降血压的作用[25-28]。此外,GABA可以通过有效刺激胰岛素的释放,防止胰腺损伤,通过抑制靶基因的表达与活性以及影响DNA复制过程来抑制癌细胞的生长[29-32]。
1.4 橘霉素
橘霉素是红曲霉发酵过程中可产生的对人体具有肾毒性、胃毒性及诱导癌症发生的有害次级代谢产物[33]。
1.4.1 合成途径
橘霉素合成首先通过1 分子乙酰辅酶A与3 分子丙二酰辅酶A在PKS催化作用下形成四酮体,其次,四酮体与丙二酰辅酶A缩合,最后通过甲基化、缩合、还原、甲氧基化、还原、氧化和脱水等步骤生成橘霉素[34](图3)。

图3 橘霉素合成途径Fig.3 Biosynthetic pathway of citrinin
1.4.2 生物活性
橘霉素除了会对肾脏造成毒性作用,也会影响肝脏功能。研究发现,橘霉素会影响小鼠活性氧(reactive oxygen species,ROS)的产生,并且增加Ca2+的积累,导致内质网压力介导的细胞凋亡信号蛋白水平上调,从而导致肝细胞凋亡,造成肝毒性[35-36]。此外,橘霉素可以通过氧化应激反应影响小鼠卵母细胞成熟[31]。
2 红曲霉次级代谢产物合成的调控
红曲霉因其有益次级代谢产物的生物活性而具有很好的应用价值,然而因橘霉素的存在而受到阻碍,因此,找到高产有益代谢产物、低产甚至不产橘霉素的调控策略至关重要[37]。目前研究表明,调控红曲霉次级代谢产物的合成可以通过自然分离的菌株选育、改变温度和光照等环境因子以及基因突变等策略来实现[9]。
2.1 菌株
自然分离的不同红曲霉菌株产次级代谢产物的能力有所区别,目前筛选高产有益次级代谢产物,并且低产橘霉素的红曲霉菌株是研究热点之一[37]。Feng Yanli等[38]从红曲米中分离到1 株丛毛红曲霉(Monascus pilosus)MS-1,在发酵14 d后,该菌株在液态发酵基质中能产无橘霉素污染的Monacolin K,产量达0.58 mg/mL,在固态发酵基质中能产Monacolin K达16.45 mg/g,并且该菌株无橘霉素合成相关基因CTNA、PKSCT、CTNE和CTNR。庄月娥等[39]以福建省古田县不同品牌的红曲米为原料,筛选到1 株高产Monacolin K、低产橘霉素的菌株红曲霉M8,在发酵10 d后,该菌株产橘霉素的含量为1.40 μg/g,Monacolin K含量为3 950 μg/g。毛继龙等[40]从红曲霉中分离到1 株M.purpureusM4菌株,具有高产洛伐他汀的能力。
2.2 培养基组成
培养基中碳源和氮源的成分影响红曲霉生长发育及次级代谢产物的产生。相比于马铃薯渣水解物,直接利用马铃薯渣培养基发酵7 d后,M.purpureusCH01产生的Monacolin K达到34.5 μg/mL,而在30 ℃条件下产生的Monacolin K仅有2.11 μg/mL,此外,产生的红色素、黄色素及总色素含量分别达27.8、19.7、1 187.5 OD units/mL,分别增产27.9%、19.4%及46.3%,橘霉素的合成量降低22.6%[41]。利用稻草水解物作为深层发酵基质,能够促进MPs的合成,同时也可以降低生产成本。M.purpureusM3103菌株在NH4Cl或NH4NO3处理下,MPs产量增加,橘霉素的产量降低[42]。
2.3 温度
温度影响红曲霉次级代谢产物的合成。先前研究表明,在25 ℃发酵时,红曲霉发酵产生的Monacolin K达34.5 μg/mL,而在30 ℃条件下产生的Monacolin K仅有2.11 μg/mL。相比于30 ℃的发酵条件,在25 ℃条件下,Monacolin K的合成基因MKA、MKD、MKE、MKF、MKG、MKH和MKI的表达量显著上调[43]。红曲霉J101菌株在25 ℃发酵条件下,MPs产量也远高于30 ℃时的MPs产量[44]。此外,温度影响不同色素的合成,在适当的高温处理下,M.ruberCGMCC 10910能产生水溶性的黄色素,当温度达到35 ℃时,黄色素的合成量显著上升,色素合成相关基因表达量显著上调[45]。
2.4 pH值
pH值是影响微生物生长和代谢活性的重要因素之一。pH值低于2.0或高于8.5,真菌的生长及次级代谢产物的合成会受到显著抑制[46]。研究发现,氮源直接影响培养环境最终的pH值,从而调控红曲霉发酵形成的MPs构成及橘霉素的合成,在含有(NH4)2SO4或谷氨酸钠作为氮源的培养条件下,当初始pH 2时,红曲霉产生橙色素的过程中不产生橘霉素[7]。此外,不同的pH值影响不同红曲色素的合成,在pH 2.5或4.0时,安卡红曲霉(Monascus anka)GIM 3.592菌株在胞内主要合成橙色素,胞外主要合成黄色素,当pH 6.0时,红曲霉能够充分利用氮源合成红色素。类似地,在低pH值环境下,M.ruberCCT 3802菌株中主要合成橙色素,高pH值环境下合成红色素[10]。
2.5 光
光是真菌的重要信号,不同的光照处理可以促进或抑制真菌的发育和次级代谢产物的合成。红光和蓝光会影响红曲霉菌丝体的发育、孢子的产生及次级代谢产物的合成[9]。在M.pilosusIFO4520菌株中,红光能够抑制菌丝的生长,蓝光促进菌丝的生长,相比于黑暗条件下,红光与蓝光能同时促进GABA的合成,但是红光能够促进橘霉素的合成,蓝光抑制橘霉素的合成[47]。M.ruberCCT380菌株在红膜覆盖的条件下生长,红色素合成量和生物量的最大值分别达到8.32 UA和8.82 g/L,显著高于正常及黑暗培养条件下红色素的合成量[48]。M.ruberM7菌株在低强度的蓝光(500 lx)下培养,色素合成相关基因MPIGA、MPIGB和MPIGJ的表达量显著上调,MPs合成量显著增加,但不影响橘霉素的合成[9,49]。在M.purpureusM9菌株中,蓝光能够通过调控1 个非编码RNA(AOANCR)负调控MROAX基因,影响橘霉素的合成[50]。
2.6 溶解氧
在微生物发酵过程中,溶解氧影响次级代谢产物的合成。在溶解氧15%~25%条件下,M.purpureusFDSJA-01菌株菌丝生长缓慢,红曲色素的产量随着溶解氧体积分数的升高而上升,在溶解氧35%~45%的条件下,菌株合成的MPs含量最高[9]。M.purpureusATCC 36928在溶解氧60%的条件下,红色素和橘霉素的产量分别上升106%和257%[51]。
2.7 外源化合物
向培养基中添加一些化合物能够影响红曲霉次级代谢产物的合成。例如,在培养基中添加C7H15COONa后,M.ruberCCT 3802菌株MPs合成量上升。在发酵2 d时添加LaCl3,可以使M.purpureus发酵产生的MPs达到124.10 μg/mL,菌株自身生物量达33.10 g/L,此外,胞外和胞内橘霉素的产量分别降低59.93%和38.14%,并且发现LaCl3处理后,MPs合成基因PKSPT、MPPB、MPPD、FASB2及PKS5表达量显著上调,橘霉素合成基因CTNA、KSCT及MPPC表达量显著下调[52]。在发酵过程中添加0.02 mol/L NaCl发酵10 d后,黄色素、橙色素、红色素及Monacolin K产量分别提高1.7、1.4、1.4、1.4 倍,橘霉素产量降低48%,但不影响红曲霉的细胞生长,在此过程中,橘霉素合成基因PKSCT和CTNA的表达水平显著降低,MPs合成基因PKSPT和PIGR表达水平显著上调,此外,NaCl添加后能够促进红曲霉ROS迸发,导致酸性磷酸酶和碱性磷酸酶活性上升[53]。在M.purpureusHJ11菌株中,环腺苷酸磷酸酶信号途径参与色素的合成,外源施加环磷酸腺苷(cyclic adenosine monophosphate,cAMP)能够促进色素的合成,当cAMP磷酸二酯酶编码基因缺失后,cAMP信号途径被激活,色素合成增加[54]。添加大豆异黄酮可以使橘霉素的产量降低96%[51]。外源添加3 μg/mL氟康唑能够促进M.purpureusNMCC-PF01菌株胞内色素的释放,提高MPs的产量[55]。
2.8 菌株诱变技术
常规的诱变技术也被应用于红曲霉菌株的筛选。在12C6+离子束(80 MeV/u,200 Gy)诱导下,筛选到1 株紫色红曲霉突变株BWY-5,发现该菌株中MPIGF、MPIGG和MPIGH基因缺失,CTNE、CTNH和CTNI基因表达量下调,MPIGM基因表达量上调,此外,该菌株能够充分利用氮源产生胞外黄色素,并且在该菌株中并未检测到橘霉素[56]。通过同步辐射光源诱变红曲霉M.purpureusKUPM5菌株,筛选到3 株突变株,分别为SC01、SC02和SC03。相比于野生型,突变株都能高产Monacolin K,其中SC02菌株在高产Monacolin K的同时,产MPs等其他次级代谢产物的能力并未受到影响[57]。桂艳玲等[58]通过紫外诱变,获得红曲霉1YM10和红曲霉3YM29-1菌株,橘霉素的产量分别降低76.09%和81.53%,并且红曲霉1YM10对枯草芽孢杆菌有很强的抑菌活性。
2.9 基因敲除与过表达技术
目前关于调控红曲霉次级代谢产物合成相关基因的功能逐渐被挖掘。有研究表明,MPPIG基因的缺失导致MPs产量降低,但不影响红曲霉生长及橘霉素的合成,MPPIH基因缺失严重影响红曲霉的生长发育,促进MPs的合成,抑制橘霉素的合成[59]。MPIJ基因的缺失导致红曲色素的合成量降低[60]。G蛋白α亚基Mga1-3参与生长和次级代谢产物的调控[61]。在M.purpureus中,组蛋白甲基转移酶编码基因ASH2缺失,导致生长减缓、产孢能力降低及色素合成量降低;此外,发酵15 d后,在该菌株中并未检测到橘霉素的存在,并且大量的次级代谢产物合成相关基因转录水平降低[62]。在M.rubeM7中,组蛋白去乙酰化酶编码基因RPD3过表达会增加组蛋白乙酰化修饰,并导致橘霉素的合成量显著增加;在M.purpureus菌株中,乙酰转移酶编码基因TRIA缺失,红曲色素和橘霉素合成量降低[63-64]。在M.pilosus和M.ruber菌株中存在1 个组蛋白甲基转移酶LaeA,能够全域调控次级代谢产物的合成[65-66]。在M.ruberM7菌株中,转录因子BRLA和WETA缺失严重影响菌丝的生长发育、分生孢子的形状和结构以及次级代谢产物的合成[67]。过表达MOKH导致M.pilosus菌株中Monacolin K合成相关基因表达量上调,从而导致Monacolin K的产量显著增加[68]。
3 红曲霉在乳制品中的应用
红曲霉因其次级代谢产物的生物活性被广泛应用于食品、医药、酿造等行业,随着生活水平的提高,当今社会人们对乳制品的需求日益增加。我国的乳制品主要分为液体乳类、乳粉类、炼乳类、乳脂类、干酪类、乳清类和其他乳制品类7 类[69]。在乳业竞争白热化的阶段,如何提升乳制品的功能以及创造新的乳制品至关重要[70-71]。研究显示,红曲霉可作为辅助发酵剂用于红曲霉乳制品的制作,优化乳制品感官的同时也能产生次级代谢产物等活性物质,可增加乳制品的功能性,表明红曲霉在乳制品中有良好的应用前景,目前红曲霉在乳制品开发中的研究主要集中在干酪、酸乳和牛乳[6,72-73]。
3.1 干酪
干酪在世界各地以各种口味和形式生产。从一开始,干酪只是作为一种保存牛乳成分的手段,现在已经演变成一种高级美食,并且营养丰富[74]。随着研究的深入,发现红曲霉在干酪的生产过程中能够改善干酪的风味及口感,并且能够产生红曲色素及GABA等活性物质,提升干酪的品质。Xia Yongjun等[75]利用烟灰色红曲霉(Monascus fumeus)x08菌株制作红曲干酪,分析发现,相比于对照组,红曲干酪中小分子肽的含量显著增加,疏水性肽与亲水性肽的比率降低。此外,与蓝纹干酪相比,红曲制作的红曲干酪味道强度较低,符合国人的饮食习惯。Zhang Shuwen等[76]利用红曲霉作为卡门贝尔干酪的辅助发酵剂,该红曲干酪中的甘氨酸、蛋氨酸及异亮氨酸等氨基酸的含量显著增加,此外,红曲干酪中辛酸乙酯、柠檬酸乙酯及2-十三烷酮等改善风味的物质含量显著增加。Wu Shenmao等[77]利用M.purpureusBD-M-4菌株制作红曲干酪,发现相比于普通干酪,红曲干酪中总微生物群的数量及可溶性氮的含量显著增加,pH值上调,但脂肪含量无明显变化。Yu Huaning等[78]利用M.purpureus制作半硬质干酪,发现在干酪成熟时,游离氨基酸含量显著改变,无论是在外皮还是干酪内部,αs1-酪蛋白显著降解,β-酪蛋白只在外皮显著降解。谢芳等[79]以水牛乳为原料,利用M.purpureusWent发酵干酪,研究发现,相比于对照组,随着红曲霉菌液喷洒浓度的增加,在干酪理化指标方面,水分、蛋白质、脂肪等物质的含量升高,NaCl含量无明显变化;在干酪的质构参数方面,弹性、硬度及咀嚼性下降,此外,在菌液浓度为107CFU/mL时,Monacolin K的产量达到最高,为1.4 mg/100 g。Jiao Jingkai等[6,80]发现,M.purpureus可以应用于制作红曲中软质干酪,具有风味良好、GABA含量升高及橘霉素含量较低等优点,并且在白霉干酪中添加红曲霉能够促进蛋白和膳食纤维的合成。此外,郑远荣等[81]利用红曲霉No.7630菌株辅助发酵成熟干酪,研究发现,红曲霉干酪的得率达(16.55±0.67)%,相比于切达干酪等干酪的得率提高近50%,此外,相比于对照组,红曲霉干酪成熟时,游离氨基酸含量平均增加58.8 倍,GABA含量增加3.5 倍。
3.2 酸乳
酸乳作为一种具有维持胃肠道健康、促进消化功能的乳制品,受到消费者的青睐,已成为世界上发展速度最快的乳制品之一。国内外一直致力于功能性酸乳的研究,人们向酸乳中添加大豆蜜糖、果肉及藜麦等物质制备功能性酸乳,具有促进改善肠道菌群、提升免疫力等功能[82]。目前也有越来越多的研究显示,红曲霉在酸乳发酵中能够产生有益的活性物质,促进机体健康。Chen Sha等[75]利用红曲色素制作酸乳,用于酸乳的着色剂。Jeon等[83]将红曲山药粉末按0、0.1、0.3、0.5、1.0、2.0 g/100 mL添加到生牛乳和5%脱脂牛乳中,经过乳酸菌发酵12 h后,对酸乳的pH值、可滴定酸度及活细胞数量进行测定,研究发现,随着红曲山药粉末的添加量增加,酸乳的pH值和可滴定酸度轻微上升,活细胞数量在添加量0.5 g/100 mL时达到最大值(1.14±0.07)×1010CFU/mL。此外,添加红曲山药粉末的酸乳对血管紧张素转化酶活性的抑制率升高,GABA的产量增加。Srianta等[84]利用红曲发酵榴莲籽作为酸乳的功能成分添加到酸乳中,发现添加红曲发酵榴莲籽后,酸乳的总酚含量达到(2.21±0.46) mg GAE/g,抗氧化活性达到(0.012 5±0.003 2) mg GAE/g,脱水率达到(5.24±0.51)%,此外,酸乳的pH值及可滴定酸度轻微上升,活细胞数量没有显著差异,从市场调研来看,消费者也更喜欢添加红曲发酵榴莲籽的酸乳。
3.3 牛乳
红曲霉在牛乳中的应用主要是通过红曲霉产生的酸性蛋白酶制备低抗原性的乳清蛋白,降低潜在的过敏性反应。Lakshman等[72]发现,M.pilosus产生的酸性蛋白酶MpiAP1和MpiAP2处理乳清蛋白水解物后,呈现出最低的抗原性。此外,利用M.purpureusNo.3403菌株产生的MpuAP蛋白具有水解Gln4-His5、His10-Leu11、Ala14-Leu15、Gly23-Phe24和Phe24-Phe25肽键的功能,将MpuAP-胰蛋白酶组合处理乳清蛋白水解物后,抗原性显著降低[85]。
4 结 语
红曲霉因其发酵过程中产生有益次级代谢产物而具有广阔的应用前景,但是橘霉素的存在导致红曲霉的应用受限,在未来的科学研究中,找到提高有益次级代谢产物产量、降低橘霉素产量的发酵方法、阐明红曲霉次级代谢产物的基因调控网络及挖掘红曲霉新代谢产物在新领域中的应用是研究热点[37]。
先前的研究中报道,红曲霉的次级代谢产物调控主要通过改变环境因子(培养基成分、温度、光照、pH值及添加剂等)与基因改造(非定向诱变与定向突变)来实现。环境的改变引起的次级代谢产物合成的改变往往是环境信号通过生物体自身的信号传递及基因调控引起的[86-87]。在真菌中,参与次级代谢产物合成的信号途径有G蛋白信号途径、cAMP信号途径和促分裂素原活化蛋白激酶信号途径等[88]。在红曲霉中,外源添加cAMP可以促进MPs的合成,表明cAMP信号途径可以参与次级代谢产物合成的调控,但是详细的机制仍需要进一步研究。此外,G蛋白信号途径通常在cAMP信号途径上游发挥功能,在红曲霉发酵过程中,G蛋白α亚基Mga1-3参与生长和次级代谢产物的调控[61]。因此,可以进一步探索细胞上游信号转导因子之间的调控关系。
红曲霉组蛋白甲基转移酶编码基因AHS2、乙酰转移酶编码基因TRIA、组蛋白甲基转移酶编码基因LAEA和组蛋白去乙酰化酶编码基因RPD3缺失及过表达影响其次级代谢产物的合成[62-63,66]。在真菌中,组蛋白修饰调控真菌的生长发育、孢子萌发及次级代谢产物合成等重要生理过程,在红曲霉中,是否还有其他保守的组蛋白修饰组分参与次级代谢产物的调控有待进一步探索。有研究[67]表明,一些转录因子可以参与红曲霉的生长发育和次级代谢产物靶基因的转录调控,可以进一步探索转录因子调控次级代谢产物靶基因转录的详细机制,为红曲霉的安全利用提供新的靶点。
此外,当今社会人们对功能性乳制品的需求量日益增加以及保障乳制品的质量与安全至关重要[89-90]。目前的研究显示,红曲霉在乳制品的产品研发中具有良好的应用前景,如何在红曲霉乳制品的制作中控制橘霉素的产量至关重要。在生产实践中,可以探索通过改变发酵温度等环境条件,制备出不产橘霉素同时含有有益次级代谢产物的红曲风味的乳制品,可以让人们享受到美味口感和得到安全保障的同时,有效地促进机体健康。

