反相高效液相色谱法测定发酵乳中赤藓红含量
陈 静,段国霞,刘丽君,李翠枝*,吕志勇
(内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010110)
赤藓红,又名樱桃红,是一种人工合成着色剂,由荧光素碘化而成,其性质稳定、色彩鲜艳、成本低廉。目前,赤藓红的应用很广泛[1-4],其作为常见的人工食品添加剂已成为人们日常消耗品的一部分[5],可单独使用或与其他食用色素复配使用,经常添加于食品、药品、化妆品中,也可以作为反应剂[6]等应用于各类研究中。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[7]对其使用量有严格规定,并建立了相应的国标方法[8]进行检测,但对于赤藓红的检测方法为液-液萃取法,操作方法复杂,且方法适用基质有限。根据现有文献报道,赤藓红应用的基质很广,食品类包括:蛋糕[9]、酒类[10]、饮料[11-12]、冷冻饮品[13]、肉制品[14]、罐头[15]、糯米类[16-17]、蜜饯[18]、辣椒粉[19]等;药品包括:中药类[20-21]、西药类[22]、药品包装[23-24]等;其他类包括:烟草类[25-27]等。其检测方法也有很多,如高效液相色谱法[28]、超高效液相色谱法[29]、高效液相色谱-质谱联用法[30-31]、共振瑞利散射法等其他方法[32-33]。但对发酵乳中赤藓红的测定还少有报道。发酵乳中一般不添加赤藓红,对于含有果酱、果泥、果粒等的果品发酵乳会有一定的带入风险,对产品质量控制和风险控制产生潜在风险。
本研究拟建立发酵乳中赤藓红的反相高效液相色谱检测方法。采用酶法水解蛋白,无水乙醇提取,碱性条件下固相萃取小柱净化富集,经反相C18柱分离,紫外可见检测器检测,保留时间定性,外标法定量。
1 材料与方法
1.1 材料与试剂
发酵乳 市售。
甲醇(色谱纯)(诺尔施) 成都市科隆化学品有限公司;无水乙醇(色谱纯) 福晨(天津)化学试剂有限公司;氨水(优级纯) 天津市富宇精细化工有限公司;乙酸铵(优级纯) 天津市光复精细化工研究所;氢氧化钠(分析纯) 天津市风船化学试剂科技有限公司;实验用水为Milli-Q超纯水;赤藓红标准品(纯度85.7%) 德国Dr.Ehrensorfer公司;木瓜蛋白酶(酶活力2 000 U/mg) 上海泰坦科技股份有限公司;HLB固相萃取小柱(3 cc,60 mg) 美国Waters公司。
1.2 仪器与设备
1260高效液相色谱仪(配备紫外检测器) 美国安捷伦公司;AL204分析天平、PE20K pH计 瑞士Mettler-Toledo公司;SHA-B水浴恒温振荡器 常州市凯航仪器有限公司;KQ-600DB数控超声清洗器 昆山市超声仪器有限公司;3K30高速离心机 德国Sigma公司;TurboVap LV氮气浓缩装置 美国Biotage公司;0.45 μm微孔过滤器 上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 流动相溶液配制
乙酸铵溶液(20 mmol/L,pH 6.5):称取1.542 g乙酸铵于800 mL超纯水中,用冰乙酸调节pH值至6.5,用超纯水定容至1 000 mL。
体积分数5%氨化甲醇溶液:量取甲醇95 mL、氨水5 mL混匀。
氢氧化钠溶液(20 g/L):称取2 g氢氧化钠,加水至100 mL,溶解混匀。
1.3.2 标准溶液配制及标准曲线的绘制
赤藓红标准储备液(1.00 mg/mL):准确称取按其纯度折算为100%质量的赤藓红标准品0.100 g,置于100 mL容量瓶中,用水定容至刻度。
赤藓红标准中间液(100 μg/mL):准确移取赤藓红标准储备液1.0 mL于10 mL容量瓶中,用水定容至刻度。
赤藓红标准工作液:上述混合中间液用水分别稀释成质量浓度为0.05、0.10、0.20、0.50、1.00、5.00、10.00、20.00 μg/mL的工作液。现用现配。
标准曲线制作:将混合标准工作液进行色谱测定,记录各组分的色谱峰面积,以质量浓度为横坐标(x),峰面积为纵坐标(y),绘制标准曲线。
1.3.3 样品处理
准确称取试样1.0 g(精确至0.000 1 g)于10 mL容量瓶,加入0.04 U木瓜蛋白酶,加水至约3 mL,60 ℃水浴30 min[34]。酶解后的试样自然冷却至室温,使用无水乙醇定容至10 mL,振荡摇匀,超声30 min,于4 ℃、8 000 r/min离心5 min。取上清液5 mL,使用20 g/L氢氧化钠溶液调节pH 7.5~7.7。上述前处理溶液加入活化好的HLB小柱(分别使用5 mL甲醇、5 mL水活化),速率为1 滴/s,待液体全部留出,用水洗涤,然后用6 mL 5%氨化甲醇溶液洗脱,收集洗脱液,于氮吹浓缩仪上60 ℃吹干,加入1.0 mL水溶解,摇匀后上机。
1.3.4 色谱条件
色谱柱:月旭-AQ C18柱(250 mm×4.6 mm,5 μm);流动相:20 mmol/L乙酸铵缓冲盐(pH 6.5)-甲醇体系,梯度洗脱程序如表1所示;检测器波长520 nm;进样量30 μL;柱温40 ℃;流速1 mL/min。

表1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure
1.3.5 结果计算
将试样溶液进行色谱测定,记录各组分的色谱峰面积。按照下式计算样品中赤藓红的含量。
式中:X为样品中赤藓红含量/(mg/kg);ρ为由标准曲线计算得出的试样中赤藓红质量浓度/(μg/mL);V为定容体积/mL;n为稀释倍数;m为样品质量/g。
1.3.6 回收率和精密度测定
回收率测定:在空白发酵乳中分别添加不同量的赤藓红,进行加标回收实验,分别平行测定6 次,并计算相对标准偏差(relative standard deviation,RSD)。
精密度测定:对发酵乳加标样品分别进行6 次重复测定,并计算RSD。
1.4 数据处理
使用Excel软件进行处理及分析。
2 结果与分析
2.1 前处理方法优化
2.1.1 加酶量的选择
一般合成着色剂与蛋白质的相互作用力通常被认为是非共价键作用,包括氢键、范德华力、疏水及静电作用等[35],使用木瓜蛋白酶对蛋白质进行酶解,生成小分子的肽[36-37],破坏了蛋白质的结构,减少了非共价键作用,从而可以使合成着色剂更易使用无水乙醇提取。发酵乳的pH值一般为4.6~5.2,均为酸性,蛋白质处于紧密结合的状态,使用单一有机溶剂不能完全提取发酵乳中的赤藓红,需要分解蛋白质后再进行提取。
分解样品中蛋白质所需木瓜蛋白酶量与样品蛋白质含量相关,即与样品称样量相关。确定样品称样量为1 g,使用赤藓红添加量为1.0 mg/kg的发酵乳试样进行不同加酶量实验。由图1可知,当样品称样量为1 g,加酶量大于0.03 U时,赤藓红回收率均大于90%,而加酶量为0.04 U时回收率大于95%。使用Minitab软件对赤藓红回收率结果进行单因子方差分析,表明在95%置信度下,不同加酶量的回收率有显著差异。考率到酶成本和高回收率原则等因素,确定加酶量为0.04 U作为后续实验最佳条件。

图1 不同加酶量与赤藓红回收率结果箱线图(nn==33)Fig.1 Effect of papain dosage on the recovery of erythrosine (n = 3)
2.1.2 提取溶剂的选择
一般合成着色剂的提取溶剂有氨水-无水乙醇体系等有机溶剂和水相溶剂。因氨水具有高挥发性和强刺激性,对人体有一定的危害。分别采用无水乙醇、甲醇、水作为提取溶剂,对赤藓红添加量为1.0 mg/kg的发酵乳试样进行实验,平行测定3 次。由图2可知,在95%置信度下,不同提取溶剂的回收率结果有显著差异。使用水作为提取溶剂,因受发酵乳溶液pH值的影响,赤藓红与蛋白质的结合比较紧密,其提取回收率较低;使用有机溶剂提取时,同样条件下无水乙醇的提取回收率比甲醇高。综上所述,选择无水乙醇作为提取溶剂。
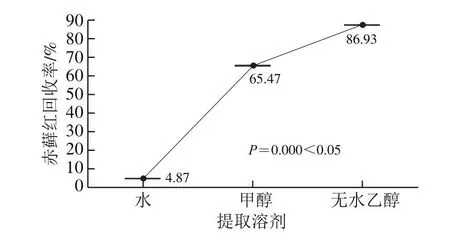
图2 不同提取溶剂与赤藓红回收率结果箱线图(nn==33)Fig.2 Effect of extraction solvents on the recovery of erythrosine (nn = 3)
2.1.3 提取溶剂添加量的选择
提取溶剂的提取能力是影响回收率结果的关键,一般情况下,有机溶剂与水相的比例会影响目标物的提取,即酶解水相与提取溶剂体积比会影响回收率。对赤藓红添加量为1.0 mg/kg的发酵乳试样,采用酶解水相与无水乙醇体积比分别为2∶8、3∶7、4∶6、5∶5、6∶4进行实验。由图3可知,在95%置信度下,不同体积比对回收率结果有显著影响。体积比2∶8、3∶7、4∶6的回收率均在90%以上,符合GB/T 27404《实验室质量控制规范 食品理化检测》关于回收率的要求。实验使用体积比4∶6提取,样液离心后,溶液仍不澄清,不利于过柱;体积比2∶8和3∶7条件下回收率较高,均大于95%。在95%置信度下,体积比2∶8和3∶7对回收率结果无显著影响,但体积比2∶8条件下操作时,2 mL的水不易完全溶解样品,尤其是黏稠的发酵乳样品,影响样品酶解及测定值的准确性,故确定酶解水相与无水乙醇体积比3∶7作为提取溶剂的最佳比例。
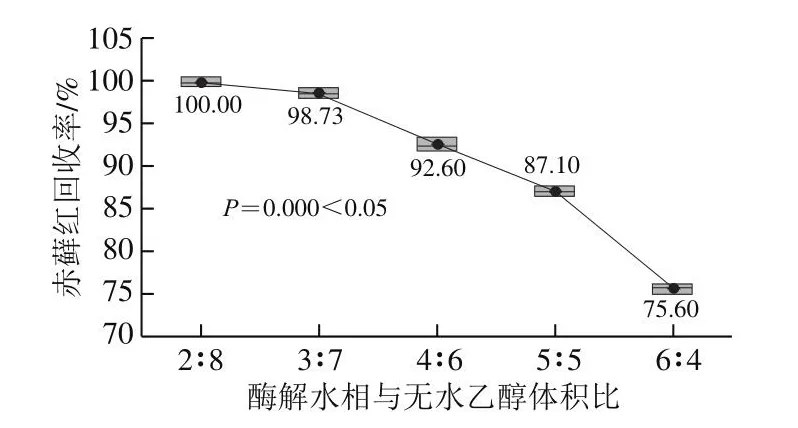
图3 不同酶解水相与无水乙醇体积比与赤藓红回收率结果箱线图(nn==33)Fig.3 Effect of volume ratio between enzymatic hydrolysate and anhydrous ethanol on the recovery of erythrosine (nn = 3)
2.1.4 超声时间的选择
分别使用超声时间10、20、30、40 min进行实验。由图4可知,在95%置信度下,不同的超声时间对回收率结果有影响。超声时间10、20、30、40 min条件下的回收率均在90%以上,符合GB/T 27404关于回收率的要求。而超声时间30、40 min的回收率均大于95%,考虑到高回收率和时间节约原则,选择超声时间为30 min。
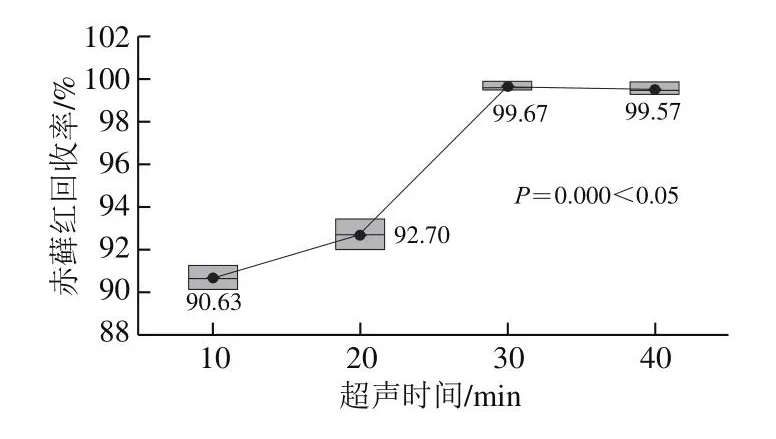
图4 不同超声时间与赤藓红回收率结果箱线图(nn==33)Fig.4 Effect of ultrasonic time on the recovery of erythrosine (nn = 3)
2.2 过柱条件的选择
目前文献方法中使用的固相萃取小柱有聚酰胺小柱、HLB小柱等。聚酰胺小柱的一般上柱方式是酸性上柱、淋洗,碱性洗脱,赤藓红色素耐酸碱性较差,故本研究选择HLB固相萃取小柱进行净化富集,并对样液过柱pH值进行研究。分别调节样液pH值为4.6、5.0、6.5、7.0、7.5、8.0、8.5进行实验。由图5可知,pH值7.5时的回收率大于90%,且回收率稳定,在95%置信度下,不同的过柱pH值对回收率结果有显著影响。需要进一步选择pH值范围,细化pH值为7.4、7.5、7.6、7.7、7.8,由图6可知,pH值7.4~7.7时的回收率均大于90%且稳定,符合GB/T 27404关于回收率的要求,在95%置信度下,不同的过柱pH值对回收率有显著影响,pH值为7.4和7.8时的回收率均小于95%,pH值为7.5、7.6、7.7时回收率均大于95%。由图7可知,进一步分析发现,pH值为7.5~7.7条件下,在95%置信度下,不同的过柱pH值对回收率无显著影响。考虑高回收率原则,选择过柱pH值为7.5~7.7。
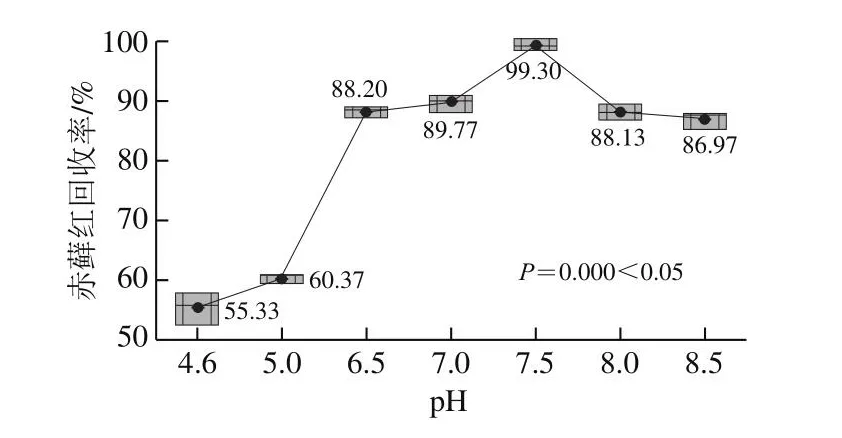
图5 不同上柱pH值(4.6、5.0、6.5、7.0、7.5、8.0、8.5)与赤藓红回收率结果箱线图(nn==33)Fig.5 Effect of sample pH (4.6, 5.0, 6.5, 7.0, 7.5, 8.0, and 8.5) on the recovery of erythrosine (nn = 3)
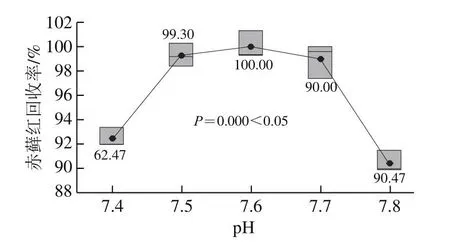
图6 不同上柱pH值(7.4、7.5、7.6、7.7、7.8)与赤藓红回收率结果箱线图(nn==33)Fig.6 Effect of sample pH (7.4, 7.5, 7.6, 7.7 and 7.8) on the recovery of erythrosine (nn = 3)
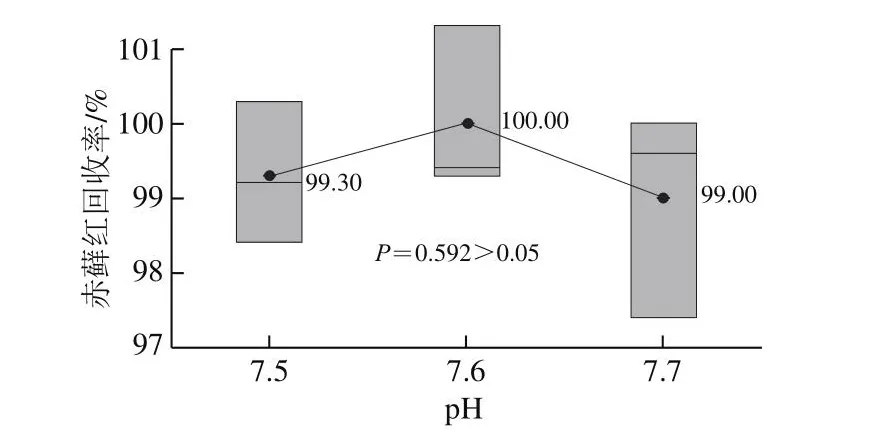
图7 不同上柱pH值(7.5、7.6、7.7)与赤藓红回收率结果箱线图(nn==33)Fig.7 Effect of sample pH (7.5, 7.6 and 7.7) on the recovery of erythrosine (nn = 3)
2.3 方法学考察
2.3.1 线性方程与相关系数
将不同质量浓度的赤藓红系列标准工作液在不同时间、上述洗脱条件下经高效液相色谱仪测定,并计算线性回归方程。由表2可知,配制3 d的标准工作液得到的标准工作曲线的相关系数均大于0.999,表明目标物的线性关系良好。
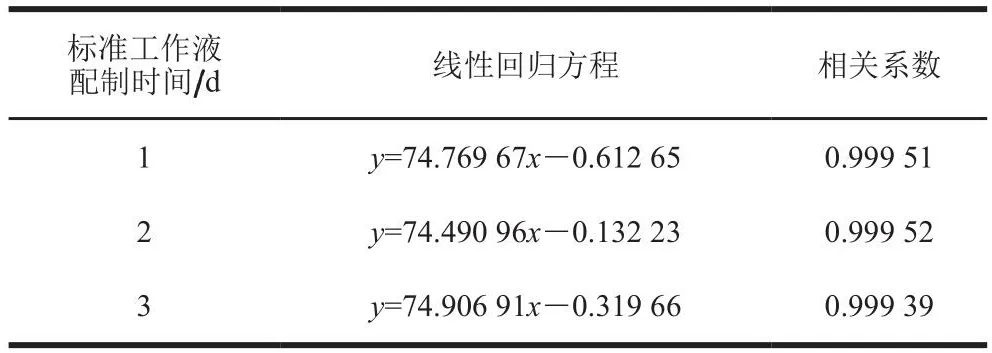
表2 赤藓红的线性回归方程及相关系数Table 2 Linear regression equations and correlation coefficients for erythrosine standard solution stored for different time periods
2.3.2 定量限与检出限
对赤藓红添加量为2 mg/kg的发酵乳试样进行测定,由图8可知,色谱图杂质峰干扰小,分离度为2.56,符合《中国药典》中关于分离度≥1.5的要求。
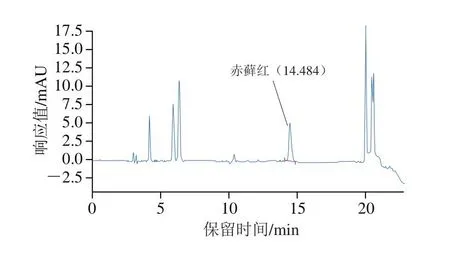
图8 发酵乳加标样品反相高效液相色谱图Fig.8 Reversed-phase high performance liquid chromatogram of spiked fermented milk
由表3可知,按照信噪比(RS/N)均满足≥3的要求,赤藓红的检出限为0.1 mg/kg,按照RS/N均满足≥10的要求,赤藓红的定量限为0.2 mg/kg。

表3 赤藓红的检出限与定量限Table 3 LODs and LOQs of erythrosine
2.3.3 方法的回收率与精密度
测定发酵乳中添加定量限、2 倍定量限和10 倍定量限3 个不同添加量赤藓红的加标回收率。由表4可知,赤藓红的加标回收率为93.1%~105.6%,RSD为1.87%~2.21%,说明该方法测定发酵乳中赤藓红具有很好的准确度和精密度。

表4 赤藓红的加标回收率及精密度测定结果(nn==66)Table 4 Recoveries and precision (RSD) of erythrosine in spiked fermented milk (nn = 6)
2.4 实际样品测定
根据本研究方法对市售7 款含果品发酵乳进行测定,由表5可知,目前市售添加果泥、果粒等原料的发酵乳未检出赤藓红。

表5 样品中赤藓红测定结果Table 5 Results of erythrosine detection in real samples
3 结 论
采用反相高效液相色谱法对发酵乳中赤藓红的含量进行测定时,样品采用酶法水解蛋白、无水乙醇提取,碱性过柱净化,采用C18色谱柱分离,应用甲醇-乙酸铵缓冲溶液作为流动相进行梯度洗脱。结果表明,本方法准确度满足定量要求,方法精密度良好,回收率高,操作简便,适用于发酵乳中赤藓红含量的测定,可为发酵乳中赤藓红的检测及风险监控提供技术支持。

