基于非靶向代谢组学与转录组学探究氨基酸缓解甘草酸苷致大鼠假性醛固酮增多症的分子机制
王子航, 单 宇, 谢湘云,2, 王 梅,2,3, 高晓黎,2,3
(1新疆医科大学药学院; 2新疆及中亚特色医药资源教育部工程研究中心; 3新疆天然药物活性组分与释药技术重点实验室, 乌鲁木齐 830017)
甘草酸类制剂是治疗慢性肝病,改善肝功能异常的一线推荐药物;还可以治疗湿疹、皮肤炎、斑秃。该药物临床主要不良反应为假性醛固酮增多症(Pseudo-hyperaldosteronism, PA),常表现为水钠潴留导致的水肿。复方甘草酸苷片是由甘草酸单铵盐(Monoammonium glycyrrhizinate,MAG)、甘氨酸(Glycine,Gly.)、DL-甲硫氨酸(DL-Methionine,Met.)组成的复方制剂,其中甘草酸单铵盐具有保护肝细胞膜[1]、抗炎[2]、抗病毒[3]、免疫调节[4]及类固醇激素样[5]作用,配方中甘氨酸和DL-甲硫氨酸可缓解甘草酸苷的副作用PA,提高肝脏的解毒能力[6],减少过敏反应。但目前尚未见研究报道甘氨酸与DL-甲硫氨酸缓解由甘草酸苷引起的轻微PA症的机制[7]。本研究采用代谢组学多参数应答的特性,通过差异代谢物的鉴定与分析来研究氨基酸对PA缓解的代谢变化,通过转录组学数据分析与醛固酮增多症相关的醛固酮腺瘤患者(Aldosterone Producing Adenoma,APA)差异基因功能,筛选甘氨酸和DL-甲硫氨酸改善醛固酮增多的可能靶点。以期通过实验验证复方甘草酸苷片中两种氨基酸甘氨酸和DL-甲硫氨酸的增效减毒作用机制。
1 材料与方法
1.1 试药甘草酸单铵盐(陕西富捷药业有限公司,2019110302);甘氨酸(天津天药药业股份有限公司,AGLYB190442);DL-甲硫氨酸(修正药业集团柳河制药有限公司,20190919);苏木素-伊红染料(北京中杉金桥生物技术有限公司,BSBA-4025);乙腈(美国Merc公司,1499230-935);甲醇(美国Thermo Fisher公司,A456-4);氨水(美国Thermo Fisher公司,A470-500);乙酸铵(美国Sigma公司,70221)。
1.2 实验动物取18只SPF级SD大鼠,雌雄各半,由新疆医科大学动物实验中心提供,实验动物许可证号为SYXK(新)2018-0003;饲养条件:温度20~25℃,相对湿度40%~70%,光照12 h/d,自由进食与饮水。
1.3 仪器AB triple TOF 6600型石蜡切片机(上海徕卡仪器有限公司);AB SCIEX型病理组织包埋机(上海徕卡仪器有限公司);Agilent 1290 Infinity 型LC超高压液相色谱仪(安捷伦科技有限公司)。
1.4 方法
1.4.1 动物分组及给药剂量 将18只SD大鼠适应性喂养1周,随机分成3组:空白对照组,甘草酸苷组,甘草酸苷与氨基酸复方组。灌胃周期14 d,空白对照组,灌胃相同体积的生理盐水;甘草酸苷组,以甘草酸单铵盐计,灌胃300 mg/kg甘草酸单铵盐溶液;甘草酸苷与氨基酸复方组,灌胃300 mg/kg甘草酸单铵盐与氨基酸的混合溶液,组成为甘草酸单铵盐∶甘氨酸∶DL-甲硫氨酸(1.25∶1∶1,w:w:w)。
1.4.2 样本采集及处理 各组大鼠灌胃14 d后,禁食12 h,麻醉,暴露腹腔,收集肝脏左、中叶及肾脏。肾脏及肝脏中叶保存于10%多聚甲醛中用于后续HE染色,肝脏左叶保存于-80℃冰箱用于代谢组学分析。肝脏组织于4 ℃缓慢解冻后,取适量样本加入预冷甲醇-乙腈-水混合溶液(2∶2∶1,v/v),涡旋混合,低温超声30 min,-20℃静置10 min,14 000 r/min,4℃离心20 min,上清液真空干燥,加入100 μL乙腈水溶液(乙腈∶水=1∶1,v/v)复溶,涡旋,14 000 r/min,4℃离心15 min。收集上清用于超高效液相色谱分析-串联质谱(UHPLC-MS)分析。通过汇集研究过程中收集的肝脏组织样品的等分试样制备QC样品。
1.4.3 大鼠肾脏、肝脏组织学检查 采集的肾脏、肝脏组织通过脱水、包埋、切片、苏木精-伊红染色,光镜下观察肝脏及肾脏的组织学损伤程度。
1.4.4 色谱条件 色谱柱:Agilent 1290 Infinity LC 超高效液相色谱系统(UHPLC)HILIC色谱柱;柱温25℃;流速0.5 mL/min;进样量2 μL;流动相组成:25 mmol 乙酸铵与25 mmol氨水混合水溶液与乙腈;梯度洗脱程序见表1。质谱条件:采用电喷雾电离正离子和负离子模式,ESI 源设置参数如下:雾化气辅助加热气1∶60,辅助加热气2∶60,气帘气(CUR)30 psi,离子源温度600℃,喷雾电压(ISVF)±5 500 V(正负两种模式);一级质荷比检测范围:60~1 000 Da,二级子离子质荷比检测范围:25~1 000 Da,一级质谱扫描累积时间:0.20 s/spectra, 二级质谱扫描累积时间0.05 s/spectra;二级质谱采用数据依赖型采集模式获得,并且采用峰强度值筛选模式,去簇电压:±60 V(正负两种模式),碰撞能量:35±15 eV,IDA设置:动态排除同位素离子范围:4 Da,每次扫描采集10个碎片图谱。

表1 流动相梯度洗脱程序
1.4.5 代谢组学数据分析方法 将Wiff格式原始数据经ProteoWizard转换成mzXML格式,采用XCMS软件进行峰对齐、保留时间校正和提取峰面积。对XCMS提取的数据进行代谢物结构鉴定、数据预处理、实验数据质量评价,再进行单变量统计分析、差异代谢物筛选、KEGG通路分析。
1.4.6 转录组学数据分析及甘氨酸、DL-甲硫氨酸作用机制分析 在GEO(https://www.ncbi.nlm.nih.gov/geo)数据库以“aldosterone producing adenoma(APA)”为关键词搜索相关基因表达数据,下载数据并利用R软件以P<0.05和靶点差值倍数(log2FC)>1为筛选标准进行差异基因分析。为明确作用靶点参与的信号转导过程,应用R程序的“org.Hs.eg.db”功能对其进行ID转换并采用京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析其参与的通路过程;使用“pathway”功能对富集得到的通路进行下载,并分析通路间关系。采用Swiss Target Prediction、相似集成算法(Similarity ensemble approach,SEA)、Super-PRED数据库(逻辑回归机器学习模型预测)收集甘氨酸、DL-甲硫氨酸作用靶点。将甘氨酸与DL-甲硫氨酸作用靶点与Veen图中交集靶点于Cytoscape 3.8.0软件进行导入,分析靶点间关系并设置相关可视化参数,获得药物-疾病-靶点相互作用网络图。使用R Studio的“ClusterProfiler”功能对药物可能作用靶点进行基因本体(Gene Ontology,GO)的生物过程、细胞组成与分子功能富集分析,获得目的分子参与的病理生理过程。
2 结果
2.1 大鼠肾脏、肝脏组织学检测空白对照组大鼠肾小管腔圆形或近似圆形,形态正常,甘草酸苷组与甘草酸苷与氨基酸复方组出现部分肾小管扩张,肾近曲小管上皮水肿++,提示出现肾损伤,而甘草酸苷与氨基酸复方组肾损伤减轻,如图1 A~C所示。空白对照组肝细胞排列紧密,形态正常,甘草酸苷组与甘草酸苷与氨基酸复方组出现肝细胞空泡变性++,提示出现肝损伤,甘草酸苷与氨基酸复方组肝损伤减轻。证明过量甘草酸苷可导致PA,引入氨基酸后能缓解甘草酸苷导致的PA,如图1 D~F所示。
2.2 PA代谢组学分析对代谢物进行主成分分析,观察组间样本的总体分布趋势和组间样本的差异度,经7-fold cross-validation得到的正离子PCA 模型共有3个主成分,R2X模型解释率等于0.581 cum>0.5 cm,负离子PCA 模型共有3个主成分,R2X模型解释率等于0.528 cum>0.5 cm,组内聚集度高,组间分离明显,说明模型可靠,甘草酸苷组与空白对照组组间有明显差异。经7-fold cross-validation得到的正离子PCA模型有2个主成分,R2X模型解释率等于0.51 cum,负离子PCA 模型有3个主成分,R2X模型解释率等于0.561 cum,组内聚集度高,组间分离明显,说明模型可靠,甘草酸苷组与甘草酸苷与氨基酸复方组间有明显差异。OPLS-DA可在不降低模型预测能力前提下,能够有效减少模型复杂性与增加解释能力。经7-fold cross-validation,甘草酸苷组与空白对照组模型正离子模型的模型预测能力Q2为0.421,见图2A。甘草酸苷组与甘草酸苷与氨基酸复方组正离子模型的模型预测能力Q2为0.376,见图2 B。来自不同组的样本显示出差异,各组样本聚集在一起并明显分开说明模型稳定性好,可靠性高。

注:A、D:空白对照组;B、E:甘草酸苷组;C、F:甘草酸苷与氨基酸复方组。(A~C)大鼠肾脏HE染色图,(D~F)大鼠肝脏HE染色图。

图2A 甘草酸苷组与空白对照组正离子OPLS-DA得分图 图2B 甘草酸苷组与甘草酸苷与氨基酸复方组正离子OPLS-DA得分图
2.3 筛选PA差异代谢物根据OPLS-DA模型得到的变量权重值(Variable Importance for the Projection, VIP)来衡量各代谢物的表达模式对分类判别的解释能力,以严格的OPLS-DA VIP>1和P<0.05为显著性差异代谢物筛选标准。如表2所示,甘草酸苷组与空白对照组的总差异代谢物数量为12种;如表3所示,甘草酸苷组与甘草酸苷与氨基酸复方组的总差异代谢物数量为9种。
2.4 PA差异代谢物代谢通路分析将筛选的差异代谢物合并后,选择差异代谢物数量大于5的KEGG代谢通路取交集。甘草酸苷组与甘草酸苷与氨基酸复方组差异代谢物的变化影响包括脂肪酸生物合成、ABC转运蛋白、甘氨酸-丝氨酸-苏氨酸代谢等信号通路。
2.5 转录组学分析及甘氨酸、DL-甲硫氨酸作用机制分析
2.5.1 APA差异基因分析 通过转录水平研究患者醛固酮升高的机制,对APA患者(GSE156931)差异基因分析发现733个基因下调,809个基因下调。APA患者基因差异较大以低表达为主,如图3所示。对基因表达差异较大的分子以热图的形式展示,结果发现样本分离度较好,无离散型样本,差异分子稳定表达,其中APA患者MYB、PPY、DDC的转录水平高表达,SCG2、PENK、CHGA、PNMT、DBH表达量降低,如图4所示。
2.5.2 差异基因功能学分析 使用R软件对差异基因进行GO富集功能分析,发现这些基因参与着神经元投射发育的调节、化学突触传递的调节与跨突触信号的调节等生物过程;调节着细胞组分;具有受体配体活性、G蛋白偶联受体结合与钙调素结合等分子功能,见图5。KEGG通路分析发现,APA患者的神经活性配体-受体相互作用、钙信号通路、轴突导向与Wnt信号通路等通路发生了变化如图6所示。基因集富集分析(GSEA)发现患者的TNF-α/NFκB和胰岛β细胞被抑制,如图7所示。

表2 甘草酸苷组与空白对照组显著性差异代谢物

表3 甘草酸苷组与甘草酸苷与氨基酸复方组显著性差异代谢物

图3 醛固酮腺瘤患者差异基因火山图

图4 醛固酮腺瘤患者差异基因热图

图5 醛固酮腺瘤患者差异基因GO分析图

图6 醛固酮腺瘤患者KEGG通路分析图

图 7 醛固酮腺瘤患者GSEA分析图
2.5.3 靶点收集 为了进一步探究甘氨酸与DL-甲硫氨酸缓解APA患者醛固酮增多症状的机制,通过SwissTargetPrediction、SEA、Super-PRED与HT-docking收集甘氨酸238个靶点,DL-甲硫氨酸328个靶点,如图8A所示。对三者取交集发现,两种氨基酸可能通过共同作用于10个靶点调节醛固酮增多,此外,甘氨酸可通过ESR2、LDLR、CBS等靶点调节。DL-甲硫氨酸可通过DNMT1、EZH1、GRIA1等靶点调节,见图8B所示。
2.5.4 氨基酸调控APA的功能分析及其联合分析 为研究两种氨基酸调节醛固酮增多的分子机制,使用R软件对交集基因GO富集分析发现两种氨基酸通过参与神经递质受体活性、神经递质结合、胞外配体门控离子通道活性等生物过程调节醛固酮,如图9所示。KEGG通路分析发现,两种氨基酸的神经活性配体-受体相互作用、GnRH分泌、亚油酸代谢等信号通路发生变化,如图10所示。
2.5.5 氨基酸调控APA的联合分析 对两种氨基酸与醛固酮增多症生物过程的富集结果进行汇总,结果发现,氨基酸可能通过调节磷脂代谢过程的调节、类异戊二烯代谢、甘油脂类等代谢过程和胞质钙离子浓度、钙离子稳态、钙离子调节的胞吐等钙调节过程进而改善醛固酮增多,如图11所示。对两种机制进行可视化分析发现,两种氨基酸可能通过作用于GSTP1、LDLR等11个靶点调节多种代谢过程,如图12所示。也可能通过调节HTR2B、P2RX7、GABBR1等7个靶点改变钙信号级联反应,如图13所示。

图8A 甘氨酸、DL-甲硫氨酸、APA交集基因图 图8B 氨基酸靶点网络图

图9 氨基酸与APA交集基因的GO分析图
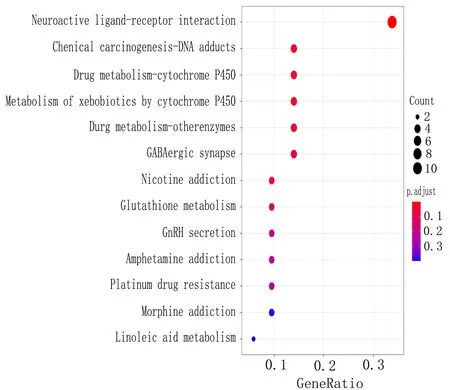
图10 氨基酸与APA交集基因的KEGG图

图11 氨基酸与APA生物过程联合分析图

图12 氨基酸调节代谢过程的生物过程图

图13 氨基酸调节钙信号通路的生物过程图
3 讨论
甘草酸苷口服后解离形成甘草酸被肠道菌群转化成甘草次酸[8],具有多种药理作用被广泛用于临床。大剂量甘草酸导致的PA[9]越来越受到关注。机制是甘草酸苷及其代谢产物能够抑制肾小管上皮细胞中11β-羟基类固醇脱氢酶Ⅱ[10],抑制皮质醇向可的松的转化,使皮质醇浓度增加,引起PA[11]。
本实验中进行的PA大鼠肾脏、肝脏组织病理学检测表明,过量的甘草酸苷导致了大鼠PA,引入氨基酸后缓解了上述症状。与空白对照组相比,通过代谢组学分析,甘草酸苷组大鼠肝脏中12种代谢物发生显著性变化。与甘草酸苷组相比,甘草酸苷与氨基酸复方组大鼠肝脏中9种代谢物发生显著性变化,并涉及脂肪酸生物合成、ABC转运蛋白、甘氨酸-丝氨酸-苏氨酸代谢等信号通路,表明氨基酸的加入可能对机体代谢有广泛影响。
综合文献对以上代谢物及通路的改变进行分析,观察到脂肪酸类代谢产物肉豆蔻酸的差异。脂肪酸广泛参与肾脏疾病[12]、代谢类疾病[13]、心血管疾病[14]。醛固酮增多和脂质代谢有关[15],脂质第二信使可以从多水平上调醛固酮的产生[16]。磷脂酶-C可增加磷酸肌醇和二酰基甘油产生使血管紧张素Ⅱ刺激肾上腺球状带分泌醛固酮[17]。因此推测肉豆蔻酸可能参与脂质代谢调节醛固酮的生成。另一种差异代谢物甜菜碱上调可抑制脂肪酸合成,刺激脂肪酸氧化和脂质分泌,改善脂质代谢[18],故缓解假性醛固酮增多症。光色素有氧化还原酶的作用,参与着机体的氧化反应,可通过下调脂质代谢因子DGAT2等蛋白水平调节脂质氧化反应[19];KEGG分析发现其参与核黄素代谢途径,核黄素能够影响醛固酮在肾脏中对钠离子的重吸收作用,并对盐皮质激素高血压型的大鼠有抗高血压作用[20-21]。光色素通过多途径影响醛固酮增多。本实验样本量少导致代谢组学分析时OPLS-DA负离子模式打分较低,预测结果出现偏差,因此没有筛选负离子模式的差异代谢物。
肾上腺分泌过多的醛固酮抑制了肾素-血管紧张素系统,有35 %的病例出现APA[22]。APA与PA发病机制相似,可通过分析APA患者差异基因的表达推测PA的发病机制。故本研究进一步分析APA患者差异表达基因,明确疾病状态下的病理生理机制,KEGG通路分析发现与钙信号调节等信号通路有关。收集氨基酸与APA的交集靶点联合分析后发现氨基酸通过作用于GSTP1、LDLR等11个靶点,参与多种代谢过程并调节HTR2B、P2RX7、GABBR1等7个靶点改变钙信号通路的多机制缓解醛固酮增多。钙离子是驱动类固醇类激素产生的关键第二信使,血管紧张素Ⅱ调节钙通道,可控制醛固酮的合成与分泌[23],HTR2B通过介导钙通道调节醛固酮的生成[24]。氨基酸作用靶点HTR2B改变其钙信号通路缓解APA患者醛固酮增多的症状。LDLR可参与脂蛋白的运输[25]并通过介导增加透明肿瘤细胞胆固醇的形式影响APA[26]。推测LDLR参与脂代谢调节肉豆蔻酸调节醛固酮的变化。氨基酸可通过作用靶点LDLR改变其代谢通路,调节肉豆蔻酸缓解APA患者醛固酮增多的症状。转录组学数据分析时数据库中PA的样本较少,而APA的致病机制与PA相似,故选取APA患者进行分析。

