复方阿莫西林乳房注入剂无菌检查方法的优化
韩宁宁,彭文绣,王 轩,赵 晖,杨秀玉,戴 青,赵富华
(中国兽医药品监察所,北京 100081)
阿莫西林乳房注入剂是由阿莫西林、舒巴坦、泼尼松龙与矿物油制成的供乳房灌注用灭菌混悬油溶液,用于奶牛泌乳期乳房炎的治疗。β-内酰胺酶抑制剂舒巴坦与β-内酰胺类抗生素阿莫西林联用,可起到增效和扩大抗菌谱作用[1-2],糖皮质激素药物泼尼松龙可增加机体对炎症的耐受性以及降低炎症的血管反应与细胞反应。无菌检查是控制乳房注入剂安全性的重要项目。复方阿莫西林乳房注入剂的质量标准收载于《兽药质量标准汇编》(2013年版)[3]中,无菌检查采用直接接种法。经国家兽药基础数据库[4]查询,目前有4家兽药生产企业获得了该品种的批准文号,相应产品执行该标准。2019年,农业农村部公告第150号[5]批准了该品种的变更注册,并发布了修订后的质量标准,但无菌检查方法并未发生变更。部分企业在执行该无菌检查标准的过程中反映,供试品接种后呈混悬状态,无法准确判断是否有菌生长,且操作繁琐,易受外源性微生物污染,对人员操作和环境洁净程度要求较高。而薄膜过滤法作为各国药典收载的无菌检查的首选方法[6-7],可克服上述问题。因此,拟将复方阿莫西林乳房注入剂无菌检查方法进行优化,优先考虑采用薄膜过滤法。
1 材料与方法
1.1 材料
1.1.1 供试品 共收集到来自2家兽药生产企业的4批样品,见表1。

表1 样品信息Tab1 Information of samples
1.1.2 试验菌种 金黄色葡萄球菌[CMCC (B) 26003]、大肠埃希菌[CMCC (B) 44102]、铜绿假单胞菌[CMCC (B) 10104]、枯草芽孢杆菌[CMCC (B)63501]、生孢梭菌[CMCC (B) 64941]、白色念珠菌[CMCC (F) 98001]和黑曲霉[CMCC (F)98003] 均购自中国食品药品检定研究院。
1.1.3 培养基 硫乙醇酸盐液体培养基、胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基均购自北京中海生物科技有限公司。
1.1.4 仪器及耗材 无菌隔离器(HTY-1650G3)和一次性无菌滤器(EVS3、EVS2)均购自浙江泰林生物技术股份有限公司。青霉素酶(30万单位/mL)购自中国食品药品检定研究院。
1.2 方法
1.2.1 薄膜过滤无菌检查方法的建立
1.2.1.1 萃取溶剂种类的筛选 萃取的油相溶剂采用无抑菌干扰作用且破乳效果良好的肉豆蔻酸异丙酯。将10 g供试品(来源/批号:齐鲁/1709007)置200 mL肉豆蔻酸异丙酯中,混匀,得均匀混悬液。采用三种水相溶剂0.1%蛋白胨溶液、pH 7.0氯化钠-蛋白胨缓冲液和pH 6.0磷酸盐缓冲液分别对破乳后的混悬液进行萃取,并对水油分离效果进行比较,以选择适宜的水相溶剂。
1.2.1.2 萃取溶剂体积的选择 将收集到的两个生产企业的样品分别采用不同体积的油相溶剂(600 mL和200 mL)和水相溶剂(300 mL和100 mL)进行萃取,并对水油分离效果进行比较,以选择适宜的萃取溶剂体积。
1.2.1.3 萃取回收率的考察 为保证样品中油相包被的菌均分配至水相中,同时为验证水相溶剂对菌的生长无抑制作用,对萃取回收率进行了考察。取灭菌后的辅料10 g,置分液漏斗中,加入小于100 cfu/mL的金黄色葡萄球菌菌液2 mL,加600 mL肉豆蔻酸异丙酯,混匀,加入300 mL pH 6.0磷酸盐缓冲液,振摇后静置,取水层置二联滤器上过滤。过滤后取下滤膜置胰酪大豆胨琼脂平板上培养,32.5 ℃培养24 h后计数。
1.2.1.4 冲洗液体积的选择 取10 g供试品置600 mL肉豆蔻酸异丙酯中,混匀,加入300 mL pH 6.0磷酸盐缓冲液,振摇后静置,取水层置二联滤器上过滤后,分别用300 mL/膜、600 mL/膜、900 mL/膜pH 7.0氯化钠-蛋白胨缓冲液进行冲洗后,每个滤筒加入约100 mL硫乙醇酸盐液体培养基,再加入小于100 cfu的金黄色葡萄球菌,32.5 ℃培养并与阳性对照菌的生长情况进行比较,以选择适宜的冲洗体积。
1.2.1.5 青霉素酶用量的选择 取10 g供试品置600 mL肉豆蔻酸异丙酯中,混匀,加入300 mL pH 6.0磷酸盐缓冲液,振摇后静置,取水层置二联滤器上过滤后,用300 mL/膜pH 7.0氯化钠-蛋白胨缓冲液进行冲洗,每个滤筒加入约100 mL硫乙醇酸盐液体培养基,重复制备5个滤筒,分别加入300万单位/膜、30万单位/膜、3万单位/膜、3千单位/膜、300单位/膜的青霉素酶,再加入小于100 cfu的金黄色葡萄球菌,32.5 ℃培养并与阳性对照菌的生长情况进行比较,以选择适宜的青霉素酶用量。
1.2.2 拟建立的薄膜过滤无菌检查法 取混匀后的本品10 g,置灭菌的分液漏斗中,加无菌肉豆蔻酸异丙酯600 mL,充分振摇,再加pH 6.0磷酸盐缓冲液300 mL,振摇,静置,取水层用薄膜过滤法处理,用pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液冲洗滤膜,每次冲洗100 mL/膜,共冲洗3次。每膜加入不少于3万单位青霉素酶。依法检查(附录1101),应符合规定。
1.2.3 方法学验证 按照《中国兽药典》一部附录1101[8]的要求,对上述方法进行验证。
1.2.3.1 菌液的制备 分别取金黄色葡萄球菌、铜绿假单胞菌、枯草芽胞杆菌、大肠埃希菌的新鲜培养物1白金耳,接种于10 mL胰酪大豆胨液体培养基中,经30~35 ℃培养18~24 h,取1 mL分别加入9 mL pH 7.0无菌氯化钠-蛋白胨缓冲液,作为10-1管,逐管10倍稀释至小于100 cfu/mL,活菌计数备用。
取生孢梭菌接种于硫乙醇酸盐流体培养基中,取白色念珠菌接种于沙氏葡萄糖液体培养基中,取黑曲霉接种于沙氏葡萄糖琼脂斜面培养基上,同法操作。
1.2.3.2 活菌计数 分别取上述细菌菌液1 mL加入培养皿,每种菌液做2个平皿,注入胰酪大豆胨琼脂培养基约18 mL,置30~35 ℃培养24~48 h。取生孢梭菌菌液置于硫乙醇酸盐流体培养基中,取真菌菌液注入沙氏葡萄糖琼脂培养基中,同法操作。
1.2.3.3 培养基的灵敏度检查 取每管装量为12 mL的硫乙醇酸盐流体培养基7支,分别接种小于100 cfu的金黄色葡萄球菌、铜绿假单孢菌、生孢梭菌各2支,另1支不接种作为空白对照,培养3 d。另取每管装量为9 mL的胰酪大豆胨液体培养基7支,分别接种小于100 cfu的枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养5 d。以空白对照管应无菌生长,加菌的培养基管生长良好来判定该培养基的灵敏度检查符合规定。
1.2.3.4 薄膜过滤无菌检查法适用性试验 ①供试品阳性菌试验组:取供试品10支,挤出内容物,混匀,取混合样品10 g,置灭菌的分液漏斗中,照1.2.2项操作,在最后一次冲洗液中分别加入小于100 cfu/mL的菌液1 mL,过滤后,每个滤筒内灌注培养基和3万单位青霉素酶,其中金黄色葡萄球菌、大肠埃希菌、生孢梭菌在硫乙醇酸盐流体培养基中,30~35 ℃条件下培养5 d,枯草芽孢杆菌、白色念珠菌、黑曲霉在胰酪大豆胨液体培养基中,20~25 ℃条件下培养5 d,各2组。
②阳性菌对照组:除不加供试品外,其余同法操作。
③供试品组:除不加阳性菌外,其余同法操作。
④阴性对照组:除不加供试品和阳性菌外,其余同法操作。
1.2.4 供试品的无菌检查 因上市抽验样品的最少检验数量不包括阳性对照用量,因此在进行供试品无菌检查实际操作时应增加二分之一的最少检验数量作阳性对照用,即取供试品15支,挤出内容物,混匀。取混合样品10 g,置灭菌的分液漏斗中,加灭菌肉豆蔻酸异丙酯600 mL充分振摇,再加pH 6.0磷酸盐缓冲液300 mL,振摇,静置,取水层。再取混合样品5 g,置灭菌的分液漏斗中,加无菌肉豆蔻酸异丙酯300 mL充分振摇,再加pH 6.0磷酸盐缓冲液150 mL,振摇,静置,取水层。将两次萃取的水层合并,照1.2.2项操作。
2 结果与分析
2.1 薄膜过滤无菌检查方法的建立
2.1.1 萃取溶剂种类的筛选 pH 6.0磷酸盐缓冲液相对常规的无菌检查用溶剂0.1%蛋白胨溶液和pH 7.0氯化钠-蛋白胨缓冲液而言,明显减轻了乳化现象,实现了完全分离,提高了萃取效率(表2)。

表2 萃取溶剂种类的选择Tab 2 Selection of extraction solvent
2.1.2 萃取溶剂体积的选择 齐鲁与澳龙两家企业的产品黏度差异较大,齐鲁的样品较稀,澳龙的样品较粘稠。因此,在考察了齐鲁的样品的萃取效果后,将供试品换为澳龙的样品。采用上述萃取溶剂进行萃取,结果发现又出现了严重乳化现象。因此将萃取溶剂量进行了增大。采用600 mL肉豆蔻酸异丙酯与300 mL pH 6.0磷酸盐缓冲液,对上述2家企业的各10 g供试品进行萃取,均可完全分层(表3)。

表3 萃取溶剂体积的选择Tab 3 Selection of extraction solvent volume
2.1.3 萃取回收率的考察 萃取后每膜菌落数/每1 mL菌落数=(77+65)/(63+68)=108%,在50%~200%的范围内。说明萃取后样品中的菌均分配至水相,且pH 6.0磷酸盐缓冲液对菌的生长无抑制作用。
2.1.4 冲洗液体积的选择 结果见表4,该结果表明即便冲洗900 mL/膜仍不能消除阿莫西林对菌生长的抑制作用,需要加青霉素酶使阿莫西林降解以消除影响。
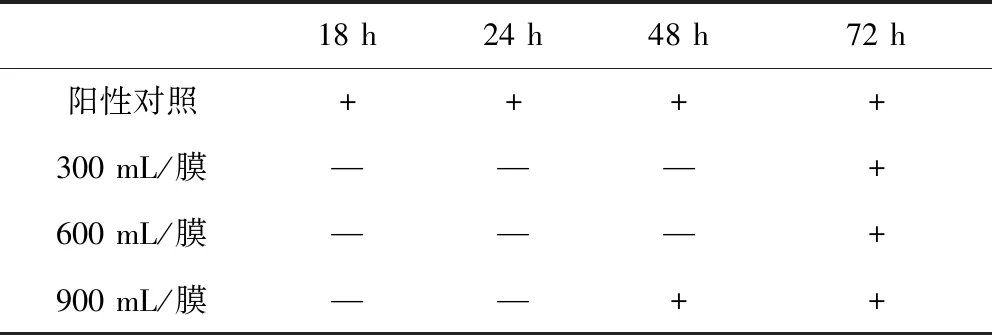
表4 冲洗液体积的选择Tab 4 Selection of flushing fluid volume
2.1.5 青霉素酶用量的选择 结果见表5,该结果表明,3000单位/膜是可消除阿莫西林抑菌作用的临界青霉素酶浓度。但考虑到不同品牌和种类的滤膜对阿莫西林的截留量存在差异,亦考虑到不同试验人员操作手法有所差异,拟采用青霉素酶的用量为3万单位/膜。
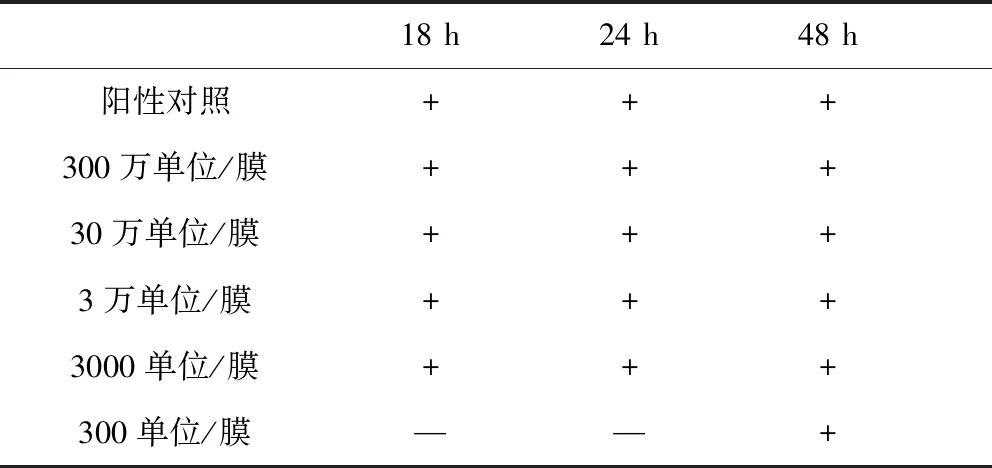
表5 青霉素酶用量的选择Tab 5 Selection of penicillin enzyme dosage
2.2 方法学验证
2.2.1 活菌计数 结果见表6,该结果表明,在各自对应稀释级别下,各检定菌株浓度均在50~100 cfu/mL范围,符合无菌检查阳性菌浓度要求。
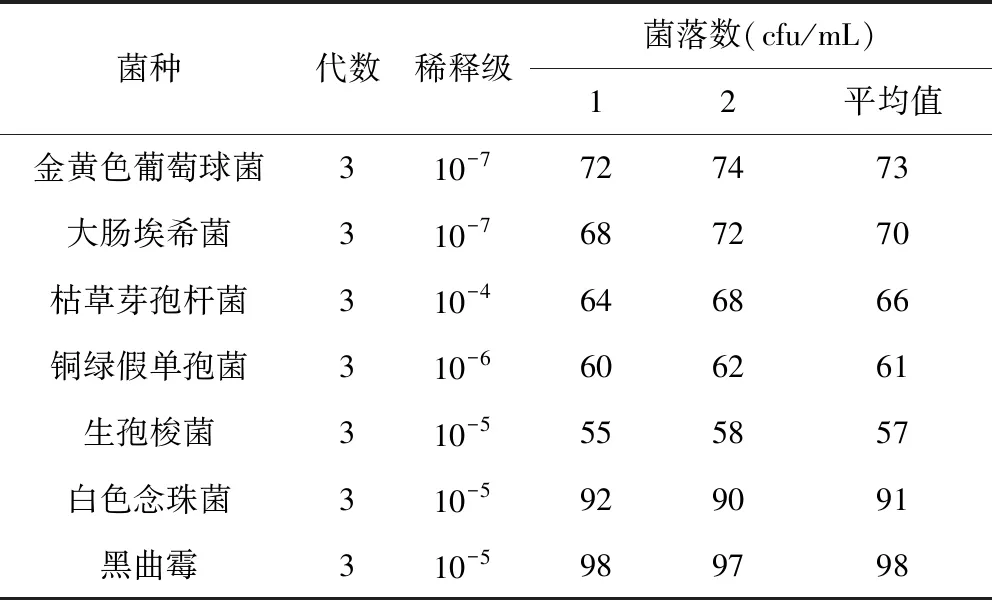
表6 活菌计数结果Tab 6 Results of living bacteria counts
2.2.2 培养基的灵敏度检查 各细菌检定菌株均在24 h内生长,各霉菌检定菌株均在48 h内生长,符合无菌检查用菌要求。
2.2.3 无菌检查方法适用性试验 薄膜过滤后,含供试品的阳性菌试验组试验菌均生长良好,供试品对菌生长没有影响。
2.3 供试品的无菌检查 4批供试品进行无菌检查后,阳性对照菌在24 h内生长良好,阴性对照14 d内均澄清,无菌生长,4批供试品14 d内均澄清,无菌生长,无菌检查结果均符合规定。
3 讨论与小结
3.1 薄膜过滤法与直接接种法的优劣性分析[9]在样品有抑菌作用干扰时,直接接种法由于难以排除样品干扰,仅可采用减少取样量的方法进行稀释,因此,样品取样量不可过大,无菌检查结果对整批样品的代表性降低;另外,对于油性基质的样品而言,与培养基混合后会形成混悬液,难以与阳性对照进行区分,结果判断困难,需进一步采用转种的方式进行次代培养,方可准确判断结果,但操作步骤增多又增大了污染的可能性;再者,直接接种法的所有操作均在开放性容器中进行,对人员操作和环境洁净度的要求较为严格。
薄膜过滤法由于可采用冲洗液将样品冲洗去除,取样量较直接接种法可有所增大,结果代表性增强;对于油性基质的样品,可选择采用聚山梨酯80等水油互溶性表面活性剂溶解后过滤,但如果采用上述手段仍无法使样品顺利过膜,可考虑破乳萃取水相的方式,但需注意选择适宜的萃取溶剂以避免乳化;另外,薄膜过滤法可采用全封闭式滤器,避免了外源性微生物的污染,操作更为简便;再者,薄膜过滤法的培养基避免了油相的干扰,结果易于观察。
对于本方法而言,萃取乳化严重的特殊情况导致即便采用薄膜过滤法亦无法较直接接种法[10]进一步增大取样量,但方法操作更为便捷,方法可靠性增强,结果判断准确性提高。
3.2 萃取用溶剂的选择分析 乳房注入剂用于奶牛乳房炎的治疗时,需向患病乳区灌注药物,药物在乳区局部留置,以充分发挥药效,基于药效设计的乳房注入剂多为油性基质的混悬液或乳膏状半固体[11]。但对于上述基质的样品而言,无菌的薄膜过滤法如将样品直接过膜往往会因为堵膜而无法进行。对现有乳房注入剂质量标准中无菌检查项方法进行了梳理,发现采用薄膜过滤法的方法大部分将样品进行了萃取,再取水相过膜。萃取用的油相溶剂多采用肉豆蔻酸异丙酯,萃取的水相溶剂多采用附录1101推荐的常用溶剂0.1%蛋白胨溶液或pH 7.0氯化钠-蛋白胨缓冲液。但本制剂采用上述常规溶剂萃取乳化现象严重,无法实现两相分离。分析认为乳化现象严重的原因是主药阿莫西林三水合物在pH中性的缓冲液中溶解性差,而酸性缓冲液中阿莫西林溶解度提高,可使乳化现象减轻。但酸性过强的缓冲液亦会对菌的生长产生影响,因此,尝试采用弱酸性的pH 6.0磷酸盐缓冲液作为萃取的水相溶剂,在解决乳化问题的同时亦避免了溶剂本身对菌的损伤。
本试验采用薄膜过滤法对复方阿莫西林乳房注入剂进行无菌检查。通过萃取溶剂的选择,解决了萃取乳化严重、萃取效率低的问题;通过增大萃取溶剂体积,实现了对不同生产企业制剂的通用性;通过萃取后过滤水相,解决了供试品直接过滤容易堵膜甚至因系统压力过高而崩裂滤器管路的问题;通过青霉素酶加入量的考察,选择适宜的酶加入量,在去除了供试品干扰作用的前提下,实现了试剂的节约。

