欧盟食品动物注射部位兽药残留指南概述
孙 雷,王亦琳,叶 妮,张 骊,王鹤佳
(中国兽医药品监察所,北京 100081)
欧盟注射部位残留指南最初于1994年作为注射部位残留评估原则的工作文件发布,2004年被旧版注射部位残留指南取代。2022年新发布指南与法规(EU)2019/6第4章中的新定义和术语进行了统一,增加了对注射部位残留参考值(ISRRV)的引用,参考的法规和其他科学指南也进行了更新。另外,该指南应与欧盟可食组织休药期制定指南(EMA/CVMP/SWP/735325/2012 Rev.2)[1]一起使用。本文详细介绍了欧盟食品动物注射部位兽药残留指南,对于我国制定兽用注射制剂的休药期具有较强的参考意义。
1 背 景
欧盟法规(EC)470/2009[2]规定拟用于食品动物的所有药理活性物质都应对消费者安全性进行评估,确定宰前休药期,以确保药物残留消除至允许浓度以下。每种兽药有其自身的肌肉最大残留限量(MRL)或注射部位残留参考值(ISRRV),因此每种兽药应分别制定自身的休药期,并作为上市许可的内容之一。
除了药物剂型、给药剂量和给药次数之外,休药期的长短很大程度上取决于给药途径。注射制剂在注射部位表现出的消除动力学速度明显慢于其他可食组织,主要是因为设计成缓释制剂或储库制剂,或药物本身或剂型的理化性质,或其他因素,如皮下给药、肌肉给药或肌肉之间的结缔组织给药。给药后出现的纤维化、包囊或坏死等组织反应是导致注射部位药物释放缓慢的另一个潜在因素。注射部位药物残留量相对较高,并且往往消除不规律不稳定,因此动物之间的差异有时很大。某些药物在给药部位的不均匀扩散可能导致药物残留的不均匀分布。与其他组织不同,注射部位样品的准确位置会对发现残留物有较大影响。另外,药物在注射部位的代谢和/或降解,引起注射部位残留物的总组成可能与其他组织大不相同。这一切表明,从药代动力学角度来看,注射部位可能无法与其他肌肉等可食组织直接比较。因此,通过远离注射部位的肌肉组织确定的休药期通常不足以确保注射部位药物残留消除至低于MRL和ADI或其他参考值。因此,需要特别考虑注射部位药物残留对消费者的潜在风险。
2 适用范围
该指南旨在评估食品动物肌肉注射和皮下注射时给药部位兽药残留对消费者的潜在风险,并详细阐述休药期的确定方法。风险管理方面,例如残留监控计划中注射部位的残留检测不在该指南的范围内。
申请人为建立休药期而进行的所有体内实验均应符合指令2010/63/EU[3]中动物保护的相关要求,以及替代、减少和优化的3R原则(EMA/CHMP/CVMP/JEG-3Rs/450091/2012[4];EMA/CHMP/CVMP/3Rs/164002/2016[5])。
3 法律依据
根据2018年12月11日欧洲议会和理事会关于兽药产品的条例(EU)2019/6(废除指令2001/82/EC[6])第10、11、14、16和35条要求,用于食品动物的兽药产品信息应包括休药期。委员会批准条例(EU)2021/805[7]中第II.3B和IIIa.3B提出了确定休药期所需的材料要求。
4 评价方法
基于法规470/2009(EC)和欧洲公开MRL评估报告(EPMAR)对药物进行的风险评估,注射部位的残留评估和休药期制定应基于MRL、注射部位残留参考值(ISRRV)、ADI或必要时的暴露限量。注射部位残留评估应遵循下面总的原则:
委员会条例 (EU) 2018/782确定了法规 (EC)470/2009[8]中提及的风险评估和风险管理建议制定的方法原则,取代欧盟药品管理规则第8卷[9]。
CVMP可食组织休药期制定指南(EMA/CVMP/SWP/735325/2012 Rev.2),取代之前的指南注释:休药期协调方法(EMEA/CVMP/036/95)[10]。
以及VICH指南:VICH GL 48确定休药期的残留消除实验[11],VICH GL49残留消除实验分析方法验证[12],VICH GL 57确定水产品休药期的残留消除实验[13]。
另外,根据该指南获得的注射部位休药期不一定是最终休药期,注射部位休药期应该与其他可食组织休药期进行比较,选择最长休药期作为产品最终监管用的休药期。在休药期时间点,所有可食组织中的药物残留量都应低于法规(EU)37/2010[14]规定的MRL,或低于ISSRV(适用时);如果没有MRL或ISSRV,可以选用其他参考值,如ADI或暴露限量。详见图1以及可食组织休药期制定指南(EMA/CVMP/SWP/735325/2012 Rev. 2)。
4.1 基于MRL的方法 对于有肌肉MRL的药物,注射部位通常被视为肌肉组织,残留评估应考虑肌肉MRL和残留标志物。休药期应确保注射位点的残留标志物浓度降至肌肉MRL以下,休药期的制定应符合可食组织休药期制定指南要求(EMA/CVMP/SWP/735325/2012 Rev. 2)。
大多数情况下,注射位点基于MRL的方法可以获得足够安全的休药期。但是,采用这种方法时应确保肌肉中的残留标志物对于预测注射部位的关注残留物也是有效的,如果肌肉的残留标志物不是注射部位残留物的组成部分(如肌肉中的代谢物不在注射部位出现),则可能认为不合适。换句话说,某些情况下基于MRL制定的休药期不一定能确保包括注射部位在内的标准食物篮中残留物的摄入量低于ADI。如果有任何迹象表明基于MRL的方法可能与ADI不一致,则需要进行基于ADI的评估,以确定计算休药期的合理性。
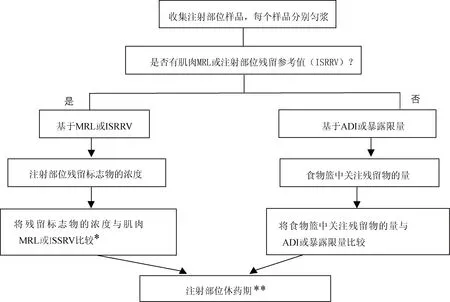
图1 注射部位的采样和检测以及基于MRL和ADI的休药期评估Fig 1 Sampling and detection of injection site and evaluation of withdrawal period based on MRL and ADI*在某些情况下,需要同时进行基于ADI的评估来检验基于MRL确定休药期的合理性,以确保食物篮中的残留物低于ADI;**根据可食组织休药期制定指南((EMA/CVMP/SWP/735325/2012 Rev. 2))计算休药期,另外,还必须根据其他组织的MRL计算各自休药期,最长休药期将被视为最适合监管用的休药期。
4.2 基于ISRRV的方法 对于注射部位残留消除采用肌肉MRL会延长休药期的药物,欧盟制定了注射部位残留参考值(ISRRV)。ISRRV的设置水平应确保在可能的休药期内,包括注射部位在内的300 g标准食物篮中药物残留量低于ADI。ISRRV并未在法规(EU)37/2010中公布,而是在欧盟公共MRL评估报告(EPMAR)中提供了该数值。例如:加米霉素在羊肉MRL为50 μg/kg,ISRRV为1500 μg/kg;泰拉霉素在猪肉MRL为800 μg/kg,牛肉MRL为300 μg/kg,ISRRV为6000 μg/kg。
使用基于ISRRV的方法计算休药期原则上和基于MRL的方法类似,通过比较残留数据和ISRRV进行推算。
4.3 基于ADI的方法 对于没有肌肉MRL或ISRRV的药物,注射部位药物残留评估的参考值通常是ADI。注射部位基于ADI的残留评估应包括药物所有相关的ADI终点(如必要时的药理学ADI、毒理学ADI和微生物ADI)。根据ADI的类型,关注的残留可能是与药物相关的总残留,也可能是总残留中的毒理学、药理学和/或微生物活性成分。
膳食结构中残留物的评估应基于包括注射部位在内的标准食物篮,注射部位应作为肌肉组织看待,300 g食物篮模型应体现注射部位的药物残留。基于ADI的方法进行休药期计算的过程如下:
1.确定每个时间点每只动物300 g注射部位的关注残留量以及其他可食组织中的关注残留量(必要时考虑残留标志物/关注残留的比值);
2.对于每个时间点的每只动物,确定标准食物篮中的残留总量,其中肌肉中的残留量由根据(1)推导出的注射部位残留量代替;
3.确定合适的ADI。
4.4 基于暴露限量的方法 该方法原则上适用于委员会条例(EU)37/2010附件表1中“无需制订MRL”的药物,这些药物尚未确定ADI,但当作为特定的注射制剂使用时,有可能在注射部位留下相对较高的残留量,且仍具有生物活性。常用的暴露限量有:建议的饮食上限(例如维生素)、可耐受的摄入量上限(例如矿物质/微量元素)、内源性化合物的天然碱含量或任何其他适当的限量。所选暴露限量的合理性以及评估方法都需要进行科学论证。
这类药物休药期的制定原则上和基于MRL、ISRRV或ADI的方法类似,通过将残留数据与暴露限量(通常指某一浓度(即类似于MRL或ISRRV方法)或残留量(即类似于ADI方法))进行比较来确定休药期。
5 残留研究
5.1 总体原则 注射制剂需要知道注射部位的药物残留情况。含有新活性成分的药物,通常要进行合理的实验给出药物相关的残留特征,包括具有潜在生物学意义的代谢物和降解/转化产物。这些信息通常在放射性残留消除研究中获得(即总残留物;关于放射性残留研究的一般指南,见VICH GL 46[15]),或适当情况下进行的旨在表征药理、毒理或微生物活性残留物成分的残留消除研究中获得。
注射部位已知残留物组成的产品,通常无需进行放射性残留消除研究,只需测定注射部位母体药物或其他任何相关的残留物组成即可(如适用时的残留标志物)。然后,可从已发表文献中获得评估关注残留物的相关支持性数据(如残留标志物与总残留的比值)。
肌肉注射或皮下注射的仿制药品,成分的微小差异就可能对注射部位的消除产生显著影响,标准的血药法生物等效性研究中可能无法检测到。因此,这类制剂除了证明生物等效性外,还应证明注射部位残留消除等效,以便采纳参比药品的休药期。但是,如果证明注射部位的消除较慢,导致休药期比参比药品的长,则应将此更长的休药期作为总的休药期。也可参见“生物等效性指南4.4部分”[16]。如果证明仿制药品在注射部位的消除更快,则仍采用参比药品较长的休药期,这是因为尚不清楚其他可食组织是否确定了休药期。
有肌肉MRL或ISRRV的药物,必须进行注射部位的残留标志物消除实验,证实注射部位的残留药物消除至MRL或ISRRV以下。如果注射制剂含有残留标志物特定的衍生物(如母体化合物的酯衍生物),对分析方法就要进行一些特殊处理(如净化、裂解/水解步骤等),以便确定注射部位残留标志物的准确浓度。
5.2 实验设计和采样 进行残留消除实验,应在兽医临床实践中常用作注射部位的部位给药,也应反映肉制品行业指南要求,避免造成注射部位组织损伤,不得在主要肉块给药。获得的实验数据必须能证实可能的最大残留量,因此必须按照预期的标签说明书中最大给药剂量给药。如果预期用途是多次给药,则应按照最多次数给药。实验动物应能代表靶动物的年龄和体重,整个实验过程都应按照正常的饲养水平进行管理。
残留消除实验还应包括可能的最大给药体积,如果药物预期用于所有年龄/体重动物,但只进行了低年龄/低体重的动物实验,使用较小体积药物,那么就不可能外推至使用最大体积药物的残留情况。建议仿制药品每个给药位点的最大给药体积应该和参比药品批准的最大给药体积一致,同时,还应考虑注射体积的适用性、动物福利和局部耐受性。
注射部位残留实验应将注射位点进行永久标记,以便宰杀动物时能够清晰定位和识别,给药时应在底层组织的中心给药,宰杀动物后立即对注射部位进行采样。注射部位的组织采样方法直接影响残留浓度,因此,采样方法在合理可行的范围内尽可能最佳:宰杀和采样程序的设计应确保将具有代表性的组织样品从残留浓度最大的区域切走。建议用下面所述的标准方法采集注射部位的初级样品(核心样品):
在动物大小允许的情况下,取大约500 g的组织进行匀浆。该样品应以注射位点为中心,并采用表1中给出近似尺寸的圆柱体形状。必须注意,应尽可能包含针头轨迹、药物释放区域和任何组织反应区域。如果有多个注射位点,采样应包括最后一次注射的部位,至少包括给药较多的注射部位。实验设计应确保最后的注射部位位于注射次数较多的身体一侧。

表1 注射部位残留采样Tab 1 Sampling of injection site residues
为确保上述采样方法足以代表残留物的浓度,建议可能的情况下,在每个注射部位采集并分析第二个约300 g的同心环形对照样品,该样品来自注射部位已经切走样品的周围(外围样品)。但是,不可能总是再采集到另外的300 g组织样品,特别是颈部注射时。如果实验需要,可以减少外围样品的重量,但是所收集的样品量应满足分析要求。
实际操作时无法采集准确重量的样品,采集样品的重量总在目标值附近变化。注射部位核心样品通常在400 g至600 g(500±20%)范围内被认为是可接受的。样品重量如果远低于此范围可能没包括注射位点相关的组织,通常被视为不具代表性(在缺乏明确和令人信服的相反证据情况下)。注射部位外围样品通常在240 g至360 g(300±20%)范围内。
根据VICH GL 48,质控样品的采样程序应确保所采样品能覆盖注射部位,这些个例采样方法需进行论证,同时考虑已有数据和制剂特点。除了使用外围样品,还可考虑使用以下方法,但所列方法并不全。
沿着注射轨迹和/或刺激部位收集椭圆形(或其他合适形状)样品, 应提供证据证明该方法针对注射部位,例如附上采样部位的照片。
根据从总放射性标志残留物研究(TRR)中获得的信息,提供注射部位残留物潜在的转移数据。如沿着注射轨迹和/或刺激部位采集一个圆形核心(或椭圆形)样品以及几个邻近样品进行TRR比较。如果该方法证明是一种合理的采样技术,那么在标志残留物消除研究中只需采集上述的初级样品即可。该研究中通常会建议增加一个额外的时间点(比休药期更长的时间点)。
根据靶动物安全性实验获得的信息(注射部位的病理检查),提供注射部位残留潜在的转移数据。
使用与有色染料混合的受试药品进行上述研究,以便目视评估注射部位残留物的潜在转移。
根据VICH GL 48,可以使用每只动物多个注射部位的概念:如果明确休药期是通过注射部位残留消除确定的,就可以选择每只动物两个注射部位来收集数据(并在确定休药期时使用这两个部位的数据)。这种做法可以减少动物数量,有利于动物福利。例如:仅单次注射给药的药品,可以第0天于颈部右侧给药,第4天于颈部左侧给药;第二次给药后第7天安乐处死动物,这样就可以提供停药7 d左侧注射部位)和11 d(右侧注射部位)的消除数据。但是,这种情况下,不能保证其他组织的采样和检测结果,因为违反了标签说明书规定用药(一次注射变为两次注射),就可能引起这些组织中的药物残留过度升高。这种给药方案是专门为通过注射部位残留消除确定最终休药期而设计的。
注射部位的核心样品和外围样品在残留检测之前,应将整块进行彻底匀质,以避免分析不均匀的样品。休药期评估时,核心样品和外围样品的检测结果都应进行考虑。如果外围样品的残留量高于核心样品,除非提供可接受的理由,否则该点不应参与统计计算。
除了法规(EU)2018/782要求的一般数据外,注射部位的残留实验还应附有与药物注射解剖学部位选择、所用注射技术和设备、注射深度(肌肉注射时)、宰杀时准确定位和识别采取的措施、采样和样品制备等全面详细的实验设计和实验条件,还应提供专家对所选采样方法的研判。
6 相关定义
该指南重点对注射部位、通用术语(ADI、MRL和休药期)、特定暴露和残留相关术语(标准食物篮、可食部分(注射部位)、残留标志物、总残留、毒理学关注残留、药理学关注残留和微生物学关注残留)进行了详细定义。对于注射制剂,注射部位可食部分包括在300 g食物篮中;基于ADI的休药期评价方法就是用300 g注射部位肌肉替代常规的肌肉。
7 结束语
对食品动物注射部位进行兽药残留消除研究,制定科学合理的休药期,为养殖过程中保障动物性食品质量安全具有十分重要意义。欧盟对注射制剂在食品动物注射部位的兽药残留研究方法对我国制定兽用注射制剂的休药期具有较强的参考意义。

