新版兽药GMP检查常见问题分析及改进建议
杨志昆,王艳玲,章安源,李有志,尹伶灵,门晓冬,冯 涛,陈志强,陈 玲*
(1.山东省饲料兽药质量检验中心,济南 250022; 2.青岛蔚蓝生物股份有限公司,山东青岛 266000)
《兽药生产质量管理规范》是我国《兽药管理条例》明确规定的管理制度和技术标准。依据农业农村部令2020年第3号、农办牧〔2020〕34号文有关要求,《兽药生产质量管理规范(2020年修订)、《兽药生产质量管理规范检查验收评定标准(2020年修订)》于2020年6月1日起正式执行。笔者对山东省已验收企业生产线、缺陷项目进行归纳总结,以期为兽药生产企业全面地实施GMP工作提供一些借鉴和参考,提高兽药产业竞争力,适应国家产业发展规划、满足日益发展的现代畜牧业需求[1]。
1 总体验收基本情况
截止到2022年9月下旬,山东省通过新版兽药GMP验收企业227家,以中小型企业为主,分布于潍坊、济南、青岛、济宁、德州等15个地市。目前潍坊市通过新版兽药GMP验收企业63家,约占全省三分之一。全省已通过验收生物制品生产企业17家,原料药生产企业18家(非无菌原料),占比分别为7.5%,7.9%。无菌原料药生产企业1家,无菌兽药生产企业53家,占比23.3%,中兽药生产企业112家,占比49.3%(部分企业同时存在化药、中药生产线)。新版兽药GMP对兽用生物制品和无菌兽药厂房建设、设施要求高,故无菌兽药与生物制品占比例份额较低。总体来看我省兽药行业在产业结构、管理水平、科技创新、质量效益等方面与发达国家相比还有较大差距。近几年山东兽药企业按照《山东省“十四五”中兽医药创新发展行动计划》,中兽药产值年增幅高于兽药产值整体增幅5个左右百分点,中兽药产业的高质量发展结合养殖环节兽用抗菌药使用减量化行动,必将促进绿色畜牧业发展。
148家企业是复验+改扩建(占比65.2%);其次迁址重建22家,占比9.7%;复验19家,占比8.4%;新建16家,占比7.0%;企业变更9家,占比4.0%;原址复验+异地扩建 6家,占比2.6%;原地改扩建7家,占比3.1%(见图1)。

图1 企业验收类型Fig 1 Accepted enterprise category
整理现场验收报告发现有关键项累计300项,一般检查项目不符合项共900项目,缺陷项目涉及验收评定标准11个章节。出现频次较高的集中在文件管理、质量控制与质量保证、确认与验证、机构与人员、设备等章节。分布详见表1。
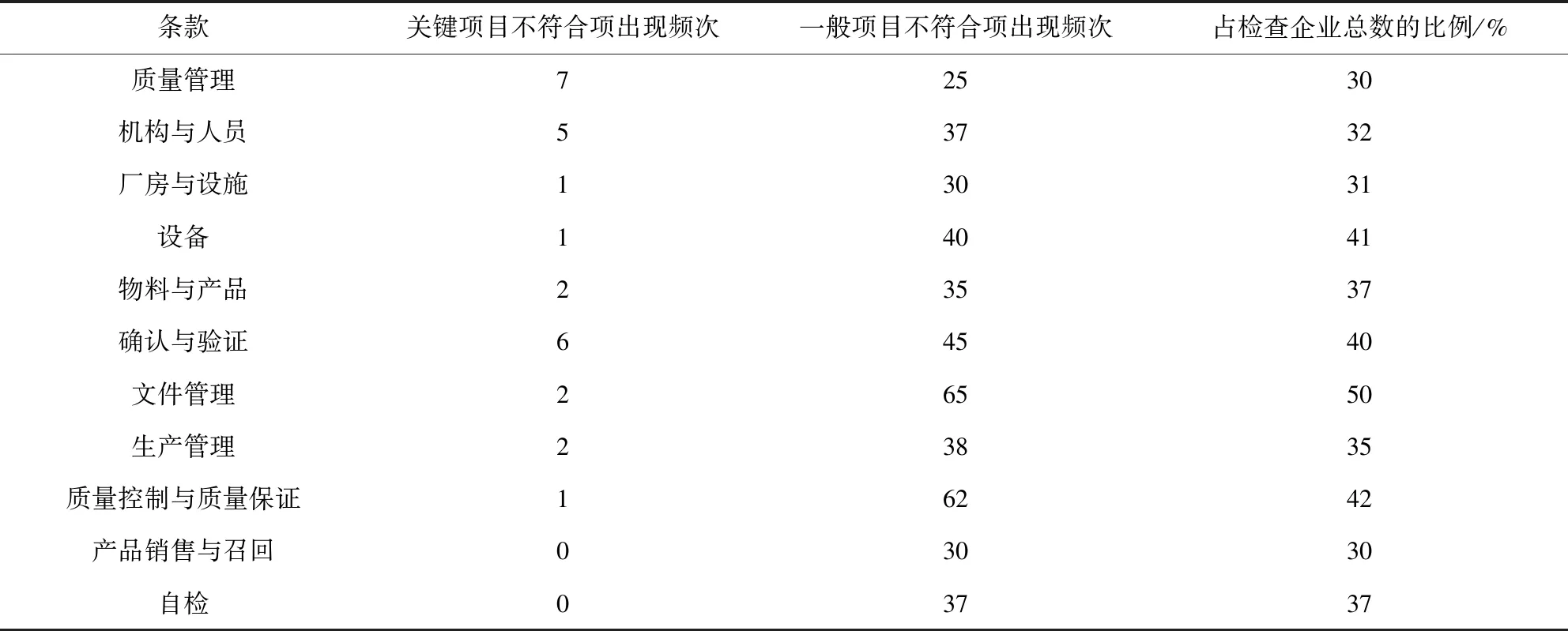
表1 缺陷项目在新版GMP评定标准分布情况(n=100)Tab 1 Distribution of defective items in the new version of GMP assessment standard(n=100)
2 存在的主要问题
2.1 质量管理 企业质量目标设定不具体,没有贯彻到兽药生产、控制及产品放行、贮存、销售全过程;质量手册规定对不同层次人员所承担的职责与实际不符;对于多品种共线存在的质量风险,风险评估内容未体现识别、评估、控制等要求,缺少预先危害分析概念。
2.2 机构与人员 培训实际效果未达到要求。个人技术档案关于中药材和中药饮片质量管理人员相应岗位职责、技能的培训内容较少。取样人员缺少授权等文件记录。
2.3 厂房与设施 厂房、生产设施和设备多产品共用的可行性评估报告内容不全面,部分企业对于洁净度级别和空气净化系统有要求的车间悬浮粒子、微生物取样点的位置与确认的结果及风险评估不一致;与无菌兽药直接接触的压缩空气和惰性气体未定期对除菌过滤器和呼吸过滤器完整性进行检查。
部分企业粉剂车间混合间和分装间除尘装置达不到生产要求,企业杀虫剂车间配液间缺少排风设施。
2.4 设备 部分企业化验室用于稳定性试验设备数量不足,注射剂车间配液罐数显液位计的计量方式不符合要求。
有些企业制药用水的微生物污染控制达不到要求。A/B级区内消毒剂和清洁剂配制用水清洁没有及时记录。部分企业纯化水及饮用水实际操作记录与监测规程不一致;发现纯化水系统达到警戒限度、纠偏限度时,未能及时按照操作规程处理。
2.5 物料与产品 发现有些生产企业无菌瓶包装材料不符合要求,免洗口服洁净瓶物料供应商评估内容缺少对洁净瓶微生物限度等检测内容。
部分企业未建立返工、重新加工管理制度,返工操作规程未对相关风险评估做出规定。
2.6 确认与验证 有些企业关键设备如灌装系统清洁验证检验方法未经过确认,无法证实其清洁的效果,以有效防止污染和交叉污染。
部分企业确认或验证实施的整个过程与方案不一致,如验证结果与评判标准不一致、产品工艺验证内容与《2020年版中国兽药典》规定检测内容不一致。
2.7 文件管理
企业文件管理没有执行GMP新规范要求。部分企业原版空白的批生产记录复制和发放没有记录;工艺规程未制定收率限度范围;中药提取收率变更理由不充分。
部分企业生产中记录数据不完整,没有及时填写。注射液工艺规程中安瓿瓶清洗、灭菌的间隔时间控制标准没有及时记录;批包装记录理论产量与收率存在偏差,没有详细说明或调查。包材收率与工艺规程规定不符合。
2.8 生产管理 部分企业非最终灭菌产品批生产记录中缺少悬浮粒子等环境监测记录;可溶性粉工艺规程未对关键辅料的水分、粒度进行质量控制要求;中药提取回收后的乙醇未按内控质量标准检验。
2.9 质量控制与质量保证 部分企业缺少电子读码机功能检查的操作规程,实验室常规留样和稳定性考察留样未分区管理;原料药、成品留样规程内容不符合要求。
部分企业变更手续不全,产品工艺变更实施记录内容不完整;没有定期对所出现的偏差进行回顾分析,趋势分析。
质量管理部门未指定专人负责供应商质量评估和现场质量考查,质量管理部门批准的合格供应商名单缺少药品规格、质量标准等信息;产品回顾分析报告评估内容不全。
2.10 产品销售与召回 有些企业产品召回操作规程未规定具体管理人员,缺少召回产品应单独妥善储存的有关规定,模拟召回报告缺少评价标准。
2.11 自检 部分企业自检报告内容不全,缺少评价、纠正和预防措施等内容。
3 缺陷项主要问题分析
通过检查对兽药企业存在的缺陷进行汇总,发现企业基本建立了质量控制和质量保证的管理框架,但在细节设置和执行方面没有将新版GMP各项条款落到实处,部分企业质量管理体系缺乏有效实施和持续不断改进。质量管理体系应充分考虑到药品生产各个环节可能出现的风险,及时发现影响药品质量的风险点。
3.1 质量风险意识淡薄 机构与人员、确认与验证、质量控制与质量保证、生产管理和文件管理等章节的缺陷项目均与产品质量密切相关,有较高的质量风险[2]。人是药品生产过程中药品质量的主宰者,人员素质是影响 GMP实施的重要因素[3]。药品生产企业作为药品质量的责任主体,没有将风险管理的理念贯穿在产品整个生命周期内,由于部分企业人员流动性大,缺少技术人员的贮备和梯队建设,全员并没有完全参与质量管理[4]。
3.2 确认与验证不规范 部分企业对GMP设备的要求理解不够深入,人为因素造成缺陷占多数。设备设施管理不仅要求定期维护和保养,应定期进行确认或验证,确保设施设备始终处于正常状态,能生产达到预期质量的产品[5]。部分企业对检定校准工作认识不足,未依照校验需求和标准对校验结果进行有效确认,企业未对证书的校准参数进行确认,例如,高温室箱式电阻炉检定温度(950 ℃)与日常使用温度(500~600 ℃)不相符。企业没有根据产品的关键生产工艺和不同产品特点开展风险评估,来确定确认或验证的范围和程度[6-7]。验证的盲目性或应对性,选择验证项目和控制参数脱离企业的实际[8]。
3.3 文件管理认识表浅 文件是整个质量管理体系的基础和指导,记录没有真实反映生产过程中各工序工艺参数和流转物料数量的变化。企业应定期审核文件,确认相关文件的一致性、有效性。确认文件是否是现行文件,避免过期文件出现在生产现场和使用者手里。失效或过时文件也应编制文件目录进行收回管理。
3.4 自检工作流于形式 部分企业自检报告对发现问题未启动偏差处理及纠正预防措施。关键人员对于生产或检验过程中发生的,可能影响产品质量的异常情况,如偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等情况没有有效地识别偏差;还有可能的原因是企业不愿增加额外成本和负担。产品质量偏差得不到纠正,类似的偏差会再次发生[9]。企业在实际生产中,不明确各种原辅料的平均损耗率、最低与最大允许损耗率。自检中若发现超过最大允许损耗率,产品的收率太低,可能是产品的装量超标或生产过程中有缺损。若损耗率过低,产品的收率太高,则可能是装量偏少或原辅料的投料量不准确。产品的收率无论是高是低,都必须查明原因,及时整改[10]。
4 改进建议
4.1 提高质量控制和质量保证系统的完整性和执行性 企业应建立严谨的质量控制实验室管理系统,确保检验数据真实可靠、可追溯[11]。只有质量保证体系不断完善,药品质量管理体系才能保证有效运行。应对上市产品进行持续稳定性考察,监控其整个生命周期的质量变化;应对所发生的变更进行评估;任何偏差都应有恰当的处理过程,制定纠正预防措施,评估措施的有效性。应按期对产品进行质量回顾分析,及时收集和处理质量投诉和不良反应;并且根据投诉、召回、偏差、自检或趋势分析结果不断完善质量控制和质量保证系统。
4.2 制订有针对性的年度培训计划 当出现工艺变更、设备更新、相关政策出台或更新等情况时及时对员工进行培训[12],根据岗位特点选择内容,针对产品生产中的薄弱环节如变更管理、风险评估等内容有效培训。除笔试评估培训效果外,可增加实操培训;质量检验人员积极参加能力验证,提升检验能力。
4.3 规范各项软件内容,建立良好GMP管理文件内容 文件管理几乎关系到GMP的各个方面。应建立有效的文件管理流程,从软件上为产品质量提供保证,发挥其指导性和可操作性作用。记录文件设计应科学合理,任何行动有据可查。批记录应依据工艺规程、质量标准、现有批量的工艺验证以及其他相关文件而制定[13-14]。开展文件的变更控制,所有受变更影响的文件都应该按实际情况进行评估和修订,并适时地进行控制。
5 结束语
新版兽药GMP实施将有效遏制低水平重复建设,提升整个行业的生产管理水平,促进兽药产业转型升级,同时也更好地保障动物源食品安全和公共卫生安全[15]。但是,检查验收时也发现一些问题有主观上的原因,也有客观的因素,有待监督管理部门、生产企业及检查员们在今后工作中的共同努力完成。新版兽药GMP实施必将加速我国兽药企业与国际市场全面接轨,有利于我国兽药行业早日走向国际市场。

