犬细小病毒VHH抗体的文库构建、表达及其鉴定
冯倩倩,王召阳,袁维峰,姜一曈,庞忠宝,朱鸿飞,贾 红*
(1. 中国农业科学院北京畜牧兽医研究所,北京 100193;2. 华南农业大学兽医学院,广州 510630)
犬细小病毒(Canine parvovirus,CPV)是细小病毒科细小病毒属中的一种无囊膜单链DNA病毒。病毒的直径为21~24 nm,基因组大小约为5.2 kb,且含有2个开放阅读框(ORF),分别编码结构蛋白(VP1和VP2)和非结构蛋白(NS1和NS2)[1]。虽然CPV是一种DNA病毒,但其呈现出非常高的变异速率,可达到约10-4个位点/年,与RNA病毒的变异速率相似,从而出现快速和持续的抗原进化和变异[2]。CPV-2a、CPV-2b和CPV-2c是犬细小病毒的三种主要的亚型。1980年初,CPV-2a被认为是在狗身上发现的主要细小病毒[3-4]。1984年,新亚型CPV-2b首次在美国出现,然后在世界范围内传播,可在犬、猫和野生食肉动物中引起严重的胃肠炎和心肌炎[5-6]。CPV-2c是该病毒的第三种变种,并于2000年在意大利首次被发现,并迅速地传播到欧洲、美洲、亚洲和澳大利亚[7-8]。据报道,CPV-2c已成为引发全球犬类细小病毒病的主要变种。CPV-2亚型之间的主要抗原差异是VP2表位A中426残基的关键氨基酸差异;其中,CPV-2a中的残基为天冬酰胺,CPV-2b中的残基为天冬氨酸,CPV-2c中的残基为谷氨酸[9-11]。
CPV的生命力较为顽强,可在4~10 ℃生存半年,37 ℃存活14 d,56 ℃存活24~36 h,60 ℃可以存活1 h,在粪便中可存活数月乃至数年,仍可引发感染[12-13]。此外,CPV的传染能力强,所有犬科动物在各年龄阶段均可感染,但1~6月龄的犬只感染率最高[14]。犬细小病毒病在临床上主要表现为肠炎型、心肌炎型和混合型[14]。肠炎型多发生在 2~6月龄小犬,表型症状为嗜睡,没有食欲,精神沉郁,呕吐和腹泻,死亡比例非常高。心肌炎型常见于4~6 周龄的幼犬,无明显病症,发病急死亡快,致死率为60%~100%。给易感动物接种疫苗,诱导产生特异性的抵抗力是预防该病的主要手段。但目前存在的疫苗也存在一些缺陷,如弱毒疫苗存在毒株变异和毒力返强的风险,可能存在母源抗体的影响导致免疫失败。因此,仍有很多幼犬感染CPV,抗体治疗是治疗该病的首选。目前抗体主要为鼠源抗体,存在免疫排斥反应等问题[15-16]。纳米抗体是一种重组抗体片段,大小约为 15 kD,是驼科中的重链抗体的可变区,又称重链单域抗体(Single variable domain on a heavy chain antibodies,VHH抗体)[17]。其具有体积小、结构简单、易表达、稳定性高、特异性强和可穿透血脑屏障等优点。因此,本研究希望通过噬菌体展示技术构建CPV的纳米抗体免疫文库,并通过重组表达获得具有高亲和力和特异性的抗CPV纳米抗体,有望开发出可用于CPV的临床诊断和治疗的纳米抗体新型制剂,为纳米抗体应用于兽用生物制品领域提供一定的指导。
1 材料与方法
1.1 材料 CPV-2c(TS02株F12代)为实验室分离及保存;猫肾细胞(CRFK、F86代)为实验室保存;健康羊驼(24月龄、雄性)及pComb3x载体购自艾柏森(江苏)生物科技有限公司;TG1感受态细胞购自北京博迈德基因技术有限公司;DH5α感受态购自南京诺唯赞生物技术有限公司;淋巴细胞分离液购自上海源叶生物科技有限公司;PrimeScript 1 st Strand cDNA Synthesis Kit 购自Takara公司;Avidin-HRP 购自Thermo公司;Mouse Monoclonal [B62-FE2] to M13 (HRP)和Goat Anti-Alpaca IgG H & L (HRP)购自Abcam公司;T4 DNA Ligase购自NEB公司;Ni-亲和纯化磁珠购自江苏千纯生物科技有限公司。
1.2 犬细小病毒纳米抗体文库的构建及特异性筛选
1.2.2 血清抗体水平的测定 分别于三免和四免后两周分别采集免疫羊驼的外周全血,离心分离血清,通过ELISA的方法检测CPV抗体效价。样品OD450nm值/阴性对照OD450nm值(P/N)>2.1则为阳性,吸光值达到阳性标准的最高稀释倍数作为血清的抗体效价。
1.2.3 VHH基因的扩增 于四免后第14天采集30 mL免疫羊驼外周血,按照淋巴细胞分离试剂盒说明书分离淋巴细胞,采用Trizol提取RNA,反转录成cDNA。根据杨艳丽等[18]方法设计两轮PCR引物,在第二轮引物中引入SfiⅠ酶切位点,引物序列见表1。扩增产物利用1%琼脂糖凝胶电泳进行鉴定及回收。
表1 巢式PCR引物Tab 1 Primer sequence for nested PCR
1.2.4 M13噬菌体抗体文库的构建 用SfiⅠ酶分别对回收的第二轮PCR产物和pComb3x载体进行酶切,酶切产物经琼脂糖凝胶鉴定后回收,用T4 DNA连接酶连接酶切后的VHH基因片段与pComb3x载体,连接产物通过电转导入TG1感受态细胞。将平板上长出的所有菌落收集至5 mL LB培养基中,再加入5 mL含有40%甘油的LB培养基,即为抗CPV纳米抗体的初始抗体库,分装后于-80 ℃保存。
1.2.5 VHH抗体库的扩增和拯救 取初始库菌液100 μL,加入100 mL LB(Amp+)培养基中,37 ℃振荡培养4~6 h,使菌液的OD600nm值达到0.6~0.8。加入辅助噬菌体M13K07,按照感染复数(MOI)= 20 ∶1量添加,37 ℃静置30 min后,再经37 ℃、180 r/min振荡培养30 min。将上述菌液在室温条件下5000 r/min离心10 min,弃上清。用200 mL LB(Amp+、Kan+)培养基重悬菌液,并置于30 ℃、200 r/min振荡培养过夜。将上述培养液经4 ℃、8000 r/min离心20 min,收集上清液至干净无菌的玻璃三角瓶内,缓慢向其中加入1/5体积的5×PEG/NaCl溶液,4 ℃静置5 h。然后在4 ℃、8000 r/min离心30 min,弃上清后,用2 mL PBS重悬沉淀,混匀后,再经8000 r/min离心2 min,弃去沉淀,于上清中按照1∶1添加40%甘油,分装至无菌EP管中,-20 ℃保存,此为CPV特异性重组噬菌体库。
1.2.6 CPV特异性重组噬菌体的淘选和富集 用纯化的CPV作为目标抗原包被ELISA板,对拯救的CPV特异性重组噬菌体库进行3轮淘选,以筛选出亲和力更高的CPV特异性重组噬菌体。第一轮淘选、第二轮淘选和第三轮淘选所用的纯化的CPV浓度分别为100 μg/mL、10 μg/mL和1 μg/mL。取拯救出的重组噬菌体库1 mL,加入9 mL PBSM进行稀释。加入酶标板中,100 μL/孔,37 ℃、80 r/min振荡反应30 min,再37 ℃静置2 h。弃去孔内的液体,用PBST清洗5次。初次侵染:每孔加入100 μL培养到对数生长期的TG1菌液,37 ℃孵育20 min,收集菌液。每孔加入200 μL洗脱液(200 mmol/L甘氨酸、pH2.2),置于微量振荡器上轻微振荡10 min。将孔内的洗脱液吸出,迅速加入1 mol/L Tris缓冲液(pH9.0)调节pH至7.4,以恢复噬菌体的侵染能力。再次侵染扩增:将上述洗脱液中加入到5 mL培养至对数生长期的TG1菌液中,再与初次侵染的菌液混合,37 ℃静置2 h。加入100 mL LB(Amp+)培养基中,37 ℃振荡培养4~6 h,使菌液OD600nm达到0.6~0.8。加入辅助噬菌体M13K07,进行拯救。拯救后的上清液即为第一轮淘选获得的重组噬菌体库扩增液,部分保存后其余进行下一轮淘选,第二、三轮淘选步骤与第一轮相同。
1.2.7 噬菌体单克隆检测 取100 μL第三次淘选时2次侵染的混合液,倍比稀释后涂于固体LB(Amp+)培养基平板上,37 ℃倒置培养过夜。平板上随机挑选96个单菌落,37 ℃、200 r/min振荡培养过夜,然后加入辅助噬菌体M13K07,制备噬菌体单克隆。以获得噬菌体的单克隆作为一抗进行ELISA检测。用包被缓冲液将纯化的CPV稀释至1 μg/mL包被酶标板。二抗为100 μL 1000倍稀释的HRP标记的鼠抗M13抗体。洗涤后,加入TMB显色,100 μL/孔,孵育15 min,最后加入50 μL H2SO4终止反应,读取OD450nm值。
解析:n(CO2)∶n(NaOH)=0.8∶1=4∶5,处在1∶2到1∶1之间,属于恰好完全反应的区间,生成的产物既有Na2CO3,也有NaHCO3,我们就可以依据钠守恒和碳守恒建立两个方程:
1.3 犬细小纳米抗体的表达与鉴定
1.3.1 VHH重组表达载体的构建 根据淘选出的4株噬菌体的序列,设计合成带有XmaⅠ和XhoⅠ酶切位点的通用引物,同时在抗体序列N端添加6×His标签序列,引物序列见表2。对4株噬菌体进行目的基因扩增。将4条VHH目的基因及pcDNA3.1载体依次通过酶切、连接、转化、PCR鉴定及菌液测序。筛选出序列连接正确且无突变的菌株,提取重组表达载体质粒DNA。

表2 VHH特异性扩增引物Tab 2 VHH Sequence specific amplification primers
1.3.2 VHH在HEK293F中的表达及纯化与鉴定复苏HEK293F细胞,37 ℃和5% CO2培养,当细胞状态稳定且存活率大于98%时进行转染。转染时将表达EGFP质粒设为对照,以检测转染效率。转染结束后收集培养基,取少量样品用SDS-PAGE电泳检测目的蛋白表达情况。然后,利用Ni-磁珠对目的蛋白进行亲和纯化,纯化后的抗体蛋白经SDS-PAGE电泳、间接ELISA及间接免疫荧光(IFA)进行鉴定。ELISA具体过程如下:使用纯化的CPV作为包被原,包被浓度为10 μg/mL,100 μL/孔,4 ℃包被过夜,PBST洗涤5次,每次3 min;采用1%BSA进行封闭,100 μL/孔,37 ℃封闭2 h,PBST洗涤5次,每次3 min。用1% BSA-PBS稀释纯化后的纳米抗体 (稀释倍数分别为1∶10、 1∶100、 1∶1000和1∶10000),100 μL/孔,37 ℃反应1 h,PBST洗涤5次,每次3 min。二抗为1∶3000稀释抗His-HRP抗体,37 ℃反应1 h,PBST洗涤5次,每次3 min。结束后采用KPL SureBlue TMB显色液进行显色,实验组OD450nm值与对照组OD450nm比值(P/N)大于2.1判断为阳性。IFA具体过程如下:将CPV-2c毒种稀释20倍,接种已长满单层CRFK细胞的48孔板,100 μL/孔,37 ℃、5% CO2条件下培养72 h后弃去培养液,用无水乙醇固定,100 μL/孔,4 ℃过夜;PBST洗涤3次后每孔加入400 μL PBSTM,37 ℃封闭1 h,再用PBST洗3次。用PBSTM将纯化后的纳米抗体稀释10倍,分别加入到细胞板中,100 μL/孔,同时设立二抗对照及空白细胞对照,37 ℃孵育1 h后用PBST洗5次。加入1000倍稀释的抗His-FITC抗体作为二抗,100 μL/孔,空白细胞对照孔不加二抗,37 ℃避光孵育1 h,洗涤5次后每孔内加入200 μL PBST保持湿润,于荧光显微镜下观察实验结果。
1.3.3 病毒中和抗体检测 CPV中和实验操作如下。(1)纳米抗体的稀释:将纯化后的重组表达纳米抗体分别用DMEM稀释5倍,经0.22 μm针式滤器过滤除菌后加入96孔细胞板的第一排,每孔100 μL,继续进行2倍(100 μL+100 μL)系列稀释至1∶640,每个稀释度做3个重复,同时设立病毒对照和未接毒的正常细胞对照孔。(2)病毒稀释:将CPV-2c细胞毒(F15代,106.5TCID50/mL)用DMEM稀释30000倍(每100 μL约含100个TCID50),加入已稀释好抗体的细胞孔中,100 μL/孔。将上述稀释好的病毒液继续进行10倍系列稀释至10-1、10-2、10-3,分别含10 TCID50、1 TCID50和0.1 TCID50,作为病毒回归实验加入不含抗体的细胞孔内,每孔100 μL,每个稀释度加5个孔。(3)中和:将上述细胞板振荡混匀10 s后置于37 ℃孵育1 h,每半小时混匀一次。(4)加细胞:将消化好的细胞悬液(含15%FBS)加入中和后的细胞孔中,每孔60 μL。(5)观察CPE:将细胞板置于37 ℃含5% CO2的培养箱中培养7 d,观察细胞病变情况。
2 结果与分析
2.1 ELISA检测免疫后抗体水平 本试验用ELISA法分别测定三免和四免后第14天外周血中的CPV抗体水平。结果如图1所示,三免及四免后血清效价均可以达到1∶25000,满足了免疫抗体库的制备要求。

图1 ELISA检测血清抗体效价Fig 1 Detection of serum antibody titer by ELISA
2.2 VHH基因PCR扩增结果 四免后外周血淋巴细胞的RNA提取结果见图2,有明显的28S和18S条带(图2A),表明RNA质量良好,可以用于VHH序列的扩增。RNA经过反转录后,用第一轮PCR引物扩增产物可见600 bp和900 bp处有的两条带(图2B),以此为模板第二轮扩增后产物在400 bp有明显条带(图2C),符合VHH片段的预期大小。

A:RNA;B:First round PCR products;C:Second round PCR products图2 VHH基因PCR扩增结果。Fig 2 PCR amplification results of VHH gene.
2.3 初始抗体库的库容与阳性率 取初始抗体文库菌液10 μL,稀释1000倍后取200 μL涂布LB(Amp+)平板,计数平板上的菌落数约为4000个,计算得出初始抗体库的库容约为2.0×106CFU/mL,符合免疫文库的库容预期,可以用于特异性噬菌体的淘选。从平板中随机挑取48个单菌落,进行菌液PCR鉴定,PCR产物的凝胶电泳结果见图3,其中阳性样品43个,阴性样品5个,阳性率约为89.6%。
M:2K DNA Marker;1~48:PCR products of randomly picked colonies图3 菌液PCR结果Fig 3 The PCR results of picked single colony
2.5 初始抗体库的多样性 通过DNAMAN软件对20个阳性单克隆的氨基酸序列进行比对分析,结果如图4所示,20条VHH基因的同源性为78.9%,CDR3区的差异较大,表明初始文库中重链可变区基因的多样性较好。通过MEGA软件绘制序列的遗传进化树,如图5所示,各序列之间同源性差异较大,进一步说明初始文库的多样性较好,可以用于特异性噬菌体的筛选。
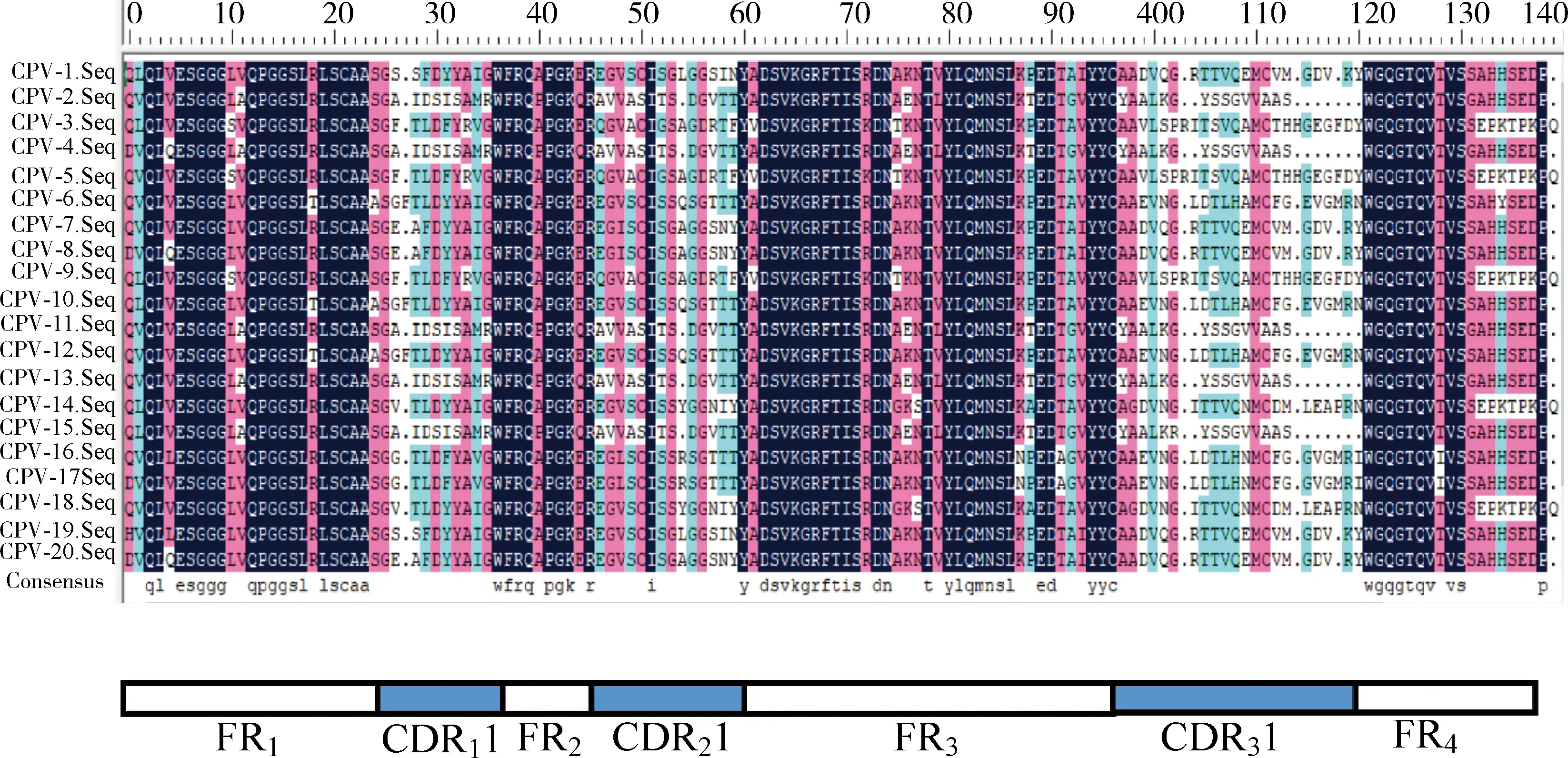
图4 氨基酸序列的比对分析Fig 4 Alignment analysis of amino acid sequences

图5 序列的进化树分析Fig 5 Phylogenetic analysis of sequences
2.6 噬菌体单克隆检测及测序结果 ELISA检测结果如图6所示,96个单克隆中有59个为CPV特异性的阳性克隆,占比为61.5%,P/N值最高可以达到22,结果表明,经过三轮淘选后可以与CPV特异性结合的高亲和力重组噬菌体得到了有效的富集。

图6 CPV特异性重组噬菌体的ELISA检测Fig 6 The ELISA result of detection of CPV specific recombinant phage
2.7 单克隆测序 将ELISA筛选中P/N值较高的前12株单克隆菌液送基因公司测序,对测序结果进行比对分析,并绘制系统进化树(图7),从中挑选出4条差异最大的序列进行VHH的表达及鉴定,分别是CPV-VHH-H1、CPV-VHH-D4、CPV-VHH-F5和CPV-VHH-E3。

图7 CPV序列的进化树分析Fig 7 Phylogenetic analysis of sequences
2.8 重组表达载体的PCR鉴定 将4条VHH目的基因与pcDNA3.1的连接产物转化, 每个平板挑取12个菌落进行PCR扩增鉴定,PCR产物进行1%琼脂糖凝胶电泳分析,结果显示,重组载体PCR产物大小约为400 bp(图8),与预期大小相符。对阳性菌落进行测序鉴定,挑选序列连接正确且无突变的菌株。

M:2K DNA Marker;1~12:pcDNA3.1-VHH-H1;13~24:pcDNA3.1-VHH-E3;25~36:pcDNA3.1-VHH-D4;37~48:pcDNA3.1-VHH-F5图8 pcDNA3.1-VHH重组表达载体的PCR鉴定Fig 8 PCR identification of pcDNA3.1-VHH recombinant expression vectors
2.9 纳米抗体的表达及纯化 将提取的阳性质粒转染HEK293F细胞,转染后第二天通过荧光显微镜观察转染效果,结果显示EGFP质粒转染对照组有明显荧光,表明质粒转染成功。转染后第7天收获细胞上清,经SDS-PAGE电泳检测,EGFP对照质粒转染组可见大小约30 kD的对照EGFP蛋白条带,CPV-VHH-H1、CPV-VHH-D4、CPV-VHH-F5和CPV-VHH-E3转染细胞组可见大小约14 kD的目的蛋白条带(图9)。收集细胞培养上清,参照Ni-磁珠试剂盒说明书进行亲和纯化,纯化后的样品可见明显VHH目的条带(图10),大小约14 kD,蛋白纯度大于90%,对照蛋白并没有被Ni-磁珠富集,结果符合预期。

M:Protein Marker;H1~F5:Supernatant of CPV-VHH-H1~F5;EGFP:Supernatant of Control plasmid图9 细胞培养上清SDS-PAGE电泳结果Fig 9 The SDS-PAGE results of cell culture supernatant

M:Protein Marker;F5~H1:Purified protein of CPV-VHH-F5~H1;EGFP:Purified protein of control plasmid图10 纯化后VHH的SDS-PAGE电泳结果Fig 10 The SDS-PAGE result of purified VHH
2.10 CPV纳米抗体结合力鉴定 利用间接ELISA方法鉴定表达并纯化的4株重组纳米抗体,结果显示H1 VHH抗体效价为1∶1 000,E3 VHH、D4 VHH 和F5 VHH抗体效价为1∶10 000,表明4株纳米抗体均可与CPV结合(图11)。

图11 ELISA鉴定纳米抗体结合力Fig 11 Identification nanobody binding by ELISA
2.11 IFA实验结果 通过间接免疫荧光实验验证4株纳米抗体与CPV的特异性,结果显示4株重组的纳米抗体均可与CPV特异性结合,IFA结果见图12。
2.12 病毒中和实验结果 通过对CPV的病毒中和实验检测重组纳米抗体的中和活性,结果显示4条纳米抗体对CPV的中和效价均小于1∶10,初步判断该4条VHH不具备CPV中和活性,中和抗体效价测定结果见表3。

表3 病毒中和实验结果Tab 3 Experimental data of VN test
3 讨 论
自中国确诊犬细小病毒病以来,该病呈地方性流行趋势,发病率和死亡率各不相同。20世纪70年代,CPV-2的发病率在30%~40%,死亡率超过10%[19]。在20世纪80年代,CPV-2发病率在41.61%~100%,死亡率在3.1%~60%[20-21]。20世纪80年代CPV-2抗体阳性率为48.92%~100%[22]。20世纪90年代至今,CPV-2临床发病率在3.90%~95.8%之间,死亡率在20.17%~73.47%[23-25]。CPV-2抗体阳性率40.9%~100%[26]。虽然我国宠物犬的总体发病率有所下降,死亡率却明显上升,表明该病毒的毒力明显更强[27]。疫苗是预防该病的主要手段,但现有疫苗也存在一些缺陷,如弱毒疫苗存在毒株变异和毒力返强的风险,可能存在母源抗体的影响导致免疫失败,因此,临床仍有很多幼犬感染CPV,因此制备抗CPV的抗体一直是防治该病的研究热点。
传统抗体通常是通过实验动物生产多克隆抗体,制备工艺较为复杂,批间差异较大,而且传统抗体具有分子量大、免疫原性高、稳定性差等特点,应用及发展均受限制。随着基因工程技术的发展和对抗体结构的深入了解,新型的基因工程抗体不断出现并被应用在诊断及治疗的各个领域。抗体制备技术的发展也由传统的多克隆抗体转向单克隆抗体和基因工程抗体。越来越多的单克隆抗体被用于疾病的治疗及诊断,虽然相较于多抗而言单抗具有很多优势,但仍然存在分子量大、具有免疫原性、组织穿透力不足和生产工艺复杂等缺点,因此基因工程抗体的开发工作显得尤为重要。
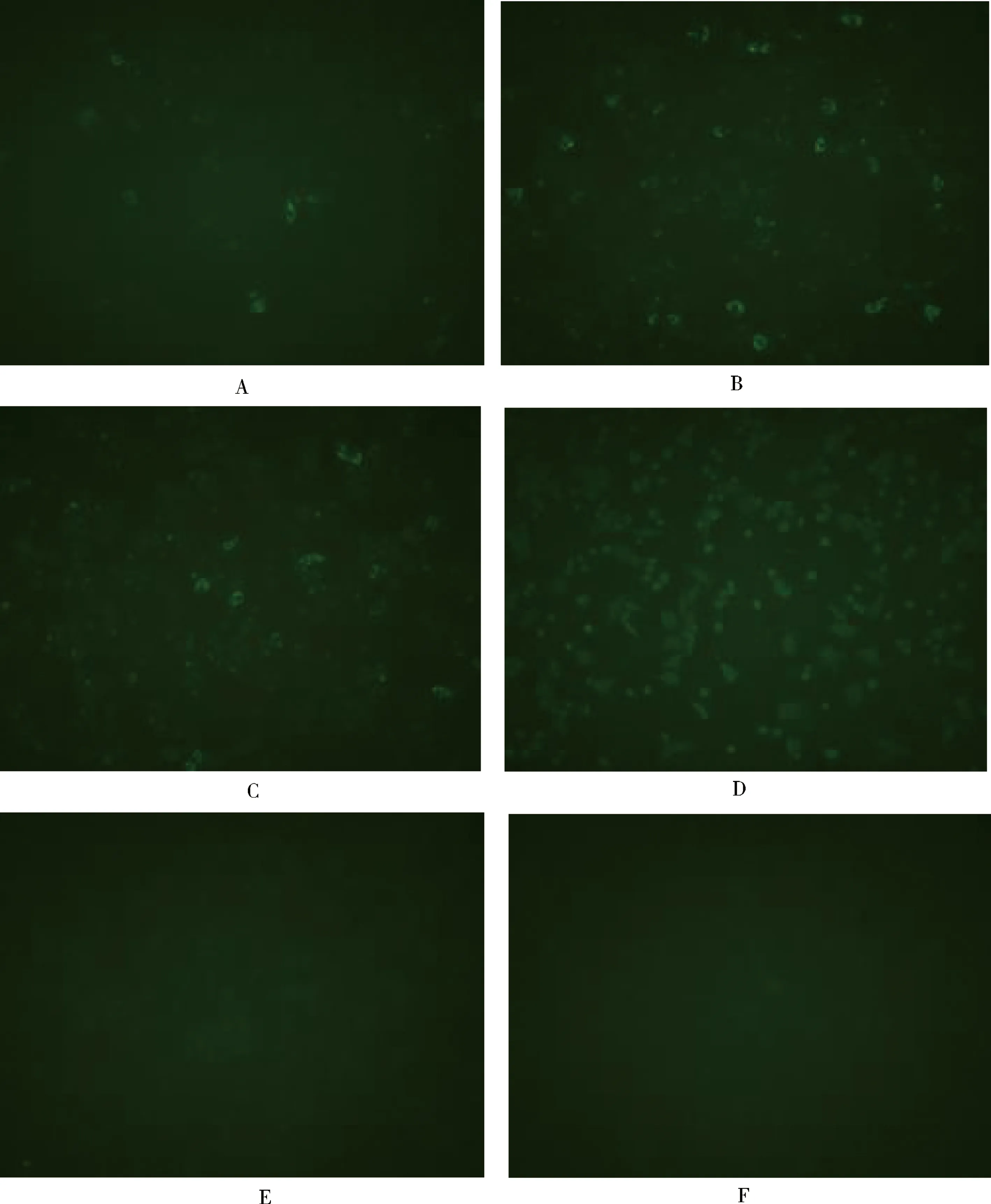
A:CPV-VHH -H1;B:CPV-VHH -E3;C:CPV-VHH -D4;D:CPV-VHH -F5;E:Control of secondary antibody;F:Cell controls without virus图12 IFA实验结果Fig 12 Results of IFA
目前,人们已经开发出了Fab抗体、Fv抗体、ScFv抗体和单域抗体等基于常规抗体结构的基因工程抗体,并且可以在多种宿主细胞中表达和制备,但由于这些抗体VL和VH之间FR2区域的疏水性特点导致其表达时存在可溶性低、稳定性差、易聚集等问题,影响表达产量,制造成本较高,不利于动物疫病防治的开发应用。而纳米抗体的单域结构以及亲水性特点使其可以在多种微生物系统中大量表达,例如大肠杆菌、毕赤酵母和酿酒酵母等,生产成本较低,更适用于动物疫病的防控[28-29]。
噬菌体展示技术已经被证明是开发和生产治疗性抗体的最有效的技术平台。噬菌体展示常用的噬菌体有两种:M13丝状噬菌体和T7裂解噬菌体,其中M13丝状噬菌体的应用最为广泛。本研究选择M13丝状噬菌体,其感染不会导致细菌细胞的裂解,不需要经过分泌,即可展示融合蛋白,有利于淘选过程中噬菌体的纯化,从而缩短试验周期。
哺乳动物细胞表达系统可以为重组蛋白提供其他系统所没有的翻译后修饰功能,被认为是表达重组蛋白最理想的系统。人胚胎肾细胞(HEK293)细胞易于培养和转染,适合重组蛋白的瞬时转染表达,瞬转表达量高于CHO细胞,可以更快获得目的蛋白。本研究将4条从噬菌体文库中筛选出的CPV特异性纳米抗体序列分别插入真核系统表达载体pcDNA3.1中,采用PEI转染HEK293细胞,成功表达出4条重组的纳米抗体蛋白,通过Ni-磁珠亲和纯化方法有效纯化出带有6×His标签的重组纳米抗体,纯度>90%。
通过SDS-PAGE、ELISA、IFA以及对CPV的中和效价测定等实验对4条重组纳米抗体进行了生物学特性的鉴定,结果显示通过HEK293F细胞表达的4条纳米抗体均能特异性结合CPV,但不具备对CPV-2c毒株的中和活性。分析可能原因有:(1)本实验采用全病毒筛选出的VHH并不是识别病毒感染细胞的关键位点的抗体。VP2蛋白是CPV的免疫原性蛋白,其中包含中和抗原位点,可以尝试以CPV VP2蛋白为目标抗原,对噬菌体文库进行更有针对性的特异性筛选,或可获得具有中和活性的纳米抗体[30]。(2)因为纳米抗体的分子量过小,虽然有利于结合抗原位点,但不足以形成有效的空间位阻效应以阻断病毒感染细胞的能力。可以通过一些基因工程的手段对纳米抗体进行修饰,例如通过柔性连接肽段串联纳米抗体构建多聚体或双特异性抗体等,以提高纳米抗体的功能。
本研究首次构建了针对CPV的纳米抗体免疫文库,并在HEK293F细胞中成功表达了特异性的纳米抗体,为进一步研究其在临床诊断和治疗中的应用奠定了基础,并为将纳米抗体应用于兽用生物制品领域提供了一定的理论知识。

