肽或蛋白质类纳米颗粒口服应用的最新研究进展
袁礼稳,刘振利,陈 珍,杨雨婷,张雪花,李露萍,谢书宇
(华中农业大学国家兽药残留基准实验室(HZAU),国家兽药安全评价实验室(HZAU),农业部畜禽产品质量安全风险评估实验室,武汉 430070)
蛋白质和肽(PPs)已被确定为生命的基本单位,并发展成为治疗一系列疾病的药物。首先,PPs具有一定的治疗优势,比如它们的特异性以及它们的耐受性等;在过去十年中,增强的特异性和耐受性特征扩大了它们的应用。在2000年代初期,研究人员首次进行了用牛和猪的胰岛素治疗糖尿病的试验。20年后,研究者们仍花费了大量时间来研究并开发这些生物分子的潜在治疗剂作用价值。另外,蛋白质和肽也已成为小分子药物——核酸的替代品之一,并且会更容易获得监管机构的批准[1-2]。纯药物级肽源于合成的化学肽(比如乳清蛋白、胰岛素等),这些肽因其具有内在的活性和功能,所以在许多疾病的治疗中发挥重要作用,比如癌症、糖尿病、自身免疫病和心血管疾病[3-4];除此之外,一些肽还可用作抗微生物剂、抗高血压剂和抗氧化剂,这些肽被修饰用来靶向许多分子靶标,例如抗菌肽激素受体、蛋白质-蛋白质相互作用和酪氨酸激酶受体等[5-6]。因此,功能化后的肽类药物可以被显著的提高其生物利用度。合适的给药途径不仅能保证药物的疗效,还能保证患者的依从性。然而,PPs的给药途径通常是胃肠外注射,长期连续注射可能对患者依从性构成巨大挑战,包括疼痛、对注射的厌恶、对针头大小的担忧和局部刺激反应明显等。因此,许多研究团体试图开发递送PPs的替代途径,例如口服、鼻腔、眼部和经皮给药[7-8],其中口服递送是最有吸引力的替代途径,因为它具有更高的安全性和依从性[9-11]。以口服胰岛素为例,口服给药途径能够模拟内源性胰岛素的生理命运,这可以实现比皮下注射(SC)更好的葡萄糖稳态[12]。口服给药途径将通过改善患者的生理条件来提高治疗某些慢性病的治疗效果。根据联合市场研究最近的报告,全球口服PPs市场预计将从2016年的6.43亿美元增长到2028年的82.3亿美元[13],因此,提高口服PPs的生物利用度将是众多研究者重点研究的难题。
1 肽或蛋白质类大分子药物口服吸收的障碍
胃肠道旨在将碳水化合物、蛋白质和其他营养物质消化成氨基酸和单糖的亚基。同时,胃肠道也是防止病原体进入机体的天然屏障。因此,完整的PPs的口服生物利用度<1%,有时甚至<0.1%[26-27]。事实上,口服给药的药物在吸收之前必须克服许多生物学障碍(图1)。
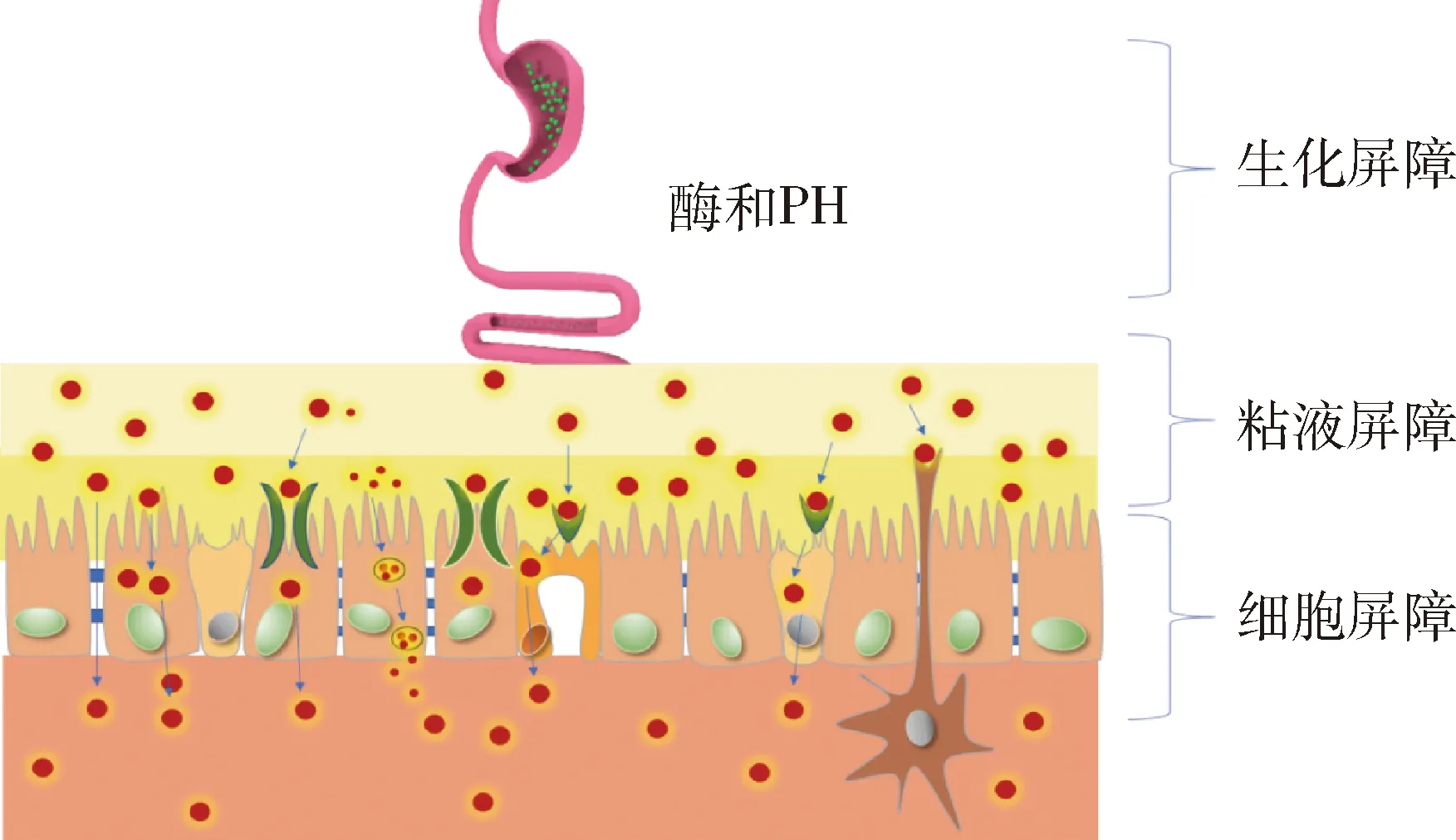
图1 口服肽或蛋白质NPs的生物学屏障Fig 1 Biological barrier of oral peptide or protein NPs
1.1 生化屏障 蛋白质或肽类纳米颗粒(PP-NPs)存在两大类生化屏障:胃肠道pH梯度变化提供的屏障和酶促屏障。胃的消化液由胃腺分泌,由盐酸、蛋白质消化酶、胃蛋白酶和粘液组成。小肠分为三个不同的区域:十二指肠、空肠和回肠,每个区域都具有影响营养吸收的独特特征[28]。当部分消化的食物和其他颗粒通过胃肠道时,它们会受到从胃(pH 1.0~2.0)到十二指肠(pH 4~5.5)、空肠(pH 5.5~7.0)和回肠(pH 7.0~7.5),然后转移到结肠和直肠(pH 7.0~7.5)的腔内pH值变化的影响[29-30]。这种pH梯度变化加上不同的胃排空率和胃肠蠕动,严重影响口服PP-NPs在胃肠道的吸收利用[31]。
盐酸使胃成为体内酸性最强的环境(pH 1~2)。在这种高度酸性的条件下,胃蛋白酶的活性最佳。胃蛋白酶作为一种广泛的内肽酶,可水解苯丙氨酸、色氨酸和酪氨酸等芳香族残基的肽键[32]。脂肪、油和甘油三酯的水解也在胃中发生,并由脂肪酶催化。此外,尽管小肠中充满了各种消化酶,如胰腺分泌的消化酶,常见酶包括胰蛋白酶、糜蛋白酶、羧肽酶和弹性蛋白酶,还有小肠的肠细胞产生的几种氨肽酶、羧肽酶、内肽酶和γ-谷氨酰转肽酶,因此,PP-NPs要克服这些酶到达下一个部位将面临严峻挑战[33]。但事实上绝大部分肽或蛋白类药物在pH梯度变化和各种酶的共同作用下土崩瓦解,致使其生物利用度低。
1.2 粘液屏障 粘液是由杯状细胞分泌的覆盖整个胃肠道的粘性凝胶层,可以捕获外来物质并保护上皮细胞免受外源性病原体的攻击。整个胃肠道中的粘液由两层组成,包括疏松易流动的松散层和牢固粘附的粘液层。粘液对PP-NPs进入粘膜下组织施加多重屏障。首先,高粘度降低了PP-NPs在粘液中的扩散性,这直接影响了PP-NPs在粘液中的穿透能力[34]。粘液在肠道中是持续分泌和更新替换的,在肠道中周转时间约为50~270 min,导致粘液层中捕获的颗粒被快速去除,从而降低了纳米颗粒的粘附和停留时间,使得PP-NPs在到达肠上皮细胞之前渗透穿过粘液层变得非常具有挑战性[35]。其次,粘蛋白也能一定程度影响PP-NPs的摄取效率,由于粘蛋白中丝氨酸的糖基化以及苏氨酸和脯氨酸结构域的存在,使粘液中的粘蛋白带高度负电荷,因此,粘蛋白和PP-NPs之间可能通过静电力产生更大的相互作用[36]。此外,由于粘蛋白刷状支架结构,可以作为一种大小颗粒的过滤器,进而降低蛋白质等较大化合物的迁移率[37-38]。另外,由于粘蛋白纤维通过范德华力和静电力、氢键和疏水相互作用与蛋白质或颗粒非共价相互作用,因此可能会发生蛋白质的结构修饰或颗粒的截留,从而阻碍他们的吸收[39-41]。
1.3 细胞屏障 位于粘液下方的肠上皮细胞也是口服PP-NPs递送的另一个主要限制因素。肠上皮细胞包括各种类型的细胞且具有各自其特定的功能,例如用于吸收的肠细胞、用于分泌粘液的杯状细胞和用于运输外来颗粒的M细胞[42]。肠上皮细胞是主要的吸收细胞,大约占90%的肠上皮[43]。这些极化的上皮细胞形成一个连续的单层,将肠腔与下面的固有层分开。
药物的肠道吸收主要依赖于跨细胞途径,而细胞旁途径是一些亲水性小分子的主要跨细胞途径[44]。根据Lipinksi “Rule of 5”,PPs被预测为极低的跨细胞渗透性,因为PPs的Log P很可能远低于5,并且PPs有大量的氢键供体或受体,分子量远大于500 Da。因此,PPs很难通过跨细胞途径被吸收到门静脉中[45]。PP-NPs通过肠上皮细胞,会受到相邻肠细胞之间的紧密连接蛋白复合物、粘附连接和桥粒的物理限制[46]。这些带有净负电荷的蛋白复合物的平均孔隙半径估计为8-13Å[47-48]。因此,它们阻止了大多数离子和大分子在相邻细胞之间的转运(称为细胞旁转运)。此外,PP-NPs(通常带电)可以被肠细胞或M细胞主动内化,并通过胞吞作用穿梭到相反的膜上[49]。通过这些方式进入细胞屏障的毒素、外源性化合物和其他外来化合物通过主动运输机制被排回管腔。因为P-糖蛋白、乳腺癌耐药蛋白和多药耐药蛋白是表达在肠细胞顶膜上的三种外排泵,它们已被证实可以降低在肠道的药物吸收,从而降低了药物的生物利用度[50-51]。
2 PP-NPs口服给药的最新进展
国内外研究人员已经研究了各种聚合物来制造NPs,因此,口服PP-NPs递送领域在过去几年中获得极大发展,包括纳米凝胶,微乳液,脂质体,纳米颗粒等(表1详细说明了用于口服的肽或蛋白质类纳米颗粒的研究进展)。然而,研究最广泛和最容易被接受的聚合物本质上是可生物降解的。聚合物的选择取决于多种因素,例如给药方式、靶向目的、装载药物的理化性质、所需的释放曲线、所需的颗粒降解速率和生物相容性等[84-85]。此外,使用渗透促进剂促进PP-NPs的吸收是一个重要的研究领域[86]。自20世纪90年代至今, 聚乳酸-羟基乙酸共聚物(PLGA)、聚甲基丙烯酸、聚(氰基丙烯酸烷基酯)、壳聚糖及其衍生物和藻酸盐等聚合物被用于制备纳米颗粒[87]。天然聚合物(明胶、白蛋白和藻酸盐)也被广泛用于NPs的制备,但具有一些固有的缺点,例如对降解的敏感性、重现性差和潜在的抗原性[88]。pH敏感的聚合物纳米载体也广泛用于口服PPs的递送。与基于脂质的纳米颗粒相比,聚合物纳米颗粒在胃肠道的降解相对于环境中表现出更好的稳定性和保存性[89]。
在脂质纳米载体的制备过程中,脂质的选择是制备纳米载体的关键因素。通常用于制备脂质纳米载体的脂质包括脂肪酸、脂肪醇、磷脂和甘油单酯、甘油二酯和甘油三酯。脂质赋形剂通过增加肠膜的通透性、减少蛋白水解和增加肠淋巴转运来增强PPs的吸收[90]。由于胃肠道液体的不稳定性和渗透性差,脂质体作为口服PPs递送系统尚未取得成功[91]。因此研究人员已经证明了对脂质NPs进行表面修饰以有效加载PPs药物,在所测试的纳米载体中,只有用DSPE-PEG2000修饰的脂质NPs能够增加小鼠胰高血糖素样肽-1(GLP-1)的水平(增加八倍)。治疗1个月后,该制剂还有效地使糖尿病小鼠的葡萄糖水平正常化[92]。
微乳液是两种互不相溶的溶剂在表面活性剂的作用下形成乳液,在微泡中经成核、聚结、团聚、热处理后得纳米颗粒。它们在热力学上是稳定的,并且尺寸小于100 nm。相比之下,纳米乳剂在热力学上不稳定,需要高能量才能产生小于200 nm的动力学稳定系统。微/纳米乳液对PPs口服递送很有前景,因为它们使用简单的水/油(W/O)乳液或多个W/O/W乳液促进亲水肽的溶解[93]。Bilosomes是一种新型脂质纳米载体,它含有结合在囊泡脂质双层中的胆汁盐。古菌体包含从酸热硫化叶菌中提取的脂质部分,保护胃肠道中的肽,并保留肽更长时间(12 h)。固体脂质纳米颗粒(SLN)亲脂性胶体载体由生理脂质和表面活性剂组成。SLN的优点包括使用无毒溶剂、避免化学交联和具有较高的药物负载效率[94]。当SLN分散在GI流体中时发生自乳化制剂被称为自乳化药物递送系统(SEDDS)。纳米颗粒尺寸小于200 nm的系统称为SNEDDS或纳米乳液。这是极具发展前景的纳米递送系统,因为它们可以包装成胶囊,为患者提供靶部位的精确给药[95]。SNEDDS用于配制亲脂性和水溶性差的药物,目前的应用包括控制药物的释放、提高药物稳定性和增加载药量(25 mg~2 g)[96]。
NPs也可以使用各种无机、有机以及有机和无机材料的混合物合成。陶瓷和磷酸钙被广泛用于制备用于各种治疗适应症的纳米颗粒。一项研究表明,较小尺寸(≤200 nm)和更多负电荷(例如二氧化硅)的NPs表现出更好的肠道通透性[97]。然而,无机NPs用于口服给药是受限制的,它们在体内缓慢和/或部分降解,因此,可能会积聚在身体组织中。因此,要了解与使用无机NP相关的毒理学问题,需要进一步升入研究和探索[98]。
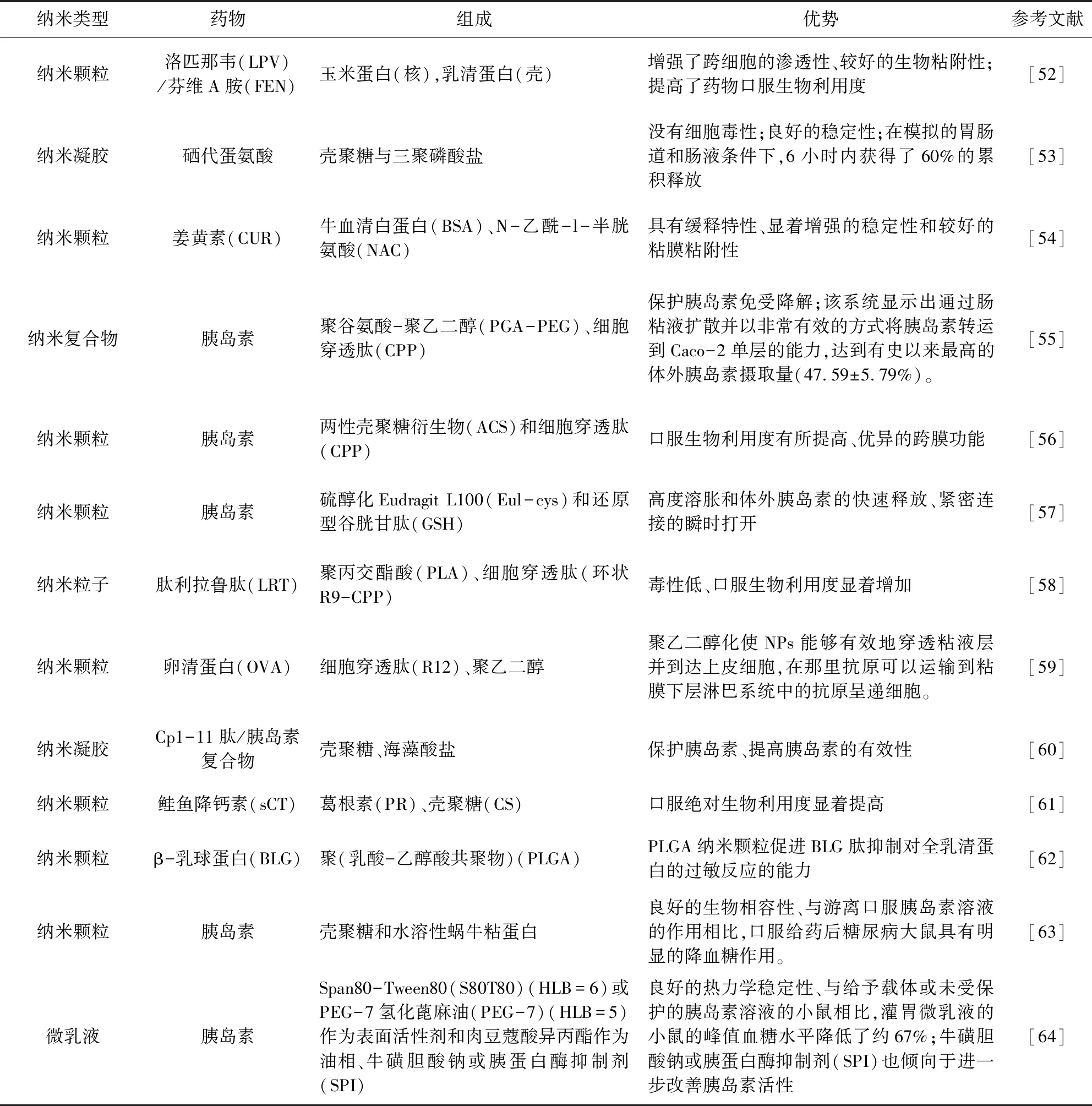
表1 用于口服的肽或蛋白质类纳米颗粒Tab 1 Peptide or protein nanoparticles for oral administration
3 展 望
纳米技术已成为医学领域的重要参与者,最近批准的NP数量越来越多[99-101]。令人兴奋的是,大量NPs正在进行临床试验研究,这反映了通过基于纳米的方法治疗人类疾病的重要性。在各种NPs中,蛋白质NPs是高度优选的,主要是因为它们具有高特异性、耐受性和生物降解性。蛋白质NPs能够装载各种药物,以便在不同的器官中进行特异性递送。这种递送可以通过口腔、鼻腔、肺部、静脉内和眼部途径介导,其中口服递送可提供最高程度的患者依从性和舒适度。用于口服给药的蛋白质NP的开发为人类疾病治疗开辟了新途径。然而,大多数口服纳米给药系统的研究仍处于实验室阶段,面临许多挑战:如何增加载药量以达到临床治疗剂量;开发成便于临床使用的剂型;安全评估和稳定性研究。因此,为了找到克服挑战的实用和有效的方法,将进行更深入的研究是必要的。

