葡萄霜霉菌糖基水解酶基因的表达模式与功能分析
潘凤英,曲俊杰,刘露露,孙大运,郭泽西,韦晓丽,韦淑梅,尹玲
葡萄霜霉菌糖基水解酶基因的表达模式与功能分析
潘凤英,曲俊杰,刘露露,孙大运,郭泽西,韦晓丽,韦淑梅,尹玲
广西壮族自治区农业科学院广西作物遗传改良生物技术重点开放实验室,南宁 530007
【目的】克隆葡萄霜霉菌()糖基水解酶(glycosyl hydrolase,GH)基因(),分析其特征以及在葡萄霜霉菌侵染葡萄叶片过程中的表达模式,研究其抑制/促进烟草叶片程序性细胞死亡(PCD)以及影响烟草疫霉()侵染的能力,为深入探究调控寄主植物免疫的机制提供理论依据。【方法】以葡萄霜霉菌Pv5-27菌株作为试材,采用RT-PCR方法扩增获得8个基因全长,并对其基因及编码蛋白进行生物信息学分析;利用酵母信号肽诱捕系统(SST)验证PvGH的分泌活性;利用实时荧光定量PCR技术检测葡萄霜霉菌侵染葡萄叶片过程中的表达模式;同时利用农杆菌介导的PVX病毒表达系统在本氏烟上瞬时表达PvGH效应蛋白,分析其对INF1和BAX触发的烟草PCD的抑制能力以及促进烟草疫霉侵染的能力。【结果】8个基因序列与通过全基因组预测的序列完全一致,长度为1 092—1 392 bp,分别编码364—464个氨基酸,与其他卵菌同源蛋白相似性高达60.62%—86.36%。8个PvGH均不含跨膜结构域,其二级结构差异较大,三级结构与其他蛋白三级结构相似性较低,呈现非常独特的三级结构。使用SingalP 5.0软件对编码的蛋白进行信号肽预测,发现它们均含有20—26 aa的信号肽,但通过SST验证结果显示PvG09279和PvG13517并不具有分泌特性。保留、缺失或者替换信号肽的8个PvGH均可抑制BAX触发的本氏烟PCD,并促进烟草疫霉的侵染,表明PvGH效应蛋白发挥其毒力不依赖于信号肽。在葡萄霜霉菌侵染初期表达上调,进一步表明其在病原菌与寄主互作中的重要作用。【结论】在侵染寄主过程中,葡萄霜霉菌分泌的PvGH通过抑制寄主PTI反应参与致病过程。
葡萄霜霉菌;糖基水解酶;生物信息学;功能分析
0 引言
【研究意义】由葡萄霜霉菌()引起的霜霉病是全球葡萄产业共同面临的一大卵菌病害,严重制约着葡萄与葡萄酒产业的绿色健康发展。该病原菌可以侵染葡萄的叶片、花序、幼果等幼嫩的绿色组织,在高温、高湿的季节极易暴发成灾。目前关于葡萄对霜霉病的抗性机制研究较多,但关于葡萄霜霉菌的致病机理研究较少。因此,明确葡萄霜霉菌糖基水解酶(glycoside hydrolase,GH)的蛋白特征和功能,能够为进一步分析病原菌与寄主之间的相互作用机制提供理论依据。【前人研究进展】细胞壁是植物抵御病原菌侵染的一道天然屏障,由多糖、蛋白质以及脂肪酸构成。病原物在侵染的过程中会分泌一些效应因子干扰或者破坏寄主植物的免疫反应,促进其侵染和繁殖[1-3]。这些效应因子大都是一些激发子或细胞内毒素等分子,能够导致寄主细胞结构和功能的改变,从而激发或抑制植物的免疫反应。GH是一类重要的胞外效应因子,致病菌在侵染寄主植物过程中分泌的GH可以将植物多糖分解成寡糖或者单糖,从而破坏植物细胞壁结构,使其突破寄主植物表皮障碍成功侵染寄主植物的同时汲取自身繁殖所需的营养物质[4-7]。已有的研究表明,GH家族蛋白在侵染寄主的过程中不仅可以发挥毒力因子作用,帮助病原菌成功侵染植物[8-9],而且在卵菌和真菌中还发现GH能够作为病原体相关分子模式(pathogen-associated molecular pattern,PAMP),激发寄主活性氧迸发、胼胝质积累、防卫基因的表达和过敏性细胞坏死等典型的PAMP触发免疫(PAMP-triggered immunity,PTI)反应[10-12]。例如,大豆疫霉()PsXEG1[12]、灰葡萄孢()的BcXYG1[13]和BcXYL1[14]、棉花黄萎病菌()的VdEG1和VdEG3[15]以及胶酸裂解酶VdPEL1[16]和角质酶VdCUT11[17]、尖镰孢()的FoEG1[18]均被发现在侵染过程中,不仅发挥毒力因子的作用,而且能够作为PAMP,引起植物叶片死亡和诱发植物自身一系列的免疫反应。此外,还有一些GH被植物受体直接地识别为PAMP,调控植物免疫反应。例如,真菌内聚半乳糖醛酸酶可以被拟南芥的富含亮氨酸重复序列类受体样蛋白(LRR-RLP)AtRLP42识别为PAMP[19];乙烯诱导木聚糖酶被番茄LRR-RLP的LeEIX识别并诱导传递过敏反应信号[20]。最近,从黄萎病菌中鉴定出一种新的乙烯诱导木聚糖酶VdEIX3,该蛋白被本氏烟()NbEIX2识别为PAMP,诱导本氏烟产生免疫反应[21]。【本研究切入点】尽管近年来的研究证明了GH家族在真菌和卵菌对植物宿主的入侵、致病性或毒力中的作用,但深入确切的机制仍然知之甚少。本项目组前期已完成了多个不同致病力葡萄霜霉菌菌株的全基因组测序[22],并通过生物信息学方法从中挖掘出在多个菌株中高度保守的PvGH蛋白,这些保守PvGH蛋白在霜霉菌致病过程中的作用有待于验证。【拟解决的关键问题】解析葡萄霜霉菌分泌的PvGH蛋白在侵染寄主过程中的作用,为进一步研究葡萄霜霉菌与寄主之间的互作机制打下基础。
1 材料与方法
试验于2020—2022年在广西农业科学院广西作物遗传改良生物技术重点开放实验室完成。
1.1 材料与试剂
1.1.1 材料 供试菌株葡萄霜霉菌Pv5-27,由本实验室葡萄分子设计育种团队分离纯化并保存;由马铃薯X病毒(potato virus X,PVX)改造的植物双元表达载体pGR107为南京农业大学窦道龙教授馈赠;酵母菌株YTK12和酵母信号肽诱捕载体pSUC2由上海交通大学卢江教授馈赠;烟草疫霉()由广西农业科学院刘增亮副研究员馈赠。
本氏烟置于25℃温室中,16 h/8 h光暗交替培养4—5周使用。
1.1.2 试剂 植物总RNA提取试剂盒购自西格玛奥德里奇(上海)贸易有限公司;反转录试剂盒购自Takara(大连)公司;高保真DNA聚合酶、感受态细胞Fast-T1和克隆试剂盒购自南京诺唯赞生物科技有限公司;胶回收试剂盒购自德国凯杰公司;质粒小提试剂盒购自天根生化科技有限公司;酵母一步法转化试剂盒、CMD-W培养基、YPRAA培养基购自北京酷莱博科技有限公司;荧光定量试剂盒购自广州聚研生物科技公司;所用引物(表1)由南宁擎科生物有限公司合成。
1.2 方法
1.2.1的克隆 提取葡萄霜霉菌Pv5-27菌株孢子囊和孢子囊梗的总RNA,利用反转录试剂盒合成cDNA第一链。根据葡萄霜霉菌基因组预测的各基因全长,设计合适的引物,克隆,连接T载体,并转化至大肠杆菌DH5,提取质粒,送至上海生工生物工程有限公司(上海生工)进行测序,将测序正确的质粒保存于-20℃备用。
1.2.2 PvGH蛋白的生物信息学分析 使用Protparam、Prot Scale、SingalP 5.0、TMHMM Server v.2.0、SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https:// swissmodel.expasy.org/)对PvGH蛋白的基本理化性质、亲/疏水性、信号肽、跨膜结构、二级结构和三级结构分别进行预测分析。
1.2.3 PvGH信号肽功能验证 根据1.2.2所预测的信号肽序列,设计相应引物,以1.2.1中的质粒为模板,分别扩增PvGH的信号肽编码序列。通过双酶切连接方法构建pSUC2--载体,转化大肠杆菌DH5,提取质粒,测序正确的pSUC2--质粒及pSUC2-(阴性对照)、pSUC2-(阳性对照)使用酵母一步法转化试剂盒转化至YTK12,涂布于CMD-W培养基,30℃培养3 d,筛选转化子。阳性转化子分别转接至以棉子糖作为全部碳源的YPRAA培养基上,30℃培养2 d。通过观察缺陷型酵母对棉子糖的利用能力来判断信号肽是否具有分泌功能。另外,从YPRAA培养基上挑取少量菌体接种于YPRAA液体培养基,30℃ 250 r/min培养过夜。吸取2 mL菌液到离心管中,700×室温离心2 min收集菌体。使用灭菌水重悬菌体后离心去上清。用450 μL CMD-W液体培养基重悬菌体,加入50 μL 1% TTC溶液混匀后35℃孵育30 min,观察各个样品中溶液的颜色变化。

表1 本研究所用引物信息

续表1 Continued table 1
1.2.4 PVX表达载体的构建 根据SignalP 5.0预测PvGH蛋白的信号肽序列,使用重叠PCR法,使得PvGH保留、去除信号肽以及替换为本氏烟PR1蛋白信号肽。使用CE Design软件设计含有Ⅰ和Ⅰ酶切位点的引物,以保留、去除以及替换信号肽的相应质粒为模板,扩增目的序列,利用同源重组的方式构建含有目的序列的pGR107载体,转化至大肠杆菌DH5感受态细胞,涂布至含100 mg·L-1卡那霉素的LB平板上,置于37℃培养箱中培养12 h。挑取单克隆并进行菌液PCR验证后,将阳性克隆送至上海生工进行测序。选择经测序验证序列正确的菌液保存并提取重组质粒DNA,分别记为pGR107-、pGR107-、pGR107-PvGH。利用液氮冻融法分别将这些质粒转化到农杆菌GV3101感受态细胞,随机挑取单克隆使用菌液PCR方法进行验证,验证正确的农杆菌转化子用于下一步试验。
1.2.5 瞬时转化本氏烟研究PvGH功能 选用小鼠细胞凋亡诱导因子BAX和能激发PTI的致病疫霉()PAMP激发子INF1作为细胞坏死激发因子。农杆菌介导的本氏烟瞬时表达方法参考尹玲[23],使用在温室中生长30 d的本氏烟,用无针头的1 ml注射器从背面注射含有pGR107-、pGR107-、pGR107-PvGH的农杆菌重悬液至第3—6叶片中,以pGR107空载作为阴性对照,激发子BAX和INF1作为阳性对照,并做好标记。24 h后,在pGR107-、pGR107-、pGR107-PvGH区域注射含有不同激发子(BAX、INF1)的农杆菌重悬液,暗光下培养5 d后观察叶片注射区域坏死情况。每次试验注射3株烟草,每株烟草注射3片叶子,重复3次。
1.2.6 葡萄霜霉菌侵染阶段的表达 使用霜霉菌Pv5-27菌株侵染欧亚种‘赤霞珠’葡萄嫩叶叶盘,采集霜霉菌孢子囊期、游动孢子期以及侵染后12、24、48、72、96 h的材料,分别提取总RNA,并反转录为cDNA,-20℃保存备用。以葡萄霜霉菌为内参,使用Roche 480荧光定量PCR仪测定的表达情况。实时荧光定量PCR反应体系20.0 μL:2×FastStart Universal SYBR Green Master(ROX)10.0 μL,正、反引物各0.8 μL(10 µmol·L-1),cDNA模板2.0 μL,ddH2O 6.4 μL。扩增程序:95℃预变性10 min;95℃变性10 s,60℃退火20 s,72℃延伸20 s,收集荧光信号,40个循环;95℃ 5 s,65℃ 60 s进行熔解曲线分析。采用2-∆∆CT法,以孢子囊期基因表达量为对照,计算目的基因相对表达量,并采用SPSS25.0进行单因素方差分析。
1.2.7 本氏烟瞬转PvGH蛋白对烟草疫霉侵染的影响 农杆菌介导的本氏烟瞬时表达方法参考尹玲[23],选择在温室中生长30 d的本氏烟,使用无针头的1 mL注射器从背面注射含有pGR107-的农杆菌重悬液至第3—6叶片的一侧,另一侧叶片注射pGR107-作为对照。2 d后摘下叶片,铺在浸湿水的滤纸平板上。叶片的两侧分别用针头刺伤,刺伤处各接种一个5 mm的25℃黑暗保湿培养生长4 d的烟草疫霉菌块,菌丝块与叶片背面接触。置于25℃黑暗保湿培养2 d后,测量病斑长度并在紫外光下对侵染状况进行观察拍照。
2 结果
2.1 PvGH的克隆和蛋白结构域分析
根据课题组前期对葡萄霜霉菌Pv5-27菌株全基因组测序得到的候选CDS序列,设计引物扩增8个基因序列。如图1所示,PCR扩增得到符合预期大小的目的条带,长度在1 092—1 392 bp。目的条带经回收、连接T载体、转化大肠杆菌后进行测序,测序比对结果发现基因序列与基因组预测的CDS序列完全一致,表明成功克隆了这8个,其编码的蛋白序列长度为364—464 aa。NCBI同源比对分析发现,8个PvGH蛋白与大豆疫霉、丁香疫霉()、致病疫霉、仙人掌疫霉()等其他卵菌同源蛋白的同源性高达60.62%—86.36%;其中PvG02199与大豆疫霉GH7蛋白相似度最高,达86.36%(表2)。

1: PvG11117; 2: PvG13516; 3: PvG10113; 4: PvG01792; 5: PvG09279; 6: PvG02199; 7: PvG13517; 8: PvG13010

表2 PvGH及编码蛋白序列特征
使用NCBI CDD和PFAM两个数据库对8个PvGH的氨基酸序列进行保守结构域预测,发现两个数据库预测的结果基本一致,它们都含有GH家族结构域(表2)。其中3个(PvG11117、PvG10113和PvG13010)含有糖苷水解酶Glyco_hydro_6亚家族保守结构域,3个(PvG13516、PvG01792和PvG13517)含有Glyco_hydro_17亚家族保守结构域,PvG09279含有糖苷水解酶Glyco_hydro_28亚家族保守结构域,PvG02199含有Glyco_hydro_7亚家族的GH7_CBH_EG结构域。此外,PvG10113除了具有保守的Glyco_hydro_6亚家族保守结构域外,在羧基端还具有一个与细胞周期调控有关的DedD结构域。分析跨膜结构域和信号肽发现,这些PvGH蛋白在氨基端均含有长度为20—26 aa的信号肽,但均不含跨膜结构域,都属于分泌蛋白。
2.2 PvGH蛋白的二级结构及三级结构预测
利用SOPMA在线软件和SWISS-MODEL对PvGH蛋白的二级、三级结构预测分析。如表3所示,8个PvGH蛋白之间的二级结构差异较大,其中PvG11117、PvG13516、PvG10113、PvG01792、PvG13517和PvG13010富含-螺旋和无规则卷曲,二者所占比例达到77.69%—82.77%;而PvG09279和PvG02199则以无规则卷曲和延伸链两种结构为主,二者所占比例超过77%;-转角在这8个PvGH蛋白中所占比例均最少,仅占3.31%—7.78%。PvGH蛋白的三级结构与数据库中已知蛋白三级结构相似性在24.49%—59.86%,其中有5个(Pv13516、Pv01792、Pv09279、Pv02199、Pv13517)相似性超过30%(表3)。利用SWISS-MODEL软件对这8个PvGH蛋白进行同源建模,得到的三维效果图如图2所示。
2.3 PvGH信号肽功能验证
将8个PvGH蛋白的信号肽编码序列连接到pSUC2酵母信号肽诱捕载体质粒上,利用酵母信号肽诱捕系统(SST)来验证这些信号肽的分泌功能。结果如图3所示,除了未转质粒的YTK12酵母菌不能在CMD-W培养基上正常生长外,所有转化子都能正常生长,说明所有质粒均成功转入了YTK12酵母菌株。将阳性转化子重新接种于YPRAA培养基,其中携带PvG11117、PvG13516、PvG10113、PvG01792、PvG02199、PvG13010这6个PvGH信号肽序列的转化菌株与阳性对照菌株相同,可在棉籽糖为唯一碳源的YPRAA培养基上正常生长,这说明6个效应蛋白的信号肽均具有分泌活性,能够使SUC2正常分泌到胞外,从而将棉籽糖分解为酵母可直接利用的单糖。相反地,携带PvG09279、PvG13517信号肽序列的转化菌株则与阴性对照和缺陷型菌株YTK12相同,不能在YPRAA培养基上正常生长,不具备分泌特性。TTC显色试验结果进一步表明,PvG11117、PvG13516、PvG10113、PvG01792、PvG02199、PvG13010这6个PvGH的信号肽具有分泌活性,能够将蔗糖转化酶分泌到体外,将TTC还原成红色的TTF,而PvG09279和PvG13517则不具有分泌活性。

表3 PvGH蛋白的二级结构和三级结构

图2 PvGH蛋白的三级结构

图3 PvGH预测信号肽的功能验证
2.4 PvGH蛋白诱发或抑制烟草细胞死亡的能力
为了明确PvGH是否可以诱发或抑制本氏烟细胞死亡及其发挥功能是否需要作用于植物质外体空间,利用overlap PCR方法,将PvGH的信号肽进行缺失和替换,分别构建相应的pGR107表达载体,在本氏烟叶片上观察PvGH全长、缺失和替换信号肽后诱发或抑制细胞死亡的能力变化。信号肽的替换是将PvGH的信号肽替换为本氏烟PR1蛋白的信号肽(图4-A)。如图4-B所示,8个保留、缺失或者替换信号肽的PvGH蛋白均不能直接诱导烟草细胞坏死,但它们均可完全抑制BAX触发的烟草叶片PCD,暗示这8个PvGH效应蛋白具有潜在的毒性功能,可以抑制植物的免疫反应,而且其毒性功能不依赖于信号肽的存在。但是它们对于激发子INF1诱导的细胞坏死的影响却不尽相同,其中5个保留、缺失或替换信号肽的PvGH蛋白(Pv11117、Pv10113、Pv01792、Pv09279、Pv13010)可以完全抑制INF1诱导的本氏烟叶片细胞坏死,而缺失信号肽的PvG13516只能部分抑制,缺失信号肽的PvG02199和PvG13517则完全不能抑制,但保留和替换PR1信号肽的PvG13516、PvG02199和PvG13517均可抑制INF1触发的细胞死亡。上述结果说明,大部分PvGH抑制寄主PTI的能力不依赖于信号肽,而PvG02199、PvG13516、PvG13517抑制寄主植物PTI的能力则部分需要依赖于信号肽,将它们分泌到植物质外体空间发挥作用。

n=27表示重复的叶片数n=27 represented the number of duplicate leaves。图6同The same as Fig. 6
2.5 PvGH在葡萄霜霉菌侵染寄主过程中的表达模式
本研究中的是从多个葡萄霜霉菌基因组数据中预测得到的保守效应蛋白基因,尚未清楚其在Pv5-27菌株侵染寄主过程中是否表达及表达模式。使用实时荧光定量PCR技术对在霜霉菌孢子囊期、游动孢子期以及不同侵染阶段的表达模式进行分析。以孢子囊期表达量为对照,计算各侵染阶段的相对表达量。结果显示(图5),除外,其余7个均在游动孢子期表达量大幅增高,和在侵染后12 hpi(hours post-inoculation)或/和24 hpi的表达水平也存在不同程度的提高。这表明葡萄霜霉菌在孢子囊释放游动孢子阶段和侵染早期即大量表达,以帮助其降解寄主的细胞壁,或抑制寄主早期的PTI反应,从而有利于促进其成功侵染。仅在游动孢子期的表达量较高,仅在24 hpi表达量较高,为其余侵染时间点表达量的8.46—41.02倍,推测这两个GH蛋白促进病原菌侵染的机制可能与其余6个GH蛋白不同。
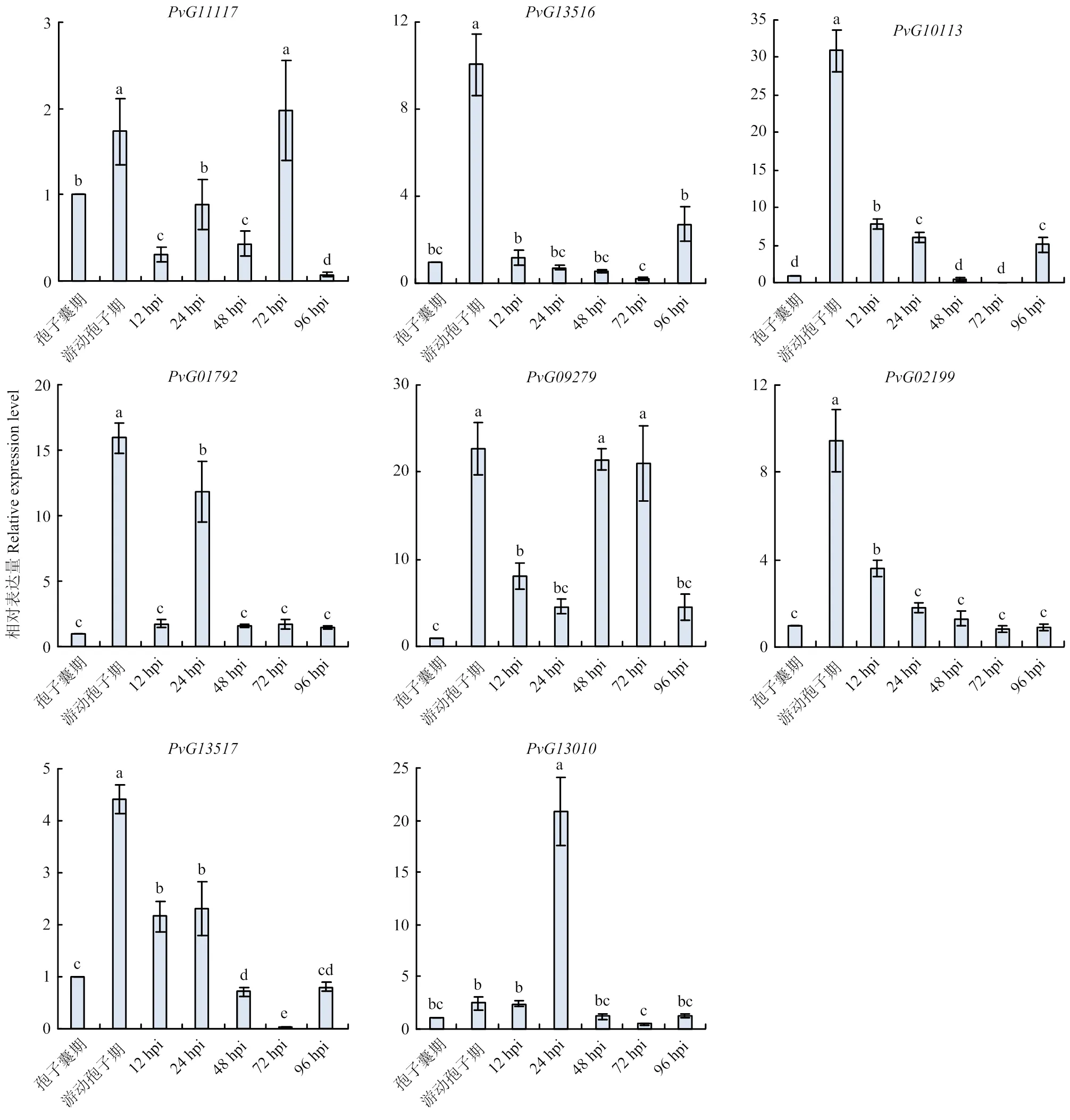
孢子囊期:Sporangium stage;游动孢子期:Zoospore stage。柱上不同小写字母表示差异显著Different lowercases on the bars indicate significant differences (P<0.05)
2.6 PvGH蛋白对烟草疫霉侵染的影响
烟草疫霉接种结果发现(图6),与pGR107-对照相比,注射pGR107-叶片产生的病斑直径显著大于对照组,表明葡萄霜霉菌的8个PvGH蛋白均可促进烟草疫霉侵染。
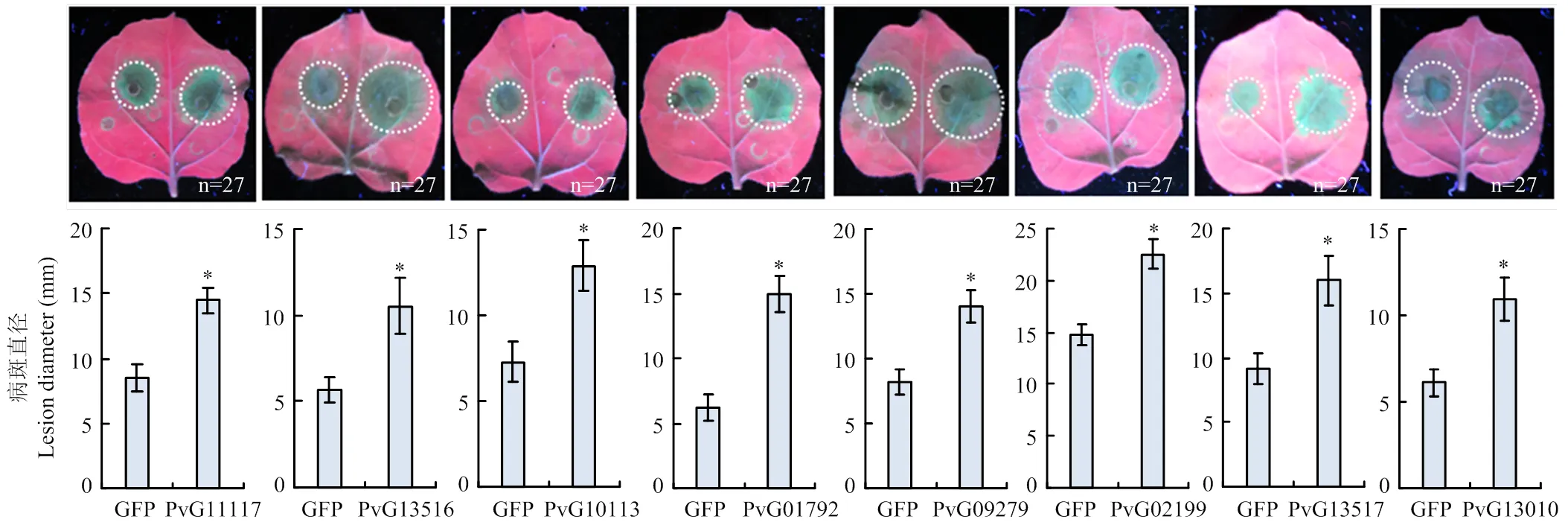
*:在P<0.05水平差异显著significant differences at P<0.05 level
3 讨论
3.1 PvGH信号肽的分泌功能
分泌特性是效应蛋白发挥功能的必要条件,因为效应蛋白只有从病原菌中分泌出来,才能靶向寄主的特定组分发挥生物功能。本研究所利用的SST系统是一种检测效应蛋白分泌特性的快捷而简单的方法,已被用于植物病原菌效应蛋白分泌特性鉴定[24-26]。本研究中,葡萄霜霉菌的8个PvGH蛋白中有6个在该系统中展示出分泌特性,有2个未检测出分泌活性。考虑到该系统是异源表达,信号肽的识别可能受影响,因此该SST系统的检测结果仅作为初步参考,对8个PvGH蛋白需要后续的生物学功能研究。
许多病原菌糖基水解酶与寄主植物的互作发生在植物质外体空间。GH12家族的大豆疫霉PsXEG1蛋白[9]和尖镰孢FoEG1蛋白[18]保留或替换为PR1信号肽的蛋白均能引起细胞坏死,但缺失信号肽的蛋白不能引起细胞坏死,说明这两种半活体营养型病原菌的GH12蛋白需要在信号肽的作用下分泌到质外体空间才可以发挥功能。与上述研究结果类似,PvG02199、PvG13516、PvG13517抑制INF触发的细胞死亡的能力也要依赖于信号肽的存在。而与此相反,葡萄霜霉菌的8个PvGH蛋白抑制BAX引起的PCD完全不依赖于其信号肽的存在,这也暗示着GH蛋白在不同营养类型的病原菌中发挥作用的场所和作用机制有所不同。
3.2 PvGH在病原菌侵染过程中的功能
疫霉菌激发子蛋白INF1能够在本氏烟叶片引起细胞死亡,激活植物的HR反应,被认为是卵菌的PAMP,其激活的HR反应被认为是PTI[27]。小鼠细胞促凋亡因子BAX在烟草叶片表达,也会引起烟草叶片细胞死亡,类似于抗病基因介导的HR反应[28]。本研究利用农杆菌介导的PVX病毒表达系统在本氏烟上瞬时表达PvGH效应蛋白,分析其对INF1和BAX触发的烟草细胞死亡的抑制能力。研究结果发现,葡萄霜霉菌在侵染寄主过程中,PvGH能够抑制寄主PTI,具有潜在的毒性功能,帮助病原菌成功侵染寄主,但是都不能作为PAMP,在异源的烟草叶片上引起坏死反应。与活体营养的葡萄霜霉菌不同,GH在其他营养类型,尤其是死体营养的病原菌中,常常作为毒力因子并作为PAMP诱发寄主植物抗性反应,例如在半活体营养型的大豆疫霉中,GH12家族蛋白PsXEG1和GH7家族PsGH7a、PsGH7c不仅发挥毒力因子的作用,而且能够作为激发子,诱发植物自身一系列的免疫反应[9,12,29-30]。死体营养型灰葡萄孢GH12家族的木葡聚糖酶BcXYG1,可在双子叶植物中诱导强烈的坏死和抗性反应[13];同样地,来自死体营养型的棉花黄萎病菌的两种具有纤维素酶活性的GH12蛋白VdEG1和VdEG3也被发现具有PAMP的功能,可以在本氏烟中触发细胞死亡以及与其酶活性无关的免疫反应[15]。此外,来自死体营养型尖镰孢GH12家族蛋白FoEG1,其酶活性为尖镰孢毒力作出贡献,并且还可以作为PAMP来诱导植物防御反应[18]。另外,灰葡萄孢的木聚糖酶BcXyl1和黄萎病菌的胶酸裂解酶VdPEL1、角质酶VdCUT11也都可以作为PAMP促进毒力并同时触发植物免疫[14,16-17]。因此,结合本研究的结果,笔者推测植物病原菌的GH效应蛋白功能差异可能与营养方式有关,活体营养型病原菌需要从寄主活细胞中吸取养分,因而需要与寄主细胞建立密切的关系并抑制寄主细胞死亡,从而保证其从寄主活细胞中不断吸取养分,而死体营养型病原菌通常先杀死寄主细胞,然后从死亡的细胞中获取营养。
3.3 PvGH蛋白异源表达
农杆菌介导的烟草瞬时表达系统是病原菌效应蛋白功能研究中普遍使用的一种方法,但是Chen等在对炭疽菌()效应子蛋白研究过程中建立了适用于葫芦科植物的农杆菌瞬时表达体系,并发现保守效应子蛋白NLP1和NIS1诱导烟草和甜瓜细胞的死亡与作用机制不同,NLP1切除信号肽(NLP1∆SP)后表达在甜瓜子叶上,仍可清晰地诱导叶片细胞坏死,但在烟草上已完全失去活性,揭示了NLP1致死两种植物细胞的机制存在本质区别[31]。此外,番茄叶霉病菌()的糖基水解酶CfGH17-1,在所测试的4个Moneymaker番茄系中,有3个番茄系会触发细胞死亡,但在非宿主植物烟草中则不能引起坏死[10]。因此,在研究植物病原菌效应子蛋白的过程中,除利用常规的烟草农杆菌转化体系,还需要建立寄主植物相应的瞬时表达系统才能更好地探索病原菌效应子蛋白的功能。在本研究中,PvGH蛋白虽然都不能异源引起烟草叶片细胞的坏死,但在其寄主植物葡萄叶片中瞬时表达是否会有不同的结果,仍待进一步的深入研究。
4 结论
成功克隆了葡萄霜霉菌的8个,发现其均具有抑制烟草叶片细胞坏死和促进烟草疫霉侵染的能力,且大部分在游动孢子阶段和侵染早期不同程度地上调表达,推测PvGH在侵染早期可以通过抑制寄主的免疫反应参与致病过程。
[1] DEREVNINA L, PETRE B, KELLNER R, DAGDAS Y F, SAROWAR M N, GIANNAKOPOULOU A, DE LA CONCEPCION J C, CHAPARRO-GARCIA A, PENNINGTON H G, VAN WEST P, KAMOUN S. Emerging oomycete threats to plants and animals. Philosophical Transaction of the Royal Society of London, Series B, Biological Sciences, 2016, 371(1709): 20150459.
[2] DEREVNINA L, DAGDAS Y F, DE LA CONCEPCION J C, BIALAS A, KELLNER R, PETRE B, DOMAZAKIS E, DU J, WU C H, LIN X, AGUILERA-GALVEZ C, CRUZ-MIRELES N, VLEESHOUWERS V G, KAMOUN S. Nine things to know about elicitins. New Phytologist, 2016, 212(4): 888-895.
[3] MCGOWAN J FITZPATRICK D A. Genomic, network, and phylogenetic analysis of the oomycete effector arsenal. mSphere, 2017, 2(6): e00408-17.
[4] FEI H, FEIL W S, CHAIN P, LARIMER F, DI BARTOLO G, COPELAND A, LYKIDIS A, TRONG S, NOLAN M, GOLTSMAN E,. Comparison of the complete genome sequences ofpv.B728a and pv.DC3000. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 11064-11069.
[5] COUTINHO P M, ANDERSEN M R, KOLENOVA K, VAN KUYK P A, BENOIT I, GRUBEN B S, TREJO-AGUILAR B, VISSER H, VAN SOLINGEN P, PAKULA T,. Post-genomic insights into the plant polysaccharide degradation potential ofand comparison toand. Fungal Genetics and Biology, 2009, 46(Suppl. 1): S161-S169.
[6] BATTAGLIA E, BENOIT I, VAN DEN BRINK J, WIEBENGA A, COUTINHO P M, HENRISSAT B, DE VRIES R P. Carbohydrate- active enzymes from the zygomycete fungus: a highly specialized approach to carbohydrate degradation depicted at genome level. BMC Genomics, 2011, 12: 38.
[7] VANFOSSEN A L, QZDEMIR I, ZELIN S L, KELLY R M. Glycoside hydrolase inventory drives plant polysaccharide deconstruction by the extremely thermophilic bacterium.Biotechnology and Bioengineering, 2011, 108(7): 1559-1569.
[8] WHITNEY J C, CHOU S, RUSSELL A B, BIBOY J, GARDINER T E, FERRIN M A, BRITTNACHER M, VOLLMER W, MOUGOUS J D. Identification, structure, and function of a novel type VI secretion peptidoglycan glycoside hydrolase effector-immunity pair. The Journal of Biological Chemistry, 2013, 288(37): 26616-26624.
[9] MA Z C, SONG T Q, ZHU L, YE W W, WANG Y, SHAO Y Y, DONG S M, ZHANG Z G, DOU D L, ZHENG X B, TYLER B M, WANG Y C. Aglycoside hydrolase 12 protein is a major virulence factor during soybean infection and is recognized as a PAMP. The Plant Cell, 2015, 27(7): 2057-2072.
[10] ÖKMEN B, BACHMANN D, PIERRE J, DE WIT P J. A conserved GH17 glycosyl hydrolase from plant pathogenic Dothideomycetes releases a DAMP causing cell death in tomato. Molecular Plant Pathology, 2019, 20(12): 1710-1721.
[11] 朱林. 大豆疫霉病原相关模式分子PsXEGl的免疫活性和毒性功能分析[D]. 南京: 南京农业大学, 2016.
ZHU L. Analysis of the immune activity and virulence function of the PAMP PsXEG1 secreted by[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese)
[12] MA Z C, ZHU L, SONG T Q, WANG Y, ZHANG Q, XIA Y Q, QIU M, LIN Y C, LI H Y, KONG L,. A paralogous decoy protectsapoplastic effector PsXEG1 from a host inhibitor. Science, 2017, 355(6326): 710-714.
[13] ZHU W J, RONEN M, GUR Y, MINZ-DUB A, MASRATI G, BEN-TAL N, SAVIDOR A, SHARON I, EIZNER E, VALERIUS O, BRAUS G H, BOWLER K, BAR-PELED M, SHARON A. BcXYG1, a secreted xyloglucanase from, triggers both cell death and plant immune responses. Plant Physiology, 2017, 175: 438-456.
[14] YANG Y K, YANG X F, DONG Y J, QIU D W. Thexylanase BcXyl1 modulates plant immunity. Frontiers in Microbiology, 2018, 9: 2535.
[15] GUI Y J, CHEN J Y, ZHANG D D, LI N Y, LI T G, ZHANG W Q, WANG X Y, SHORT D, LI L, KONG Z Q, BAO Y M, SUBBARAO K V, DAI X F.manipulates plant immunity by glycoside hydrolase 12 proteins in conjunction with carbohydrate- binding module 1. Environmental Microbiology, 2017, 19(5): 1914-1932.
[16] GUI Y J, ZHANG W Q, ZHANG D D, ZHOU L, SHORT D P G, WANG J, MA X F, LI T G, KONG Z Q, WANG B L, WANG D, LI N Y, SUBBARAO K V, CHEN J Y, DAI X F. Aextracellular cutinase modulates plant immune responses. Molecular Plant-Microbe Interactions, 2018, 31(2): 260-273.
[17] YANG Y K, ZHANG Y, LI B B, YANG X F, DONG Y J, QIU D W. Apectate lyase induces plant immune responses and contributes to virulence. Frontiers in Plant Science, 2018, 9: 1271.
[18] ZHANG L, YAN J P, FU Z C, SHI W J, NINKUU V, LI G Y, YANG X F, ZENG H M. FoEG1, a secreted glycoside hydrolase family 12 protein from, triggers cell death and modulates plant immunity. Molecular Plant Pathology, 2021, 22(5): 522-538.
[19] ZHANG L, KARS I, ESSENSTAM B, LIEBRAND T W, WAGEMAKERS L, ELBERSE J, TAGKALAKI P, TJOITANG D, VAN DEN ACKERVEKEN G, VAN KAN J A. Fungal endopolygalacturonases are recognized as microbe-associated molecular patterns by thereceptor-like protein RESPONSIVENESS TO BOTRYTIS POLYGALACTURONASES1. Plant Physiology, 2014, 164(1): 352-364.
[20] RON M, AVNI A. The receptor for the fungal elicitor ethylene- inducing xylanase is a member of a resistance-like gene family in tomato. The Plant Cell, 2004, 16(6): 1604-1615.
[21] YIN Z Y, WANG N, PI L, LI L, DUAN W W, WANG X D, DOU D L.LRR-RLP NbEIX2 mediates the perception of an EIX-like protein from. Journal of Integrative Plant Biology, 2021, 63(5): 949-960.
[22] YIN L, AN Y, QU J J, LI X L, ZHANG Y L, DRY I, WU H, LU J. Genome sequence ofand insight into the pathogenic mechanism. Scientific Reports, 2017, 7: 46553.
[23] 尹玲. 葡萄霜霉病抗性基因结构域及霜霉菌效应分子功能研究[D]. 北京: 中国农业大学, 2015.
YIN L. Functional analysis of domains of grape downy mildew resistance geneand effectors of[D]. Beijing: China Agricultural University, 2015. (in Chinese)
[24] 刘云霄. 葡萄霜霉菌RXLR效应蛋白鉴定及其功能分析[D]. 北京: 中国农业大学, 2018.
LIU Y X. Characterization and functional analysis of grapevine downy mildew RXLR effectors[D]. Beijing: China Agricultural University, 2018. (in Chinese)
[25] CHENG Y L, WU K, YAO J N, LI S M, WANG X J, HUANG L L, KANG Z S. PSTha5a23, a candidate effector from the obligate biotrophic pathogenf. sp., is involved in plant defense suppression and rust pathogenicity. Environmental Microbiology, 2017, 19(5): 1717-1729.
[26] 黄振, 李慧雪, 周宇明, 暴怡雪, 张木清, 姚伟. 甘蔗梢腐病病原菌Nep1-like蛋白的筛选鉴定及功能分析. 植物病理学报, 2022, 52(2): 156-164.
HUANG Z, LI H X, ZHOU Y M, BAO Y X, ZHANG M Q, YAO W. Identification and function analysis of Nep1-like proteins of, the pathogen of sugarcane pokkah boeng disease. Acta Phytopathologica Sinica, 2022, 52(2): 156-164. (in Chinese)
[27] VIDHYASEKARAN P. PAMP signals in plant innate immunity. Springer, 2014.
[28] LACOMME C, SANTA CRUZ S. Bax-induced cell death in tobacco is similar to the hypersensitive response. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(14): 7956-7961.
[29] TAN X W, HU Y Y, JIA Y L, HOU X Y, XU Q, HAN C, WANG Q Q. A conserved glycoside hydrolase family 7 cellobiohydrolase PsGH7a ofis required for full virulence on soybean. Frontiers in Microbiology, 2020, 11: 1285.
[30] 贾玉丽. 大豆疫霉胞外纤维素降解酶PsGH7c的功能初探[D]. 泰安: 山东农业大学, 2021.
JIA Y L. Preliminary studies on the function of extracellular cellulase PsGH7c from[D]. Taian: Shandong Agricultural University, 2021. (in Chinese)
[31] CHEN J L, INOUE Y, KUMAKURA N, MISE K, SHIRASU K, TAKANO Y. Comparative transient expression analyses on two conserved effectors ofreveal their distinct cell death-inducing activities betweenand melon. Molecular Plant Pathology, 2021, 22(8): 1006-1013.
Expression and Functional Analysis of Glycosyl Hydrolase Genes from
PAN FengYing, QU JunJie, LIU LuLu, SUN DaYun, GUO ZeXi, WEI XiaoLi, WEI Shumei, YIN Ling
Key Lab of Guangxi Crop Genetic Improvement and Biotechnology, Guangxi Academy of Agricultural Sciences, Nanning 530007
【Objective】The objective of this study is to clone glycosyl hydrolase genes from(s), analyze their characteristics and expression patterns in infected grape leaves, and the abilities to inhibit or promote programmed cell death (PCD) and affectinfectionin tobacco leaves, so as to provide a theoretical basis for further study on mechanism of regulating host plant immunity.【Method】Eights with full-length were amplified by RT-PCR fromPv5-27 strain. The sequences of these eights and encoded proteins were analyzed by bioinformatics. Yeast signal peptide trap system (SST) was used to verify the secretory activity of the PvGH proteins. The expression pattern ofs during infection grape leaves was detected by qRT-PCR. At the same time, eight PvGH effector proteins were transiently expressed inby-mediated PVX virus expression system. Moreover, their inhibitory abilities to inhibit INF1- and BAX-triggered PCD and to promoteinfection were also analyzed.【Result】The sequences of eights were completely consistent with the prediction in genome sequence, with the length of 1 092 to 1 392 bp, encoding 364-464 amino acids, respectively. The similarity with homologous proteins from other oomycetes was as high as 60.62%-86.36%. None of them had transmembrane domains. Their secondary structures were quite different from each other, and their tertiary structures were less similar to those of other proteins, which showed a very unique tertiary structure. SingalP 5.0 software was used to predict signal peptide of these proteins. It was found that all the PvGH proteins contained signal peptide sequences of 20-26 aa in length. However, the SST verification results showed that PvG09279 and PvG13517 do not have secretion activity. The retention, deletion or replacement of signal peptide sequences of the eight PvGH proteins could inhibit the BAX-triggered PCD and all these PvGH proteins could promoteinfectionin tobacco leaves. It suggests that the potential virulence of eight PvGH effectors does not dependent on the signal peptide. The up-regulated expression ofs in the early stage of infection offurther indicated that PvGHs play an important role in the interaction between pathogen and host.【Conclusion】During downy mildew infection, PvGHs secreted byare involved in pathogenic process by inhibiting the host PTI response.
; glycosyl hydrolase; bioinformatics; function analysis

10.3864/j.issn.0578-1752.2023.05.006
2022-10-21;
2022-11-24
国家自然科学基金(31860493)、中央引导地方科技发展专项资金(桂科ZY21195039)、广西重点研发计划(桂科AB21076001)、“广西八桂青年学者”专项、广西农业科学院基本科研业务专项(2021YT121)
潘凤英,E-mail:251853746@qq.com。通信作者尹玲,E-mail:779335723@qq.com
(责任编辑 岳梅)

