‘鲁丽’ב红1#’苹果杂交群体全基因组KASP标记开发及验证
郑文燕,常源升,何平,何晓文,王森,高文胜,李林光,王海波
‘鲁丽’ב红1#’苹果杂交群体全基因组KASP标记开发及验证

1山东省果树研究所,山东泰安 271000;2山东省农业技术推广中心,济南 250100
【目的】利用‘鲁丽’ב红1#’亲本及杂交后代,开发苹果叶片性状竞争性等位基因特异PCR(kompetitive allele-specific PCR,KASP)标记,为苹果光能高效利用育种提供参考。【方法】以‘鲁丽’和I型红肉苹果‘红1#’及其134个杂交后代的幼嫩叶片为材料,调查叶片性状表型(包括叶片长度、宽度、叶绿素含量、花青苷含量、光合参数和叶绿素荧光参数等)数据。采用Illumina HiSeq 2500测序平台进行全基因组重测序,通过短序列比对软件将测序序列(reads)回贴到苹果参考基因组,利用GATK软件工具包检测单核苷酸多态性(single nucleotide polymorphisms, SNP)标记。【结果】‘鲁丽’和‘红1#’及其134个杂交后代重测序得到有效reads数分别为164 776 660、149 482 876和3 927 370 200。与苹果参考基因组比对率分别为98.77%、98.89%和97.79%。共检测到6 445 766个SNP。经过滤后获得94 208个特异性强,准确性高的SNP位点。对每个SNP进行KASP引物设计,最终开发了5 802个苹果全基因KASP标记。这些KASP标记的多态性信息含量(polymorphism information content,PIC)平均值为0.31,PIC大于0.35的占30.13%。Simpson遗传多样性指数在0.01—0.67,平均每个位点遗传多样性指数为0.53。观测杂合度平均值为0.32。KASP标记所在基因的KEGG功能聚类分析显示,“叶酸介导的一碳代谢途径”是差异基因富集最显著的途径。通过对‘鲁丽’ב红1#’杂交群体24个叶片相关性状进行表型调查,结果显示亲本‘鲁丽’和‘红1#’在叶片净光合速率、气孔导度(Gs)等性状的表型值均存在显著差异。杂交后代表型变异幅度较大,各性状分离广泛。随后对杂交群体叶片性状表型值与KASP标记基因型进行相关性分析,结合KASP标记注释,筛选得到21个与叶片大小、Gs和色素含量性状显著相关的KASP标记。【结论】利用‘鲁丽’和‘红1#’及其134个杂交后代全基因组重测序数据开发了5 802个苹果全基因组KASP标记,获得21个与叶片性状显著相关的KASP标记,为开展标记辅助苹果光能高效利用育种提供了理论参考。
苹果;全基因组重测序;叶片性状;KASP标记
0 引言
【研究意义】苹果(Borkh.)是我国最重要的栽培果树之一,其产量和面积均居世界首位,在乡村产业振兴中发挥了举足轻重的作用[1]。近年来,在国家引导“林果业上山上坡,鼓励利用‘四荒’资源,不与粮争地”的政策背景下,如何提高果树生产力,成为重要课题。目前,生产中主要通过高光效树形改造,构建丰产稳产的叶幕结构,提高光能利用效率,以提高苹果果实品质和产量,而比较不同品种的光合性能,挖掘光能利用潜力,加强光能高效利用品种的选育将为苹果高光效研究提供更多的有效途径,同时对提升苹果产量和质量具有重要意义[2-4]。长期以来,常规杂交仍是苹果育种的主要手段,但童期长,自交不亲和,遗传杂合度高,缺乏对目标性状早期预选方法,导致苹果常规杂交育种周期长、成本高、效率低。随着测序技术日趋成熟,遍布于基因组且易于检测的共显性单核苷酸多态性(single nucleotide polymorphisms,SNP)标记被广泛开发,已成为作物基因分型和遗传研究的基本工具[5-6],其高效、快速、高通量的特点,对苹果育种实现早期选择,提高效率具有重要意义。【前人研究进展】竞争性等位基因特异性PCR(kompetitive allele-specific PCR,KASP)是SNP高通量分型的主流技术,已经广泛应用于作物的遗传图谱构建、基因精细定位、分子标记辅助育种和品种鉴定等[7-9]。在苹果中,已经开发了不同性状的KASP标记,如苹果抗黑星病、抗白粉病和抗绵蚜性状[10]、果实酸含量[11]、水分利用效率相关性状[12]、苹果果实轮纹病抗病性[13]、苹果果皮着色度[14]、硬度脆度保持性[15]、砧木耐盐碱性[16]、苹果虎皮病性状[17]等。利用这些KASP标记可大幅度提高分子检测可视化程度,实现了高通量、低成本应用,推动苹果分子育种发展[18]。叶片光合特性和叶绿素荧光参数是用于评价CO2固定光能利用效率的有用指标[19],鉴定出这些参数的遗传位点,则可以利用标记辅助育种改善光合特性,对进行光能高效利用育种提供参考。【本研究切入点】叶片性状正受到高度重视[20-22],植物叶片形状,叶绿素含量、净光合速率和叶绿素荧光参数等均属于微效多基因控制的数量性状,由复杂的遗传网络调控[23-24]。分子标记技术可快速、准确地鉴定植物数量性状,目前分子标记技术已应用于多种作物叶片性状研究,但尚未获得与苹果叶片性状相关的KASP标记[25]。研究表明,苹果光合效率表现出明显的杂种优势,杂交后代有更强固定大气CO2的能力,更具丰产潜能。通常绿叶净光合速率较高,红叶光合功能期较长,使用净光合速率或光合功能期变异较大的品种杂交,更易于从杂交群体中选出具有光合优势的后代[26-27]。基于此,本研究以‘鲁丽’与I型红肉苹果‘红1#’构建的遗传群体为材料进行叶片性状的KASP标记开发。其中,红肉苹果(f.)作为新疆野苹果()的红肉变型,是苹果育种的重要资源[28-29]。‘红1#’果肉和叶片均为红色。‘鲁丽’苹果通过‘藤木一号’ב皇家嘎啦’杂交育成,其果肉白色,叶片绿色。【拟解决的关键问题】通过对‘鲁丽’与I型红肉苹果‘红1#’构建的遗传群体进行全基因组重测序,开发苹果全基因组KASP标记,筛选出与叶片大小、叶绿素含量、光合参数和叶绿素荧光参数等性状显著相关的KASP标记,为开展标记辅助育种提供理论参考。
1 材料与方法
试验于2021年在山东省果树研究所分子生物学实验室进行。
1.1 材料
‘鲁丽’()ב红1#’(f)杂交组合:该群体于2018年进行杂交,2019年获得杂种实生苗,当年8月份芽接至M9T337矮化自根砧,定植于山东省泰安市岱岳区山东省果树研究所天平湖试验站,常规管理。2020年4月观察苹果叶片颜色,淘汰非红叶的假杂种植株,选取134株F1实生后代连同双亲进行全基因组重测序。图1为亲本和3株典型后代叶片形态照片。

图1 亲本‘鲁丽’和‘红1#’及其3株杂交后代第4—10片叶片形态
1.2 表型测量
1.2.1 叶片形态指标 2021年8月采集136株苹果叶片样品,取当年生枝条由上向下数第5—7片叶子,每株不少于20片成熟叶,采用CID公司生产的手持叶面积仪(CID-202,美国)测量叶片的叶面积、叶长、叶宽和叶片周长。
1.2.2 叶片生理指标
①叶片总花青苷含量测定:取10片上述成熟叶片堆叠在一起,利用打孔器打成10个小叶盘(直径约0.7 cm),称取0.1 g,用液氮研磨成粉末后,在酸化甲醇中(1% HCl-CH3OH)提取苹果叶片总花青素,并通过pH示差法测量总花青素含量[30-31]。pH 1.0的样品稀释液为氯化钾缓冲液(0.025 mol∙L-1、50 mmol∙L-1KCl、150 mmol∙L-1HCl),pH 4.5的样品稀释液为乙酸钠缓冲液(0.4 mol∙L-1、400 mmol∙L-1CH3COONa、240 mmol∙L-1HCl),利用紫外分光光度计OPTIMA SP-3000DB(日本)测量530 nm和700 nm处样品稀释液的吸光度。叶片总花青苷含量计算公式为:
花青苷含量(mg∙g-1)=(A×MW×DF)/ε×W。
式中,A:吸光度,A=(A530-A700) pH 1.0-(A530-A700) pH 4.5;MW:矢车菊素-3-葡萄糖苷的分子量;DF:稀释因子;ε:矢车菊素-3-葡萄糖苷的消光系数;W:样品重量。
②叶片叶绿素含量测定:使用ARNON[32]描述的方法,在80%的丙酮溶液中提取叶绿素。在645 nm和663 nm处测量提取液的吸光度,叶绿素含量计算公式如下:
Chla (mg∙g-1)=(12.7 A645-2.69 A663)×V/1000W;
Chlb (mg∙g-1)=(22.9 A645-4.68 A663)×V/1000W;
Chl (a+b) (mg∙g-1)=(20.2 A645+8.02 A663) ×V/1000W。
式中,Chla:叶绿素a;Chlb:叶绿素b;A:吸光度值;V:80%丙酮萃取液的体积;W:样品重量。
1.2.3 叶绿素荧光特性 使用Porket PEA植物效率分析仪(Hansatech,英国)测定苹果发育枝顶端由上至下第6片功能叶的58个荧光参数。本研究重点选取9个进行KASP标记与性状的关联分析,如PSII最大光能转化效率(v/m),单位反应中心吸收的光能(ABS/RC),单位反应中心耗散的能量(DIo/RC)以及单位反应中心捕获的能量(TRo/RC)等。测定前将叶片遮光暗适应30 min,以确保PSII反应中心完全开放[33]。
1.2.4 叶片光合速率 使用美国PP SYSTEMS公司CIRAS-3便携式光合测定系统测定苹果发育枝顶端由上至下第6片功能叶片的净光合速率(Pn)、细胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)、水分利用效率(WUE)和大气蒸汽压亏缺(VPD)。
1.2.5 表型数据分析 使用SPSS17.0 软件处理表型数据,参照Zheng等[14]对数据进行方差分析、相关分析和描述统计。
1.3 DNA提取和全基因组重测序
取‘鲁丽’和‘红1#’及其134个杂交后代的幼嫩叶片,采用改良的CTAB法提取基因组DNA[10]。采用Illumina HiSeq 2500测序平台进行DNA双末端PE150测序,150 bp读长(Illumina,San Diego,CA,USA)。测序深度:‘鲁丽’32×,‘红1#’30×,杂交后代平均5.13×。采用Burrows-Wheeler Aligner(BWA)软件将重测序获得的测序reads回贴到苹果参考基因组上(https://iris.angers.inra.fr/gddh13/)以进行后续的变异分析[34]。采用GATK软件工具包用于亲本、子代与参考基因组之间SNP和InDel检测,SnpEff软件用于SNP和InDel变异的注释[35-36]。
1.4 KASP标记开发
利用GATK软件工具包进行SNP的鉴定后,经过vcftools软件对SNP过滤分析,首先保留最小基因组覆盖深度>5×,标记质量值>30,最小完整度>0.7,最小等位基因频率0.05,双等位基因的位点;其次,选择多态信息含量(polymorphism information content,PIC)≥0.2,期望杂合度≥0.2的SNP位点;然后,使用RepeatMasker软件标记基因组重复序列,去除重复序列上的SNP标记;最终,截取SNP标记上下游各50 bp序列,然后使用blast软件把序列比对参考基因组,去除比对上2个(包括原有位置)及2个以上位置的标记。对每个SNP标记进行引物设计,使用引物设计软件primer 3.0,只有引物设计成功的SNP位点才认为是合格的KASP标记,使用合格的KASP标记进行下游分析。
1.5 群体遗传结构分析
基于开发的全基因组KASP标记,通过软件包pca3d(版本:0.10)进行主成分分析(principal components analysis,PCA)分析,得到样品的主成分聚类情况[37]。使用软件FastTree(版本:2.1.3)中的极大似然法(maximum likelihood,ML)构建进化树[38]。使用STRUCTURE(版本:2.3.1)软件进行群体遗传结构分析。使用TASSEL软件(版本:5.2.59)计算亲缘关系。使用plink软件(版本:v1.90b6.24)计算HWE。
1.6 KASP标记及其所在的基因注释
采用ANNOVAR软件对KASP标记及其所在基因进行注释。SNP起始位点上游2 kb内为upstream,终止位点下游2 kb内为downstream。利用GO(http:// www.geneontology.org/)和KEGG(http://www.genome. jp/kegg)数据库对KASP标记所在的差异基因进行功能聚类。利用蔷薇科基因组数据库(https://www. rosaceae.org/)和Uniprot数据库(http://www.uniprot. org/)中的功能注释信息查看相应蛋白质的功能。
2 结果
2.1 苹果全基因组重测序和SNP标记的开发
通过Illumina HiSeq 2500测序平台对‘鲁丽’和‘红1#’及其134个杂交F1代进行全基因组重测序,共得到635 Gb有效数据(clean data)。其中,‘鲁丽’得到的有效数据为24.68 Gb,‘红1#’得到的有效数据为22.39 Gb,134个杂交后代总数据量为588.15 Gb。Q30均达到90%以上,GC平均含量为38.61%(表1)。使用短序列比对将有效数据与GDDH13苹果参考基因组序列进行比对[34],计算出两个亲本和杂交后代的测序数据比对率,比对率分别为98.77%、98.89%和97.79%,这也证实了测序数据的质量良好,可以继续对测序结果进行SNP数据分析。
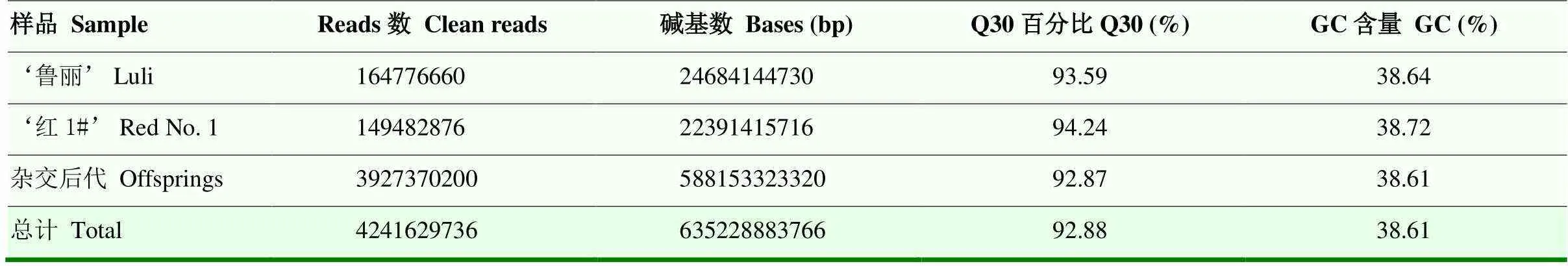
表1 重测序数据汇总表
使用GATK软件[35]检测亲本和134个杂交后代与参考基因组之间的SNP位点,共检测到SNP位点6 445 766个,平均每条染色体含有9 820个,不同染色体的SNP数量在278 600—525 072个,相对应的SNP密度在7 858—11 097个/Mb;总体上,SNP标记的数量与染色体长度呈正相关,例如15号染色体长度最长(54.945 Mb),检测到的SNP数量较多,为525 072个,其SNP密度为9 556个/Mb;在较短的1号染色体上检测到的SNP数量最少,为278 600个,其SNP密度为8 539个/Mb(表2)。

表2 过滤前后染色体上的SNP统计
2.2 苹果SNP标记的筛选和KASP引物设计
为获得特异性强和准确性高的高质量SNP位点,使用Vcftools、RepeatMasker以及blast等软件对全基因组SNP筛选,去除缺失率>30%,PIC<0.2,以及截取SNP上、下游各50 bp序列内还有其他变异的位点后获得94 208个SNP位点。过滤后,SNP个数在3 216—7 431,相对应的SNP密度在89—189个/Mb(表2)。对每个SNP标记进行KASP引物设计,有5 802个SNP位点设计成功,转化成KASP标记,转化后的KASP标记在苹果各条染色体上的分布如图2所示,开发的KASP标记覆盖全部染色体,在各染色体上基本均匀分布,使用这些KASP标记进行后续群体进化及KASP标记注释等分析。

横坐标代表染色体的物理位置,窗口大小为0.1 Mb;纵坐标代表染色体;绿色到红色代表KASP标记密度由低到高的区域
对开发5 802个KASP标记的SNP位点的缺失率、PIC、遗传多样性指数和观测杂合度进行分析(图3)。可以看出,这些SNP位点的缺失率在0—0.29,平均值为0.15;PIC在0.2—0.375,平均值为0.31,PIC>0.35的SNP位点有1 748个,比例为30.13%,其中,Hardy-Weinberg检验≥0.01的SNP位点有717个,表明这些标记具有较高的多态性;Simpson遗传多样性指数在0.01—0.67,平均每个位点遗传多样性指数为0.53;观测杂合度在0.05—1.00,平均值为0.32(图3)。
2.3 杂交群体进化分析
基于开发的5 802个KASP标记对杂交群体分层分析,通过主成分分析,发现最大主成分为2.92,没有主成分能明显区分群体中的杂交后代(图4-A)。随后利用structure软件分析群体的结构,通过最大似然值进行群体划分,结果显示预设的不同祖先个数(K),没有清晰的群体结构存在,划分的亚群间来源共同祖先的关系区分不明显。由于此群体属于杂交群体,有共同的亲本,遗传背景相似,因此,此群体未划分出明显的群体结构。利用系统发育分析描述杂交后代之间的关系,结果显示双亲及其134个杂交后代主要被分成9个主要分支,其中有5个后代与父本‘红1#’组成一个分支,有28个后代与母本‘鲁丽’组成一个分支,关系较密切,而其余后代分为7个分支,表明后代之间存在较强的遗传变异(图4-B)。
2.4 KASP标记注释
利用ANNOVAR软件对开发的全基因组KASP标记进行注释。对KASP-SNP位点的变异类型进行分析,结果表明,SNP变异位点以转换(transition,Ts)为主,约占65.3%,其中A/G和C/T SNP位点分别为30 595和30 523个,颠换(transversion,Tv)约占34.7%,A/T、C/G、A/C、G/T型SNP分别为9 073、5 082 、9 160和9 143个,碱基转换发生频率是颠换发生频率的1.88倍(图5-A)。
对KASP注释位点的基因结构分布区域分析,结果显示,40 264个SNP位点分布在基因间区,约占43.03%,53 312个SNP(占56.97%)分布在基因区。对基因区的SNP位点分析,有15 839个位于转录起始位点上游2 kb区域内,有12 439个SNP位点位于转录终止位点下游2 kb区域内。有13 615个SNP位点分布在内含子区,3 596个SNP位点分布在外显子区,3 401个SNP位点分布在非翻译区。对分布于外显子区的SNP位点进一步分析,有1 462个导致同义突变,2 078个导致非同义变异,44个SNP位点导致翻译提前终止和12个SNP位点导致终止密码子缺失(图5-B)。

图3 5802个SNP位点的缺失率(A)、多态信息含量(B)、遗传多样性指数(C)和观测杂合度(D)变化分布图

A:利用SNP标记对‘鲁丽’ב红1#’及其134个杂交后代进行主成分分析;B:系统发育分析

A:SNP位点变异类型及数目统计;B:SNP位点基因组分布区域注释分析
2.5 KASP标记所在基因注释和富集分析
基于苹果红叶品种‘红1#’和绿叶品种‘鲁丽’及其134个杂交后代全基因组重测序数据,获得了含有KASP-SNP变异位点所在的25 761条基因信息。为全面理解基因功能信息,在GO数据库中注释到19 173个基因(图6),在KEGG数据库注释到5 589个基因,这些基因被聚类到注释到133条代谢途径,参与碳水化合物代谢的基因数最多,为911个(图7)。图8显示的是KEGG聚类中差异基因最显著的前20个途径,其中富集最显著的通路为叶酸介导的一碳代谢途径,富集因子为1.45。其次为泛醌和其他萜类-醌生物合成、卟啉和叶绿素代谢和甘油脂代谢。植物激素信号转导途径富集到的差异基因个数最多为287个。这些代谢物质和代谢通路可为红叶和绿叶光合速率、叶绿素荧光及叶绿素含量差异相关性状的机理研究提供参考。
2.6 与叶片性状相关的KASP标记验证
为了解‘鲁丽’ב红1#’杂交群体的表型多样性,利用SPASS 17.0软件对亲本及杂交后代叶片相关24个性状进行表型描述性统计分析(表3)。结果显示,亲本‘鲁丽’和‘红1#’在叶片净光合速率(Pn)、气孔导度(Gs)、叶绿素含量、花青素含量及单位面积电子传递的量子产额(ETo/CSo)等性状均存在显著差异。杂交后代表型变异幅度较大,各性状分离明显。如表3所示,杂交后代各性状的表型值变异系数(coefficient of variation,CV)变化范围为6.12%— 84.19%,单位反应中心耗散掉的能量(DIo/RC)的CV最高,进一步选择的潜力较大,其次是花青苷,单位面积捕获的光能(TRo/CSo)的CV最低。通过Shapiro-Wilk检验:胞间CO2浓度、Gs、蒸腾速率、叶绿素含量、叶面积等12个性状表型呈正态分布(>0.05),这些性状为等效多基因控制的数量性状。Pn、VPD、水分利用效率、花青素含量等其他12个性状表型分布为偏态分布,表明这些性状可能存在主效基因或非等效基因。

图6 KASP标记所在基因的GO分类注释图

图7 KASP标记所在基因的KEGG富集分析

表3 ‘鲁丽’ב红1#’杂交群体叶片性状表型分析
Ci:胞间CO2浓度;Pn:净光合速率;Gs:气孔导度;Tr:蒸腾速率;VPD:叶面饱和蒸汽压亏缺;WUE:水分利用效率;Vc:羧化效率;Chla:叶绿素a;Chlb:叶绿素b;Chl(a+b):总叶绿素;Anthocyanin:花青苷;Area:叶面积;Length:叶片长度;Width:叶片宽度;Perimeter:叶片周长;v/m:PSII最大光能转化效率;ABS/RC:单位反应中心吸收的光能;DIo/RC:单位反应中心耗散掉的能量;TRo/RC:单位反应中心捕获的能量;ETo/RC;单位反应中心用于电子传递的能量;ABS/CSo:单位面积吸收的光能;DIo/CSo:单位面积热耗散;TRo/CSo:单位面积捕获的光能;ETo/CSo:单位面积电子传递的量子产额。Non与Normal表示苹果叶片不同性状表型值正态性检验结果,前者为非正态分布,后者为正态分布(>0.05)。不同小写字母表示双亲叶片性状表型值之间的差异显著性(=0.05)。下同
Ci: Intercellular CO2concentration; Pn: Net photosynthetic rate; Gs: Stomatal conductance; Tr: Transpiration rate; VPD: Vapor pressure deficit; WUE: Water use efficiency; Vc: Ccarboxylation efficiency; Chla: Chlorophyll a; Chlb: Chlorophyll b; Chl(a+b): Total chlorophyll contents;v/m: Maximum quantum yield of PSII; ABS/RC: Aabsorption flux per reaction center; DIo/RC: Heat dissipation per reaction center; TRo/RC: Maximal trapping flux per reaction center; ETo/RC: Quantum yield of electron transport per reaction center; ABS/CSo: Absorption flux per cross-section; DIo/CSo: Heat dissipation per cross-section; TRo/CSo: Maximal trapping flux per cross-section; ETo/CSo: Quantum yield of electron transport per cross-section. Non and Normal represent non normally distributed and normally distributed for phenotypes of different traits, respectively (>0.05). Different lowercase letters indicate significance between phenotype values of the leaf traits in both parents (=0.05). The same as below

Y轴代表各个KEGG通路的名称;X轴代表富集因子。点的颜色代表q值的大小,点的大小代表注释在该通路中基因的数目。q值的大小由点的颜色表示,q值越小,颜色越接近红色,并且每个途径涉及的基因的数量由点的大小表示
结合136个苹果全基因组重测序数据,全基因组KASP标记以及基因功能注释,对所有的KASP-SNP位点进行筛选。首先去除双亲基因型缺失,双亲间无差异及杂交后代不分离的SNP位点,随后根据20个性状表型数据,分别选出20株表型极端高的单株和20株极端低的单株,将SNP标记在极端表型中验证,并对基因型进行卡方检测,将卡方检验显著的标记在38份种质资源中验证,最终开发了叶片性状相关的KASP-SNP标记21个。其中与叶片长度相关的KASP标记4个,定位于9和15号染色体上;与叶片宽度相关的KASP标记4个,定位于5、11和14号染色体上。与叶面积相关的KASP标记有1个,位于15号染色体。与气孔导度相关的KASP标记有2个,位于10号染色体上。与叶绿素a和叶绿素b相关的KASP标记有3个,位于11和16号染色体上,与花青素相关的KASP标记有1个,位于11号染色体上。与单位面积电子传递的量子产额相关的KASP标记有7个,位于5和14号染色体上(表4)。
利用这些KASP标记所在的基因及其功能注释,筛选出与叶片叶绿素含量、气孔导度性状相关的候选基因。叶绿素b称为光合作用的天线色素吸收光能。本研究中筛选到与叶片叶绿素b含量相关的KASP标记。该标记的A/C突变在母本‘鲁丽’苹果中的基因型为A:C,在父本‘红1#’中的基因型为A:A。在其杂交后代叶绿素b含量极端高和极端低的各20个单株中A:A与A:C基因型分离比分别为8﹕6和15﹕1,2值为5.593,卡方检验达到显著水平(20.05,1=3.84)。通过KASP标记所在的基因功能注释,发现该标记位于乙烯响应因子ERF转录因子家族的启动子上。
气孔导度是衡量植物与气体间平衡的重要指标。本研究中,筛选到与气孔导度性状相关的KASP标记定位在苹果8和10号染色体上,分别位于和启动子上。在启动子上T/C突变的KASP标记,在父本‘红1#’中基因型为T:C,在母本‘鲁丽’中的基因型为T:T,在各20株极端后代中T:T与T:C的分离比分别为8﹕9和14﹕3,2值为4.636,卡方检验达到显著水平(20.05,1=3.84)。在启动子上的A/G突变KASP标记,在父本‘红1#’中基因型为G:G,在母本‘鲁丽’中的基因型为A:G,在各20株极端后代中A:G与G:G的分离比分别为0:15和6:7,2值为8.811,卡方检验达到极显著水平(20.01,1=6.63)。

表4 叶片性状相关的21个KASP标记
*:<0.05; **:<0.01.20.05,1=3.84,20.01,1=6.63,20.05,2=5.99,20.01,2=9.21
3 讨论
3.1 叶片相关性状的候选基因预测
基于‘鲁丽’和‘红1#’及其134个杂交后代全基因组测序数据开发了全基因组KASP标记,KEGG聚类分析发现共有5 589个基因被聚类到133个途径,其中差异基因富集最显著的通路为叶酸介导的一碳代谢途径。植物激素信号转导途径富集到的差异基因个数最多。叶酸作为一碳单位的主要供体,在酶反应中起到转运一碳单位的作用,在植物中还参与了木质素的形成以及光呼吸作用[39-40]。光呼吸与叶片光合作用密切相关,叶绿素b称为光合作用的天线色素吸收光能。本研究中筛选到与叶片叶绿素b含量相关的KASP标记位于乙烯响应因子ERF转录因子家族的启动子上。ERF转录因子已经被报道参与叶绿素合成与降解过程,如甜橙和,苹果都能结合叶绿素降解相关结构基因和启动子,使和上调表达,从而促进果实或果皮叶绿素的降解[41-43]。
气孔是光合作用吸收空气中CO2的主要入口,气孔导度(Gs)是衡量气体通过气孔的难易程度的重要指标,Gs越大,气孔阻力越小,CO2和水汽等越易通过气孔进行交换。目前普遍认为脱落酸含量与气孔运动有关[44],赤霉素[45]、油菜素内酯[46]等植物激素在调节气孔运动中也发挥重要作用,且大部分与ABA产生互作,共同调节Gs的变化。本研究中,通过KASP标记与性状的相关性分析,结合基因功能注释,重点筛选得到2个影响Gs的候选基因和。GID1(Gibberellin insensitive dwarf 1)为GA信号转导的受体。BSK1(BR-signaling kinase 1)为BR信号转导过程中的重要成员。根据双亲‘鲁丽’(32×)和‘红1#’(30×)的重测序数据,笔者实验室建立了‘鲁丽’ב红1#’的高密度遗传连锁图谱,利用该连锁图谱对苹果叶片相关性状进行了QTL定位,共定位了57个QTLs(数据未列出)。本研究中开发的KASP标记所在的基因、和均位于与叶片叶绿素b含量或气孔导度相关的QTL区间,但是这些候选基因启动子发生的突变是否影响其转录活性及影响叶片叶绿素含量或气孔导度还需要进一步验证。
3.2 苹果叶片花青素对光合作用的影响
新疆野苹果(Roem)是现代栽培苹果(Borkh)的祖先种,遗传多样性丰富[47]。本研究所用的I型红肉苹果‘红1#’属于新疆红肉苹果(),是新疆野苹果的变型,其枝叶都是红色[28]。启动子上的小卫星重复序列调控红肉苹果果实着色的分子机制已有广泛研究[48-50],但是苹果叶片色泽发育过程的分子机制至今尚不清楚。通过对红叶桃的叶片着色性状进行遗传规律分析,发现桃叶片着色是一个质量性状,红叶对绿叶为显性,且该位点定位在桃基因组第6染色体上[51]。对该区间内的进行表达量检测,发现在红叶桃中表达量显著高于绿叶,过量表达能使桃叶片变红,表明该基因控制桃叶片着色性状,但是使在红叶桃中表达量升高的变异位点还需探索[52]。
本研究中,‘红1#’叶片为红叶,‘鲁丽’为绿叶,杂交后代的叶片全部表现为红叶,表明苹果叶片的着色性状是显性基因控制的质量性状。与苹果中的转录因子(MDP0000573302)具有较高的相似性,与控制果肉着色的为同源基因,但是在这些基因上未找到与苹果叶片花青苷含量显著相关的遗传变异位点。通过全基因组重测序,在11号染色体上获得与苹果叶片花青苷含量相关的KASP3343标记。该标记在20株花青苷含量极高的株系和20株极端低的株系中,3种基因型CC:CA:AA的比值分别为12﹕2﹕4和3﹕2﹕13,2检验达到极显著水平。因此推测11号染色体上可能存在调控苹果叶片色泽发育的位点,结合11号染色体上存在与互作的基因以提高苹果果皮着色度的研究结果[14],为进一步探讨苹果叶片色泽发育提供了参考。
已有研究表明,叶片变红主要是由于叶片中产生了花青素类的红色色素,新合成花青素需要消耗能量,可能使叶片光合效率降低[53-54]。然而本研究中,与绿叶相比,‘红1#’叶片的PSⅡ的最大捕光效率(v/m)较高,单位反应中心吸收的光能(ABS/RC)和单位反应中心捕获的能量(TRo/RC)显著增加,而用于电子传递的能量(ETo/RC)显著降低。v/m与非光化学猝灭有关,秋季叶片处于高光强下时,叶片捕获的光能大于光能利用率,使叶片受到光损伤胁迫,而花青苷对叶片光合组织起到了光保护作用[55-56]。同时,红叶通过减少用于电子传递的能量(ETo/RC)以缓解高光强对叶片的伤害。另外,红叶中含有较高的黄酮类抗氧化化合物,这些物质对叶片起到了光保护作用[54,57]。
4 结论
利用‘鲁丽’‘红1#’及其134个杂交后代全基因组重测序数据与参考基因组比对,共检测到6 445 766个SNP位点。经过滤后,将5 802个SNP位点成功转化成KASP标记。通过对杂交群体叶片性状表型值与KASP标记基因型进行相关性分析,结合KASP标记注释,获得了21个与叶片大小、气孔导度和色素含量性状显著相关的KASP标记。
[1] 王金政, 毛志泉, 丛佩华, 吕德国, 马锋旺, 任小林, 束怀瑞, 李保华, 郭玉蓉, 郝玉金, 姜远茂, 张新忠, 杨欣, 曹克强, 赵政阳, 韩振海, 霍学喜, 魏钦平. 新中国果树科学研究70年: 苹果. 果树学报, 2019, 36(10): 1255-1263.
WANG J Z, MAO Z Q, CONG P H, LÜ D G, MA F W, REN X L, SHU H R, LI B H, GUO Y R, HAO Y J, JIANG Y M, ZHANG X Z, YANG X, CAO K Q, ZHAO Z Y, HAN Z H, HUO X X, WEI Q P. Fruit scientific research in New China in the past 70 years: Apple. Journal of Fruit Science, 2019, 36(10): 1255-1263. (in Chinese)
[2] 李民吉, 张强, 李兴亮, 周贝贝, 杨雨璋, 张军科, 周佳, 魏钦平. 4种矮化砧木对再植苹果幼树生长、产量和品质的影响. 中国农业科学, 2020, 53(11): 2264-2271. doi: 10.3864/j.issn.0578-1752.2020.11.012.
LI M J, ZHANG Q, LI X L, ZHOU B B, YANG Y Z, ZHANG J K, ZHOU J, WEI Q P. Effects of 4 dwarfing rootstocks on growth, yield and fruit quality of ‘fuji’ sapling in apple replant orchard. Scientia Agricultura Sinica, 2020, 53(11): 2264-2271. doi: 10.3864/j.issn. 0578-1752.2020.11.012. (in Chinese)
[3] 陈学森, 韩明玉, 苏桂林, 刘凤之, 过国南, 姜远茂, 毛志泉, 彭福田, 束怀瑞. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见. 果树学报, 2010, 27(4): 598-604.
CHEN X S, HAN M Y, SU G L, LIU F Z, GUO G N, JIANG Y M, MAO Z Q, PENG F T, SHU H R. Discussion on today’s world apple industry trends and the suggestions on sustainable and efficient development of apple industry in China. Journal of Fruit Science, 2010, 27(4): 598-604. (in Chinese)
[4] 赵德英, 程存刚, 仇贵生, 董雅凤, 张彩霞, 李壮, 张怀江, 胡国君, 厉恩茂. 苹果高质量发展技术创新途径. 中国果树, 2021(8): 1-5.
ZHAO D Y, CHENG C G, QIU G S, DONG Y F, ZHANG C X, LI Z, ZHANG H J, HU G J, LI E M. Technological innovation approach of high quality development in apple industry. China Fruits, 2021(8): 1-5. (in Chinese)
[5] GANAL M W, POLLEY A, GRANER E M, PLIESKE J, WIESEKE R, LUERSSEN H, DURSTEWITZ G. Large SNP arrays for genotyping in crop plants. Journal of Biosciences, 2012, 37(5): 821-828.
[6] THOMSON M J. High-throughput SNP genotyping to accelerate crop improvement. Plant Breeding and Biotechnology, 2014, 2(3): 195-212.
[7] SEMAGN K, BABU R, HEARNE S, OLSEN M. Single nucleotide polymorphism genotyping using kompetitive allele specific PCR (KASP): Overview of the technology and its application in crop improvement. Molecular Breeding, 2014, 33(1): 1-14.
[8] MACKAY I J, BANSEPT-BASLER P, BARBER T, BENTLEY A R, COCKRAM J, GOSMAN N, GREENLAND A J, HORSNELL R, HOWELLS R, O’SULLIVAN D M, ROSE G A, HOWELL P J. An eight-parent multiparent advanced generation inter-cross population for winter-sown wheat: Creation, properties, and validation. G3: Genes|Genomes|Genetics, 2014, 4(9): 1603-1610.
[9] PHAM A T, HARRIS D K, BUCK J, HOSKINS A, SERRANO J, ABDEL-HALEEM H, CREGAN P, SONG Q J, BOERMA H R, LI Z L. Fine mapping and characterization of candidate genes that control resistance toK. Hara in two soybean germplasm accessions. PLoS ONE, 2015, 10(5): e0126753.
[10] BAUMGARTNER I O, KELLERHALS M, COSTA F, DONDINI L, PAGLIARANI G, GREGORI R, TARTARINI S, LEUMANN L, LAURENS F, PATOCCHI A. Development of SNP-based assays for disease resistance and fruit quality traits in apple (×Borkh.) and validation in breeding pilot studies. Tree Genetics & Genomes, 2016, 12(35): 1-21.
[11] JIA D J, SHEN F, WANG Y, WU T, XU X F, ZHANG X Z, HAN Z H. Apple fruit acidity is genetically diversified by natural variations in three hierarchical epistatic genes:,and. The Plant Journal: for Cell and Molecular Biology, 2018, 95(3): 427-443.
[12] WANG H B, ZHAO S, MAO K, DONG Q L, LIANG B W, LI C, WEI Z W, LI M J, MA F W. Mapping QTLs for water-use efficiency reveals the potential candidate genes involved in regulating the trait in apple under drought stress. BMC Plant Biology, 2018, 18(1): 136.
[13] SHEN F, HUANG Z Y, ZHANG B G, WANG Y, ZHANG X, WU T, XU X F, ZHANG X Z, HAN Z H. Mapping gene markers for apple fruit ring rot disease resistance using a multi-omics approach. G3: Genes|Genomes|Genetics, 2019, 9(5): 1663-1678.
[14] ZHENG W Y, SHEN F, WANG W Q, WU B, WANG X, XIAO C, TIAN Z D, YANG X L, YANG J, WANG Y, WU T, XU X F, HAN Z H, ZHANG X Z. Quantitative trait loci-based genomics-assisted prediction for the degree of apple fruit cover color. The Plant Genome, 2020, 13(3): e20047.
[15] WU B, SHEN F, WANG X, ZHENG W Y, XIAO C, DENG Y, WANG T, HUANG Z Y, ZHOU Q, WANG Y, WU T, XUE F X, HAN Z H, ZHANG X Z. Role ofandnatural variations in apple flesh firmness/crispness retainability and development of QTL-based genomics-assisted prediction. Plant Biotechnology Journal, 2021, 19(5): 1022-1037.
[16] LIU J, SHEN F, XIAO Y, FANG H C, QIU C P, LI W, WU T, XU X F, WANG Y, ZHANG X Z, HAN Z H. Genomics-assisted prediction of salt and alkali tolerances and functional marker development in apple rootstocks. BMC Genomics, 2020, 21(1): 550.
[17] MILLER B A, TILLMAN J R, HOWARD N P, KOSTICK S A, EVANS K M, LUBY J J. A DNA test for high incidence of soft scald and soggy breakdown postharvest disorders inBorkh. Molecular Breeding, 2021, 41: 57.
[18] WINFIELD M, BURRIDGE A, ORDIDGE M, HARPER H, WILKINSON P, THOROGOOD D, COPAS L, EDWARDS K, BARKER G. Development of a minimal KASP marker panel for distinguishing genotypes in apple collections. PLoS One, 2020, 15(11): e0242940.
[19] SIMKIN A J, LÓPEZ-CALCAGNO P E, RAINES C A. Feeding the world: improving photosynthetic efficiency for sustainable crop production. Journal of Experimental Botany, 2019, 70(4): 1119-1140.
[20] JIN F L, ZHANG F W, YUE X, LI M, AO X X. Correlation between leaf size and fruit quality of Kiwi. Agricultural Basic Science and Technology, 2016, 17 (11): 2472-2488.
[21] MAEDA H, AKAGI T, TAO R. Quantitative characterization of fruit shape and its differentiation pattern in diverse persimmon () cultivars. Scientia Horticulturae, 2018, 228: 41-48.
[22] 江锡兵, 章平生, 杨龙, 吴强, 吴聪连, 吴小云, 龚榜初, 赖俊声. 板栗和锥栗种间杂交F1代叶片表型及其遗传变异研究. 园艺学报, 2019, 46(11): 2129-2142.
JIANG X B, ZHANG P S, YANG L, WU Q, WU C L, WU X Y, GONG B C, LAI J S. Genetic variation of leaf phenotypic traits in F1 progeny of interspecific cross betweenandActa Horticulturae Sinica, 2019, 46(11): 2129-2142. (in Chinese)
[23] 张小猜, 赵政阳, 樊红科, 党志国, 张志敏. 苹果杂种F1代叶片性状分离及早期选择研究. 西北农业学报, 2009, 18(5): 228-231.
ZHANG X C, ZHAO Z Y, FAN H K, DANG Z G, ZHANG Z M. Study on the leaf trait segregation of apple hybrid seedlings and application in pre-selection. Acta Agriculturae Boreali-Occidentalis Sinica, 2009, 18(5): 228-231. (in Chinese)
[24] 刘遵春, 苗卫东, 刘大亮, 陈学森. 苹果叶片相关性状的QTL定位及其遗传效应分析. 西北植物学报, 2014, 34(3): 481-487.
LIU Z C, MIAO W D, LIU D L, CHEN X S. Identification of quantitative trait loci associated with leaf traits in apple and analysis of their genetic effects. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(3): 481-487. (in Chinese)
[25] 张兴平, 钱前, 张嘉楠, 邓兴旺, 万建民, 徐云碧. 分子植物育种助推南繁种业转型升级. 中国农业科学, 2021, 54(18): 3789-3804. doi: 10.3864/j.issn.0578-1752.2021.18.001.
ZHANG X P, QIAN Q, ZHANG J N, DENG X W, WAN J M, XU Y B. Transforming and upgrading off-season breeding in Hainan through molecular plant breeding. Scientia Agricultura Sinica, 2021, 54(18): 3789-3804. doi: 10.3864/j.issn.0578-1752.2021.18.001. (in Chinese)
[26] 吕天星, 伊凯, 刘志, 王冬梅, 闫忠业, 姜孝军, 王铭. 苹果实生苗叶片叶绿素含量遗传趋势. 西北农业学报, 2013, 22(12): 91-95.
Lü T X, YI K, LIU Z, WANG D M, YAN Z Y, JIANG X J, WANG M. Genetic trend of leaf chlorophyll content in apple seedling plant. Acta Agriculturae Boreali-Occidentalis Sinica, 2013, 22(12): 91-95. (in Chinese)
[27] 姜卫兵, 庄猛, 沈志军, 宋宏峰, 曹晶, 李刚. 不同季节红叶桃、紫叶李的光合特性研究. 园艺学报, 2006, 33(3): 577-582.
JIANG W B, ZHUANG M, SHEN Z J, SONG H F, CAO J, LI G. Study on the photosynthetic characteristics of red-leaf peach and purpleleaf plum in different seasons. Acta Horticulturae Sinica, 2006, 33(3): 577-582. (in Chinese)
[28] CHEN X S, FENG T, ZHANG Y M, HE T M, FENG J R, ZHANG C Y. Genetic diversity of volatile components in Xinjiang Wild Apple (). Journal of Genetics and Genomics, 2007, 34(2): 171-179.
[29] VAN NOCKER S, BERRY G, NAJDOWSKI J, MICHELUTTI R, LUFFMAN M, FORSLINE P, ALSMAIRAT N, BEAUDRY R, NAIR M F, ORDIDGE M. Genetic diversity of red-fleshed apples (). Euphytica, 2012, 185: 281-293.
[30] GIUSTI M M, WROLSTAD R E. Characterization and measurement of anthocyanins by UV-visible spectroscopy. Current Protocols in Food Analytical Chemistry, 2001, (1): F1.2.1-1.2.13.
[31] HOSSEINIAN F S, LI W D, BETA T. Measurement of anthocyanins and other phytochemicals in purple wheat. Food Chemistry, 2008, 109(4): 916-924.
[32] ARNON D I. Copper enzymes in isolated chloroplasts. polyphenoloxidase in beta. Plant Physiology, 1949, 24(1): 1-15.
[33] DOBRÁNSZKI J, MENDLER-DRIENYOVSZKI N. Cytokinin- induced changes in the chlorophyll content and fluorescence ofapple leaves. Journal of Plant Physiology, 2014, 171(16): 1472-1478.
[34] LI H, DURBIN R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics, 2009, 25(14): 1754-1760.
[35] MCKENNA A, HANNA M, BANKS E, SIVACHENKO A, CIBULSKIS K, KERNYTSKY A, GARIMELLA K, ALTSHULER D, GABRIEL S, DALY M, DEPRISTO M A. The Genome Analysis Toolkit: A MapReduce framework for analyzing next-generation DNA sequencing data. Genome Research, 2010, 20(9): 1297-1303.
[36] CINGOLANI P, PLATTS A, WANG L L, COON M, NGUYEN T, WANG L, LAND S J, LU X Y, RUDEN D M. A program for annotating and predicting the effects of single nucleotide polymorphisms, SnpEff: SNPs in the genome ofstrain w1118; iso-2; iso-3. Fly, 2012, 6(2): 80-92.
[37] WEINER J, PARIDA S K, MAERTZDORF J, BLACK G F, REPSILBER D, TELAAR A, MOHNEY R P, ARNDT-SULLIVAN C, GANOZA C A, FAÉ K C, WALZL G, KAUFMANN S H E. Biomarkers of inflammation, immunosuppression and stress with active disease are revealed by metabolomic profiling of tuberculosis patients. PLoS ONE, 2012, 7(7): e40221.
[38] PRICE M N, DEHAL P S, ARKIN A P. FastTree 2: Approximately maximum-likelihood trees for large alignments. PLoS ONE, 2010, 5(3): e9490.
[39] HANSON A D, ROJE S. One-carbon metabolism in higher plants. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 119-137.
[40] CHRISTENSEN K E, MACKENZIE R E. Mitochondrial one-carbon metabolism is adapted to the specific needs of yeast, plants and mammals. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2006, 28(6): 595-605.
[41] YIN X R, XIE X L, XIA X J, YU J Q, FERGUSON I B, GIOVANNONI J J, CHEN K S. Involvement of an ethylene response factor in chlorophyll degradation during citrus fruit degreening. The Plant Journal: for Cell and Molecular Biology, 2016, 86(5): 403-412.
[42] LI S J, XIE X L, LIU S C, CHEN K S, YIN X R. Auto- and mutual-regulation between two CitERFs contribute to ethylene- induced citrus fruit degreening. Food Chemistry, 2019, 299: 125163.
[43] HAN Z Y, HU Y N, LV Y D, ROSE J K C, SUN Y Q, SHEN F, WANG Y, ZHANG X Z, XU X F, WU T, HAN Z H. Natural variation underlies differences in ETHYLENE RESPONSE FACTOR17 activity in fruit peel degreening. Plant Physiology, 2018, 176(3): 2292-2304.
[44] SHI Y, LIU X N, ZHAO S S, GUO Y. The PYR-PP2C-CKL2 module regulates ABA-mediated actin reorganization during stomatal closure. The New Phytologist, 2022, 233(5): 2168-2184.
[45] 曹柳青. 赤霉素对冬枣光合作用和内源激素的影响[D]. 保定: 河北农业大学, 2006.
CAO L Q. Effects of gibberellin on photosynthesis and endogenous hormones of Dongzao jujube [D]. Baoding: Hebei Agricultural University, 2006. (in Chinese)
[46] AHAMMED G J, GAO C J, OGWENO J O, ZHOU Y H, XIA X J, MAO W H, SHI K, YU J Q. Brassinosteroids induce plant tolerance against phenanthrene by enhancing degradation and detoxification inL. Ecotoxicology and Environmental Safety, 2012, 80: 28-36.
[47] 王延玲. 新疆红肉苹果红色发育机理的初步研究[D]. 泰安: 山东农业大学, 2011.
WANG Y L. Preliminary study on the red development mechanism of Xinjiang red meat apple [D]. Tai’an: Shandong Agricultural University, 2011. (in Chinese)
[48] CHAGNÉ D, CARLISLE C M, BLOND C, VOLZ R K, WHITWORTH C J, ORAGUZIE N C, CROWHURST R N, ALLAN A C, ESPLEY R V, HELLENS R P, GARDINER S E. Mapping a candidate gene () for red flesh and foliage colour in apple. BMC Genomics, 2007, 8: 212.
[49] ESPLEY R V, BRENDOLISE C, CHAGNÉ D, KUTTY-AMMA S, GREEN S, VOLZ R, PUTTERILL J, SCHOUTEN H J, GARDINER S E, HELLENS R P, ALLAN A C. Multiple repeats of a promoter segment causes transcription factor autoregulation in red apples. The Plant Cell, 2009, 21(1): 168-183.
[50] UMEMURA H, OTAGAKI S, WADA M, KONDO S, MATSUMOTO S. Expression and functional analysis of a novelgene, MdMYB110a_JP, responsible for red flesh, not skin color in apple fruit. Planta, 2013, 238(1): 65-76.
[51] LAMBERT P, PASCAL T. Mapping Rm2 gene conferring resistance to the green peach aphid (Sulzer) in the peach cultivar ‘Rubira®’. Tree Genetics and Genomes, 2011, 7(5): 1057-1068.
[52] 周晖. 桃花青苷着色及原花青素合成的调控机制研究[D]. 武汉: 中国科学院研究生院(武汉植物园), 2015.
ZHOU H. Mechanisms underlying the regulation of anthocyanin coloration and proanthocyanidin synthesis in peach [D]. Wuhan: Wuhan Botanical Garden, Chinese Academy of Sciences, 2015. (in Chinese)
[53] GOULD K S, VOGELMANN T C, HAN T, CLEARWATER M J. Profiles of photosynthesis within red and green leaves of. Physiologia Plantarum, 2002, 116(1): 127-133.
[54] HATIER J H B, CLEARWATER M J, GOULD K S. The functional significance of black-pigmented leaves: Photosynthesis, photoprotection and productivity in‘Nigrescens’. PLoS ONE, 2013, 8(6): e67850.
[55] HUGHES N M, MORLEY C B, SMITH W K. Coordination of anthocyanin decline and photosynthetic maturation in juvenile leaves of three deciduous tree species. The New Phytologist, 2007, 175(4): 675-685.
[56] 周振翔, 李志康, 陈颖, 王志琴, 杨建昌, 顾骏飞. 叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响. 中国农业科学, 2016, 49(19): 3709-3720. doi: 10.3864/j.issn.0578-1752.2016.19.004
ZHOU Z X, LI Z K, CHEN Y, WANG Z Q, YANG J C, GU J F. Effects of reduced chlorophyll content on photoinhibition and photosynthetic electron transport in rice leaves. Scientia Agricultura Sinica, 2016, 49(19): 3709-3720. doi: 10.3864/j.issn.0578-1752.2016. 19.004. (in Chinese)
[57] 李卫星, 杨舜博, 何智冲, 金飚. 植物叶色变化机制研究进展. 园艺学报, 2017, 44(9): 1811-1824.
LI W X, YANG S B, HE Z C, JIN B. Research advances in the regulatory mechanisms of leaf coloration. Acta Horticulturae Sinica, 2017, 44(9): 1811-1824. (in Chinese)
Development and Validation of KASP Markers Based on a Whole- Genome Resequencing Approach in a Hybrid Population of Luli × Red No. 1
ZHENG WenYan1, CHANG YuanSheng1, HE Ping1, HE XiaoWen1, WANG Sen1, GAO WenSheng2, LI LinGuang1, WANG HaiBo1
1Shandong Institute of Pomology, Tai’an 271000, Shandong;2Shandong Agricultural Technology Extension Center, Ji’nan 250100
【Objective】A series of kompetitive allele-specific PCR (KASP) markers for traits related to apple leaves were developed to provide a reference to effectively utilize light in apple breeding using a Luli ×Red No. 1 hybrid population as materials. 【Method】This study investigated the leaf trait phenotypic data (including leaf length, width, contents of chlorophyll and anthocyanin, photosynthetic rate and chlorophyll fluorescence parameters) of Luli, a type I red-fleshed apple, Red No. 1, and 134 hybrids. Whole-genome resequencing was conducted on an Illumina HiSeq 2500 platform. The clean sequencing reads were mapped to the apple reference genome using BWA software. GATK software was used to identify single nucleotide polymorphisms (SNPs). 【Result】A total of 164 776 660, 149 482 876, and 3 927 370 200 clean reads were obtained by whole-genome resequencing from Luli, Red No. 1 and 134 hybrid individuals, respectively. The data were aligned to the reference genome sequences with mapping rates of 98.77%, 98.89%, and 97.79%, respectively. A total of 6 445 766 SNPs were identified. The SNPs were then filtered, and 94 208 accurate and high-quality SNPs were selected for subsequent KASP primer design. Finally, 5 802 KASP markers were developed based on a high-throughput whole-genome resequencing approach. The average polymorphism information content (PIC) of these KASP markers was 0.31, and there were 30.13% PICs>0.35. The Simpson genetic diversity index ranged from 0.01 to 0.67, with an average value of 0.53. The mean observed heterozygosity was 0.32. A Kyoto Encyclopedia of Genes and Genomes enrichment analysis of the genes for KASP marker revealed that “one carbon pool by folate” was the most significant pathway. An analysis of the phenotypic data of leaf-related traits in both the parents and individuals from the Luli ×Red No. 1 cross showed that there were significant differences in the phenotypic values of leaf net photosynthetic rate, stomatal conductance (Gs) and other traits between the parents Luli and Red No. 1. The F1 generation exhibited a wide phenotypic variation, and the most traits segregated extensively. Α detailed study of the phenotypic data of leaf traits of the hybrid population with the genotype and annotations of the KASP markers finally resulted in the development of 21 KASP markers, which was correlated with leaf-related traits, including chlorophyll content, Gs and leaf length and width.【Conclusion】Use of the whole-genome resequencing data of Luli, Red No. 1 and 134 hybrid individuals resulted in the development of 5 802 KASP. A total of 21 of these KASP markers significantly correlated with leaf traits, which provided a theoretical reference for the high utilization of light energy in apple breeding.
apple; whole-genome resequencing; leaf-related traits; KASP marker

10.3864/j.issn.0578-1752.2023.05.010
2022-04-26;
2022-07-14
山东省自然科学基金(ZR2021MC045)、山东省农业良种工程项目(2021LZGC024)、国家自然科学基金(31901976)、泰山产业领军人才工程项目(LJNY202026)、国家现代农业产业技术体系建设专项资金(CARS-27)
郑文燕,E-mail:1587493148@qq.com。通信作者王海波,E-mail:wanghaibo992@126.com。通信作者李林光,E-mail:llg6536@163.com
(责任编辑 赵伶俐)

