微创Ivor-Lewis食管切除术治疗Siewert Ⅰ型食管胃交界部腺癌的效果研究
董 威,武凌云
(秭归县中医医院,湖北 秭归 443600)
Siewert 分型将食管胃交界部癌根据肿瘤的中心位置分为三种类型。其中Siewert Ⅰ型的食管胃交界部腺癌患者其临床5 年和10 年生存率均较其他两个类型高[1]。临床在治疗Siewert Ⅰ型食管胃交界部腺癌时常使用左胸食管切除术,但创伤较大[2]。Ivor-Lewis 食管切除术是经右胸入路的食管癌治疗方法,虽然手术需要通过胸腔和腹腔两个体腔进行操作,但如果使用微创手术设备,则可大大减少手术创伤[3]。本文就微创Ivor-Lewis 食管切除术治疗Siewert Ⅰ型食管胃交界部腺癌的效果进行研究。
1 资料与方法
1.1 一般资料
从2020 年1 月—2020 年12 月期间在我院接受手术治疗的Siewert Ⅰ型食管胃交界部腺癌患者中筛选研究对象,筛选标准包括纳入标准和排除标准。纳入标准:1)病理活检证实存在Siewert Ⅰ型食管胃交界部腺癌。2)可耐受手术和麻醉。3)临床TNM 分期≤Ⅲ期。4)认知功能正常。5)临床资料齐全。6)知晓研究内容,且同意参与研究。排除标准:1)存在手术禁忌证。2)存在癌细胞转移。3)术前接受过新辅助治疗。4)存在精神疾病。5)存在免疫系统疾病。6)存在凝血功能异常。共获得研究对象80 例,随机分入对照组或观察组。对照组:男性36 例(组内占90.00%),女性4 例(组内占10.00%);年龄最大的70 岁、最小的47 岁,平均(60.99±5.26)岁;BMI 最小的18、最大的27,平均(24.79±2.73);TNM 分期Ⅰ期11 例(组内占27.50%),TNM 分期Ⅱ期17 例(组内占42.50%),TNM 分期Ⅲ期12 例(组内占30.00%);合并肺气肿2 例(组内占5.00%),合并高血压3 例(组内占7.50%),合并糖尿病3 例(组内占7.50%),合并心脏病4 例(组内占10.00%)。观察组:男性35 例(组内占87.50%),女性5 例(组内占12.50%);年龄最大的70 岁、最小的49 岁,平均(61.11±5.01)岁;BMI 最小的18、最大的27,平均(24.81±2.77);TNM 分期Ⅰ期11 例(组内占27.50%),TNM 分期Ⅱ期17 例(组内占42.50%),TNM 分期Ⅲ期12 例(组内占30.00%);合并肺气肿2 例(组内占5.00%),合并高血压4 例(组内占10.00%),合并糖尿病3 例(组内占7.50%),合并心脏病4 例(组内占10.00%)。两组的以上资料相比,P>0.05。
1.2 方法
对照组采取传统的左胸食管切除术治疗,观察组采取微创Ivor-Lewis 食管切除术治疗。左胸食管切除术的实施方法:取右侧卧位,在左胸做切口,长度为18 cm。游离食管,清扫淋巴结。切开膈肌,游离胃,清扫腹部淋巴结。制作管状胃,离断食管。使用吻合器吻合食管和胃。用可吸收缝线加固吻合口。取出切除的组织,冲洗胸腔,留置引流管,关闭切口。微创Ivor-Lewis 食管切除术的实施方法:患者平卧,行单腔气管插管。在脐下1 指处做1 cm 切口,建立气腹,压力维持在12 mmHg。在左侧锁骨中线与脐水平位置做0.5 cm 切口,右侧锁骨中线与脐水平线交界点处做0.5 cm 切口,左侧锁骨中线与肋弓交界点外侧1 指处做1 cm 切口,右侧锁骨中线与肋弓交界点外侧1 指处做1 cm 切口。游离胃右动脉,并在幽门上方3 cm 的位置将其结扎、切断。将胰腺上缘的后腹膜切开,清扫肝总动脉前方、脾动脉起始部位的淋巴结和脂肪。将胃左静脉结扎、切断。向上清扫腹腔的淋巴结和脂肪。将胃左动脉双重结扎、切断。切开胃肠韧带,在胃后间隙切开胃结肠韧带、胃脾韧带。沿胰腺上缘切开后腹膜至左侧膈肌脚上缘。向食管裂孔内游离存在病灶的食管。从幽门上3 cm 开始,向胃底部制作管状胃,管状胃的宽度为3 ~5 cm。缝合胃切缘止血,关闭切口。之后更改体位为左侧卧位。在腋后线与第六肋间交界位置做5 cm 切口,在腋前线第四肋间做1 cm 切口,在肩胛前缘线与第五肋间做1 cm切口。建立气胸,压力维持在6 ~8 mmHg。沿喉返神经清扫淋巴结和脂肪至胸廓入口处。切开食管后壁纵膈胸膜。游离食管至膈裂孔处。在膈上3 cm 处游离、结扎胸导管,游离肺韧带。清扫隆突下淋巴结和脂肪。悬吊上段食管,并游离气管食管韧带。用吻合器在胸廓入口5 cm 处离断食管。上提管状胃至胸廓入口处,使用吻合器吻合食管和胃。用可吸收缝线加固吻合口。取出切除的组织,冲洗胸腔,留置引流管,关闭切口。
1.3 观察指标
1)术中临床指标,包括术中的出血量、正常食管切除长度、淋巴结清扫总数、胸腔淋巴结清扫数、腹腔淋巴结清扫数。2)术后康复指标,包括第一天胸腔引流量、胸腔引流时间、术后排气时间、术后住院时间。3)术后并发症发生情况。常见术后并发症包括吻合口漏、肺部感染、心律失常、切口感染等。4)临床转移和复发情况。术后随访18 个月,对患者的肝转移、肺转移、腹膜后淋巴结转移、纵膈淋巴结转移等转移情况进行观察。术后随访18 个月,对患者的复发情况进行观察,常见复发位置为吻合口。
1.4 统计学分析
用SPSS 25.0 统计学软件进行数据分析,计量资料用均数± 标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ² 检验。P<0.05为差异有统计学意义。
2 结果
2.1 术中临床指标
两组术中临床指标相比,观察组术中出血量少,正常食管切除长度长,淋巴结清扫总数、胸腔淋巴结清扫数、腹腔淋巴结清扫数多,手术时间长,P<0.05。见表1。
表1 术中临床指标(± s)
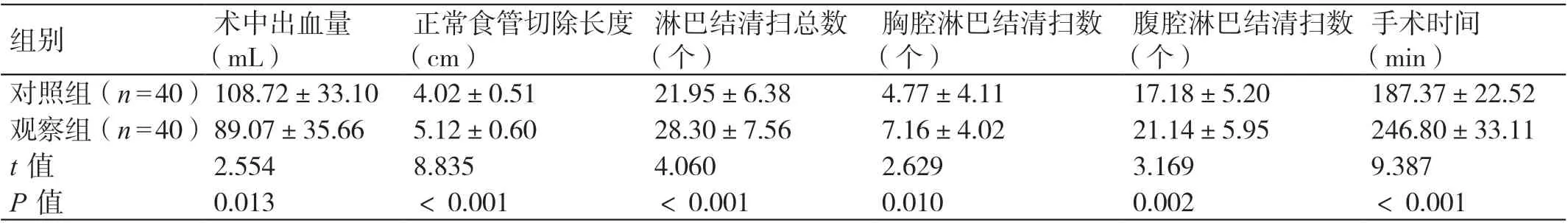
表1 术中临床指标(± s)
手术时间(min)对照组(n=40)108.72±33.10 4.02±0.51 21.95±6.38 4.77±4.11 17.18±5.20 187.37±22.52观察组(n=40)89.07±35.66 5.12±0.60 28.30±7.56 7.16±4.02 21.14±5.95 246.80±33.11 t 值 2.554 8.835 4.060 2.629 3.169 9.387 P 值 0.013 <0.001 <0.001 0.010 0.002 <0.001组别 术中出血量(mL)正常食管切除长度(cm)淋巴结清扫总数(个)胸腔淋巴结清扫数(个)腹腔淋巴结清扫数(个)
2.2 术后康复指标
两组术后康复指标相比,观察组术后第一天胸腔引流量少,胸腔引流时间、术后排气时间、术后住院时间短,P<0.05。见表2。
表2 术后康复指标(± s)
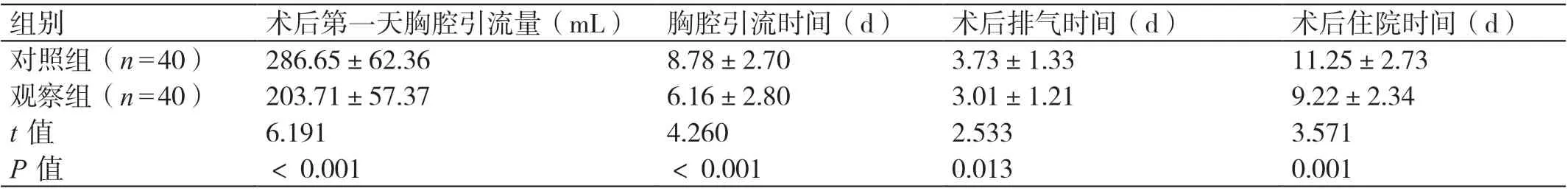
表2 术后康复指标(± s)
组别 术后第一天胸腔引流量(mL) 胸腔引流时间(d) 术后排气时间(d) 术后住院时间(d)对照组(n=40) 286.65±62.36 8.78±2.70 3.73±1.33 11.25±2.73观察组(n=40) 203.71±57.37 6.16±2.80 3.01±1.21 9.22±2.34 t 值 6.191 4.260 2.533 3.571 P 值 <0.001 <0.001 0.013 0.001
2.3 术后并发症发生情况
两组术后并发症发生情况相比,吻合口漏发生率、肺部感染发生率、心律失常发生率、切口感染发生率和术后并发症总发生率均无显著差异,P>0.05。见表3。
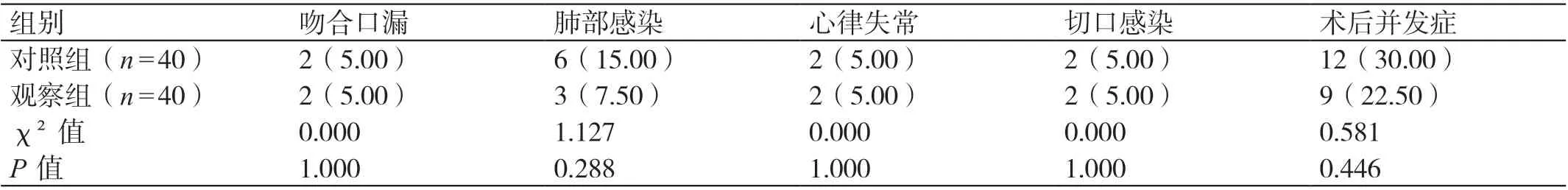
表3 术后并发症发生情况[例(%)]
2.4 临床转移和复发情况
两组临床转移情况相比,肝转移发生率、肺转移发生率、腹膜后淋巴结转移发生率、纵膈淋巴结转移发生率和转移总发生率均无显著差异,P>0.05。两组临床复发情况相比,吻合口复发发生率无显著差异,P>0.05。见表4。
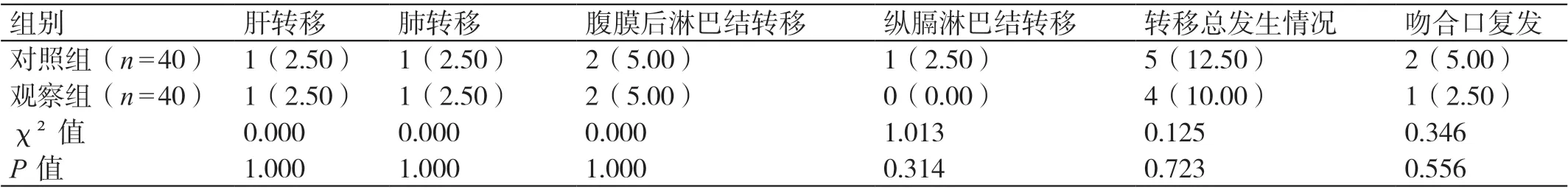
表4 临床转移和复发情况[例(%)]
3 讨论
近年来,食管胃交界部癌的发病率有所增加[4]。东南亚和东亚是食管胃交界部癌新发患者的集中地区,临床常见的类型为腺癌[5]。食管胃交界部腺癌在发病的早期无明显的症状,部分患者可感到咽部有疼痛等不适,随着病情的发展,患者会出现吞咽困难、食道梗阻、胸骨后疼痛等症状[6]。食管胃交界部腺癌的发生主要与反流性食管炎、吸烟、饮酒、饮食习惯不良等有关[7]。不良饮食习惯包括摄入较多粗糙的食物、香肠、腊肉、泡菜、酸菜等。临床主要将食管胃交界部腺癌分为Siewert Ⅰ型、Siewert Ⅱ型、Siewert Ⅲ型。Siewert Ⅰ型的肿瘤中心在食管齿状线上方1 ~5 cm。Siewert Ⅱ型的肿瘤中心在食管齿状线上方1 cm 以下至下方2 cm 以上。Siewert Ⅲ型的肿瘤中心在食管齿状线下方2 ~5 cm[8]。在流行特点上,Siewert Ⅰ型主要见于男性群体,Siewert Ⅱ型发病的男女比例值较小,Siewert Ⅲ型发病的男女比例值最小(但男性发病率仍然明显高于女性)[9]。
Ivor-Lewis 食管切除术需要先进行腹腔操作,然后再进行右胸操作。胸腔和腹腔操作都采取开放性手术的方法,会对患者造成非常大的创伤,不仅术后并发症发生率高,而且康复速度较慢,容易发生各种意外[10-11]。目前临床在治疗食管胃交界部腺癌时,可以使用术前新辅助治疗来提高患者的生存率,而使用胸腔镜联合腹腔镜的微创手术则可有效减小手术对患者造成的创伤[12-13]。这是临床治疗食管胃交界部腺癌的重要突破。腔镜手术不仅能够减小手术创伤,而且在手术过程中可以获得良好的视野,从而进行更为精细的操作,降低喉返神经损伤的概率,防止对其他脏器造成不必要的创伤[14-15]。
本研究中为对照组采取传统的左胸食管切除术治疗,为观察组采取微创Ivor-Lewis 食管切除术治疗,并将术中临床指标、术后康复指标、并发症发生情况、临床转移和复发情况进行对比,结果显示观察组在部分指标方面获得了更优的效果。由此可见,微创Ivor-Lewis 食管切除术治疗Siewert Ⅰ型食管胃交界部腺癌虽然手术时间较长,但能减少术中出血量,比较彻底地清扫淋巴结,促进患者术后快速康复,且安全性和远期疗效均良好。

