血清AT-Ⅲ、G6PD检测对新生儿败血症早期诊断及预后评估的价值分析
陈明娟,冯 琳
新生儿败血症是一种感染性疾病,病情较为严重且凶险,主要是因为新生儿免疫系统未成熟,免疫功能较低,容易受到病原体的感染。新生儿败血症的主要病原体是葡萄球菌、革兰阴性菌等,病原体侵入新生儿血液后就会迅速生长,造成婴儿全身性炎症反应,是新生儿死亡及残疾的重要原因之一[1-3]。新生儿败血症发病率较高,1976-2016年间,每10万儿童中约有70例严重败血症患儿,病死率11%~19%[4]。现今医疗条件及生活环境得到了很大的提升,但新生儿败血症仍会对新生儿生命造成一定的危害,对新生儿败血症的早期诊断及预后评估仍是研究重点。凝血功能紊乱及纤溶系统紊乱与新生儿败血症密切相关,当感染因素侵入患儿体内后会引发机体产生大量炎症因子,对组织、器官造成损害的同时会激活机体凝血系统,引起大量凝血因子消耗、微血栓形成等,造成机体纤溶系统紊乱。抗凝血酶-Ⅲ(antithrombin-Ⅲ,AT-Ⅲ)是由肝脏合成的一类丝氨酸蛋白酶抑制剂,是体内平衡凝血过程、维持纤溶系统稳定的重要物质,与新生儿败血症密切相关[5]。6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏会导致新生儿患溶血性贫血,研究表明G6PD缺乏时,红细胞膜的非酶糖基化产物对于机体来说是异物,能够刺激机体产生大量抗体,引发巨噬细胞对红细胞的吞噬功能,造成大量红细胞被破坏,使机体发生溶血现象,造成患儿免疫功能低下,更易受到外界环境的感染,进而引发败血症[6]。本研究通过对新生儿败血症患儿血清中AT-Ⅲ、G6PD表达水平进行检测和分析,为新生儿败血症的早期诊断及预后评估提供依据。现作报道。
1 资料与方法
1.1 一般资料 选择2018年1月至2020年1月在我院确诊的新生儿败血症患儿77例为败血症组,胎龄30~45周,平均胎龄(36.6±4.5)周;日龄5~19 d;男39例,女38例。其中血培养阳性确诊为败血症26例,为金黄色葡萄球菌5例,大肠埃希菌7例,表皮葡萄球菌3例,缓症链球菌1例,溶血葡萄球菌2例,鲍曼不动杆菌4例,肺炎克雷伯菌4例;血培养阴性51例,均符合新生儿败血症临床诊断标准。同时选取我院确诊的细菌感染非败血症患儿50例为感染组,胎龄30~46周,平均胎龄(36.9±6.1)周;日龄4~17 d;男27例,女23例;原发疾病为皮肤感染6例,肺炎15例,感染性腹泻9例,脐炎9例,尿路感染11例。同时选取本院健康新生儿100例为对照组,胎龄32~46周,平均胎龄(37.1±3.8)周;日龄6~20 d;男52例,女48例。3组研究对象胎龄、日龄、性别等一般资料均具有可比性。败血症组患儿均入院治疗及观察,以住院第1天开始,根据4个月内生存及死亡情况再分为生存组和病死组。
纳入标准:(1)新生儿败血症的诊断标准参考《新生儿败血症诊断及治疗专家共识》[7];(2)感染组为肺炎、脐炎等所致的细菌感染;(3)各组新生儿临床资料完整。排除标准:(1)有肝脏疾病、恶性肿瘤、糖尿病及先天性疾病;(2)先天性畸形;(3)具有遗传性代谢类疾病。本研究经医院道德伦理委员会批准通过,所有样品采集均取得患儿家属知情同意并签字,符合《世界医学协会赫尔辛基宣言》。
1.2 主要试剂与仪器 全自动生化分析仪,购自美国Bio-Rad公司;AT-Ⅲ及G6PD测定试剂盒,均购自于美国Invitrogen公司。
1.3 方法
1.3.1 血液样品预处理 败血症组在发生临床可疑败血症症状、体征时,感染组在入院4 h时,对照组空腹状态,采集所有受试者空腹静脉血3~5 mL,置于特定离心管中,枸缘酸钠抗凝,室温静置20 min,3 000 g 4 ℃离心10 min,收集血清装至特定离心管中,于-80 ℃冰箱保存备用,用于后续相应指标的测定。发色底物法检测血清AT-Ⅲ的表达水平,简易比色法检测血清中G6PD的表达水平。
1.3.2 临床指标测定 采用全自动生化分析仪测定被试者血清中降钙素原(procalcitonin,PCT)、白细胞计数(white blood cell,WBC),并记录新生儿疾病危重评分(neonatal critical illness score,NCIS)。
1.4 统计学方法 采用t检验、χ2检验、方差分析和q检验,ROC法分析血清AT-Ⅲ、G6PD对新生儿败血症及患儿不良预后的诊断价值,新生儿败血症不良预后的影响因素采用logistic回归分析。
2 结果
2.1 3组新生儿血清AT-Ⅲ、G6PD水平的比较 与对照组相比,感染组、败血症组血清AT-Ⅲ、G6PD表达水平均显著降低,且败血症组血清AT-Ⅲ、G6PD表达水平低于感染组,差异均有统计学意义(P<0.01)(见表1)。

表1 3组受试者血清AT-Ⅲ、G6PD表达水平比较
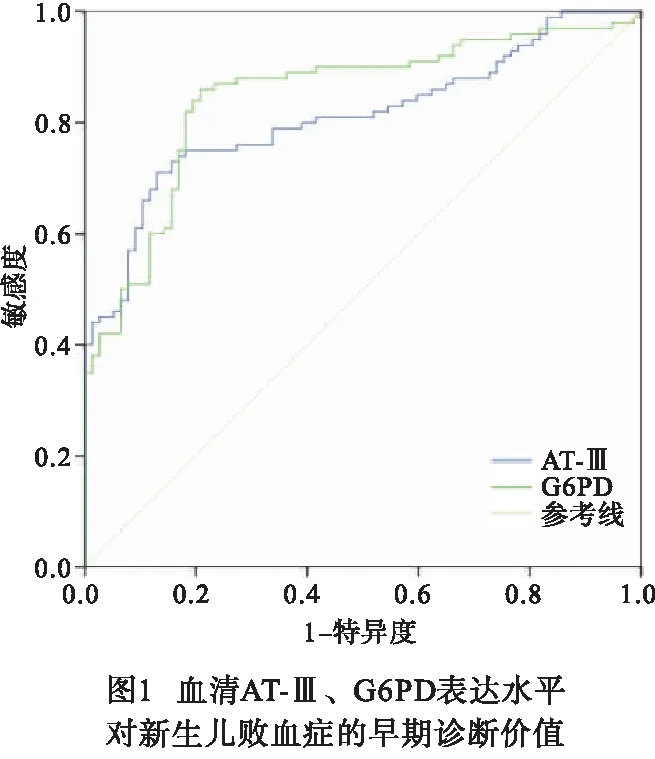
2.2 血清AT-Ⅲ、G6PD表达水平对新生儿败血症的早期诊断价值 ROC曲线结果表明,血清AT-Ⅲ表达水平早期诊断新生儿败血症曲线下面积(AUC)为0.811(95%CI:0.748~0.874),敏感度为75.0%,特异性为81.8%,截断值为51.35%;血清G6PD表达水平早期诊断新生儿败血症的AUC为0.847(95%CI:0.788~0.905),敏感度为86.0%,特异性为79.2%,截断值为16.54 U/g Hb(见图1)。
2.3 新生儿败血症生存组与病死组间指标比较 败血症患儿中病死10例,生存67例,病死率12.98%,生存组与病死组性别、胎龄、日龄、出生体质量之间比较差异均无统计学意义(P>0.05);与生存组相比,病死组新生儿血清中PCT、WBC水平均升高(P<0.05),NCIS评分、AT-Ⅲ及G6PD表达水平均降低,差异均有统计学意义(P<0.05~P<0.01)(见表2)。
2.4 logistic回归分析新生儿败血症病死的危险因素 将是否发生新生儿败血症病死作为因变量,以血清中PCT、WBC、AT-Ⅲ、G6PD表达水平作为自变量进行多因素logistic回归分析,结果显示AT-Ⅲ和G6PD表达水平降低是新生儿败血症病死的危险因素(P<0.05),血清中PCT、WBC新生儿败血症患儿预后不良无相关性(P>0.05)(见表3)。

表2 生存组与病死组新生儿败血症患儿间指标比较
分组nWBC/(×109/L) NCIS评分/分AT-Ⅲ/%G6PD/(U/g Hb)生存组6712.57±3.8687.01±11.0546.29±9.3015.87±4.69病死组1024.63±5.9657.96±10.1239.97±8.468.73±2.02t—8.547.832.034.73P—<0.01<0.01<0.05<0.01
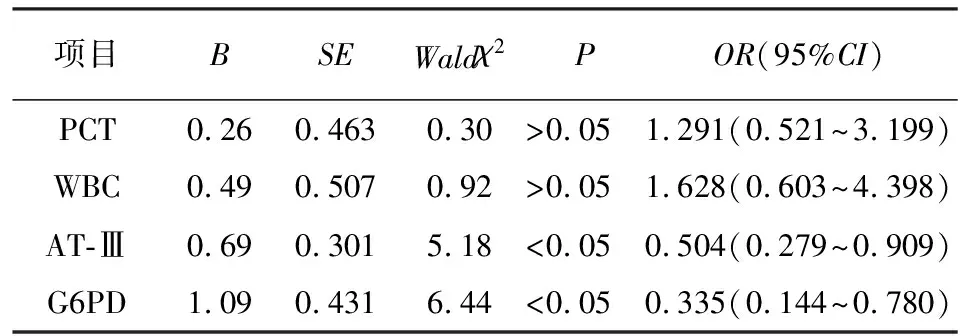
表3 新生儿败血症病死发生的logistic回归分析
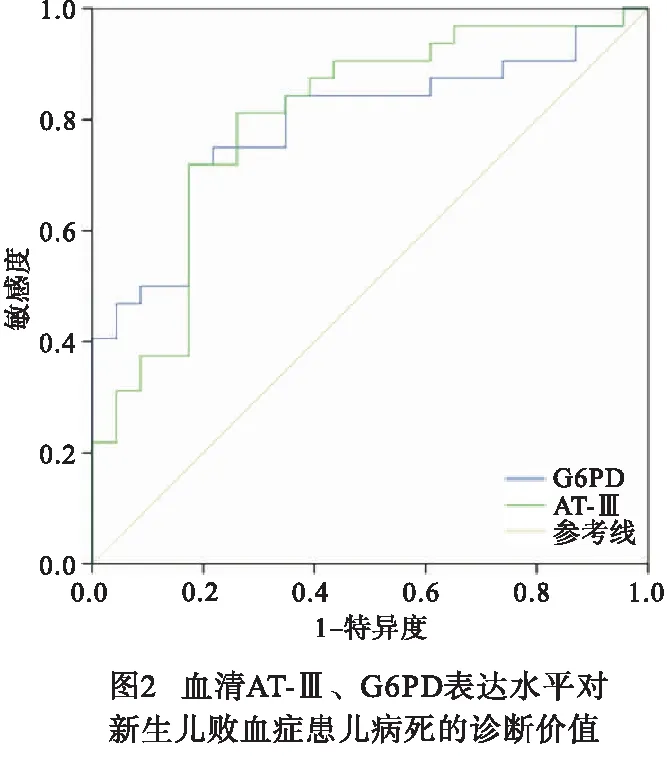
2.5 血清AT-Ⅲ、G6PD对新生儿败血症病死的诊断价值 血清AT-Ⅲ水平诊断新生儿败血症病死AUC为0.791(95%CI:0.671~0.911),敏感度为75.0%,特异性为78.3%,截断值为39.11%;血清G6PD表达水平诊断新生儿败血症病死的AUC为0.800(95%CI:0.678~0.922),敏感度为81.3%,特异性为73.9%,截断值为13.37 U/g Hb(见图2)。
3 讨论
新生儿是一类特殊人群,其免疫器官未发育成熟,对外界病菌的抵抗能力较弱,易受到外界细菌、病毒等的感染,进而引起全身的炎症反应,甚至导致死亡。新生儿败血症是新生儿常见的危重病之一,常因早产、抗菌药物使用不当、新生儿脐带等处理不恰当引起。致病菌侵入新生儿血液后,常会导致新生儿全身感染,引发脑膜炎、感染性休克等,严重时可引起死亡。目前关于新生儿败血症的诊断多为血培养,用抗生素进行治疗,随着新生儿败血症的发病率、致残率及死亡率的升高,对其进行早期诊断及良好预后评估仍是研究的热点[8-10]。
新生儿败血症与患儿体内的凝血系统密切相关,易引发弥散性血管内凝血[11],随着病原体引起患儿全身炎症反应的不断恶化,患儿体内的凝血系统发生紊乱,引起血管内微血栓的形成、纤溶系统紊乱、血管内凝血,进而损伤患儿的器官及组织,威胁患儿生命健康[12]。AT-Ⅲ在人体内起着重要的抗凝调节作用,对凝血系统的平衡起到重要的作用,可反映人体凝血纤溶系统的状态,苏畅等[12]研究发现真菌感染性败血症患儿的AT-Ⅲ低于健康新生儿,并认为与患儿的凝血纤溶系统紊乱密切相关。G6PD与人体溶血功能密切相关,G6PD缺乏时,会造成患儿红细胞大量坏死,引发急性溶血[13],资料显示新生儿溶血症常并发败血症,患有溶血症的新生儿因其红细胞损坏而引起免疫功能的障碍,加上新生儿各器官尚未发育成熟,使新生儿更易受到细菌及病毒的感染,进而引起败血症[14]。本研究中新生儿感染组与败血症组血清AT-Ⅲ、G6PD表达水平均显著低于对照组,其中败血症组血清AT-Ⅲ、G6PD表达水平亦低于感染组,此结果与苏畅等[12]研究结果一致。WBC是新生儿败血症诊断标准中的非特异性检查指标之一,对于新生儿败血症的诊断及预后评估具有一定辅助价值[7];当机体受到严重感染时,血液中PCT含量会迅速升高[15],而NCIS评分对于评估新生儿败血症危重程度具有一定的帮助[16]。本研究中77例新生儿败血症患儿病死10例,预后不良率为12.98%,与生存组相比,病死组新生儿血清中PCT、WBC水平均显著升高,NCIS评分、血清中AT-Ⅲ及G6PD表达水平均显著降低,提示血清AT-Ⅲ及G6PD水平亦与新生儿败血症患儿的预后有关。ROC曲线及多因素logistic回归分析结果表明,AT-Ⅲ和G6PD表达水平是新生儿败血症病死的保护因素,诊断新生儿败血症预后不良的灵敏度及特异性较高,当新生儿患儿AT-Ⅲ表达<39.11%、血清G6PD表达<13.37 U/g Hb时,患儿发生不良预后的可能较大,需尽早采取措施预防不良事件的发生。

