槲皮素对过氧化氢诱导的人脐静脉内皮细胞AKT/mTOR信号通路及自噬的影响
宋 涛,官泽宇,徐 超,朱二畅,蔡 瑶,卢 冉,余朝文
血管内皮细胞在维持心血管系统的正常生理功能发挥重要作用,它通过分泌一系列血管活性物质调节血液的自分泌、内分泌或旁分泌,改善血流、血管壁张力、血管生成和炎症。由于其屏障功能,血管内皮细胞更容易受到物理或化学危险因素诱导的损伤[1],因此血管内皮细胞损伤发生在许多临床事件中,包括血管生成、动脉粥样硬化、血栓形成、高血压和心力衰竭[2]。
自噬可以消除不必要或功能失调的细胞器和细胞。众所周知,伴随轻链 3 Ⅰ/Ⅱ (LC3 Ⅰ/Ⅱ)和Beclin 1变化的自噬功能障碍与许多疾病的发病机制有关。LC3 Ⅱ是LC3的脂化形式,已被证明是哺乳动物的自噬体标志物,并已应用于研究多种炎症条件下的自噬[3]。 Beclin 1是自噬体成核复合物的关键成分,可促进LC3转化和 LC3 斑点的形成。自噬被破坏,通常会发生LC3 Ⅱ和Beclin 1 的表达降低[4]。一些证据表明,血管内皮细胞的自噬功能障碍导致内皮功能障碍和血管稳态破坏,进一步导致心血管疾病的发病机制[5]。此外,哺乳动物雷帕霉素靶蛋白 (mTOR) 是细胞代谢的主要调节因子,是调节自噬的关键分子[6]。
槲皮素是一种黄酮类化合物,主要存在于中药材。研究[7]表明,槲皮素具有抗氧化、抗癌和抗炎特性,重要的是,槲皮素已被证明可以保护人脐静脉内皮细胞(HUVECs)过氧化氢引起的损伤。而且槲皮素已被证实可在高糖水平可以介导部分细胞系自噬[8],且氧化应激损伤的线粒体、细胞可通过机体内的自噬降解提高抗氧化能力,增强细胞活力。因此,槲皮素有可能通过介导自噬来防止内皮细胞损伤。本研究主要分析了槲皮素是否可以保护 HUVECs 免受过氧化氢诱导的损伤并识别可能涉及的机制。
1 材料与方法
1.1 细胞、试药及仪器 HUVEC(编号7-1074)购自齐氏生物科技有限公司。槲皮素(成都瑞芬思生物科技有限公司,批号:180704);兔抗人LC3 Ⅰ/Ⅱ(批号:ABC929)、AKT(批号:SAB4500797)、mTOR(批号:T2949)、β-actin(批号:A3653)抗体、HRP标记的羊抗兔IgG二抗(美国,Sigma公司)。 CBl50 CO2细胞培养箱(德国Binder公司);酶标仪(美国,BioTek)。
1.2 方法
1.2.1 细胞培养 HUVEC在RPMI-1640培养基中培养,辅以10%胎牛血清和1%青霉素/链霉素,采用5% CO2在37 ℃培养箱中孵育,并进行细胞传代。
1.2.2 分组、建模和给药 HUVEC以8×103个细胞/孔的密度接种在 96孔板中。细胞贴壁后,分为对照组(RPMI-1640 培养基),H2O2组(200 μmol/L H2O2),阳性对照组(200 μmol/L H2O2+50 μg/mL 维生素 E),槲皮素组 (200 μmol/L H2O2+30、15、7.5 μmol/L槲皮素)。
1.2.3 MTT检测 HUVEC 以 8×103个细胞/孔的密度接种在96孔板中。 细胞贴壁后,依据实验分组给药,48 h后将 MTT(20 μL 0.5 mg/μL PBS溶液)加入每个孔中,并将板置于37 ℃下孵育4 h。然后介质去除并在每个孔中加入 DMSO(150 μL),维持10 min以溶解紫色甲臜晶体。使用酶标仪570 μm 处测定吸光度。基于以下公式计算细胞活力的百分比:细胞活力(%)=A570给药组/A570对照组×100%。
1.2.4 MDC染色 MDC 染色用作自噬囊泡的示踪剂,阳性细胞在其核区周围着色,所有酸性液泡被染色。对数生长期的细胞接种在24孔板中,设置对照组(RPMI-1640 培养基),H2O2组(200 μmol/L H2O2),槲皮素组 (200 μmol/L H2O2+30、15、7.5 μmol/L槲皮素),培养48 h制作细胞爬片,细胞爬升片制备过夜进行组处理,37 ℃水浴中加入0.05 mmol/L MDC处理 15 min,用 PBS 洗涤 3 次,然后用 4% 多聚甲醛固定 15 min。 然后在抗荧光淬灭载玻片上进行荧光显微镜避光观察。
1.2.5 Western blotting实验 对数生长期的细胞接种在6孔板中,设置对照组(RPMI-1640 培养基),H2O2组(200 μmol/L H2O2),槲皮素组 (200 μmol/L H2O2+30、15、7.5 μmol/L槲皮素),培养48 h。将细胞在含有1 mmol/L PMSF的 RIPA缓冲液裂解。收集上清液并通过BCA蛋白质测定试剂盒检测蛋白质浓度。在8%~15%梯度SDS-PAGE凝胶上加载和分离蛋白质,然后转移到PVDF膜。用脱脂牛奶封闭非特异性结合位点1 h后,将膜与LC3B(1∶1 000)、p-AKT(1∶2 000)、AKT(1∶2 000)、p-mTOR(1∶2 000)、mTOR(1∶2 000)、β-actin(1∶1 000)一抗一起孵育过夜。然后将膜与辣根过氧化物酶标记的二抗在室温下以1∶5 000 稀释度孵育1 h。条带通过WD-9413B成像系统检测,ImageJ 软件(1.51a 版)用于分析条带密度。
1.2.6 3-MA对槲皮素诱导自噬的影响 实验设置对照组、H2O2组(200 μmol/L H2O2),槲皮素组 (200 μmol/L H2O2+30 μmol/L槲皮素),槲皮素(200 μmol/L H2O2+30 μmol/L槲皮素)+3-MA(10 mmol/L 3-MA)组,处理48 h,每孔添加20 μL MTT,孵育 4 h。570 nm测量光密度,Western blotting检测相关蛋白水平。
1.3 统计学方法 采用单因素方差分析和LSD-t检验。
2 结果
2.1 槲皮素对细胞活力的影响 与对照组比较,H2O2组细胞吸光度值明显降低(P<0.01),提示模型建立成功。与H2O2组比较,阳性对照组、30、15、7.5 μmol/L槲皮素组吸光度值明显增加(P<0.01)(见表1)。
2.2 槲皮素对细胞中自噬体的影响 与H2O2组比较,槲皮素能增加HUVEC中MDC染色标记的荧光颗粒,并伴随槲皮素浓度的上调明显增加(P<0.01)(见图1、表2)。
2.3 槲皮素对自噬相关蛋白的影响 槲皮素能促进HUVEC中自噬蛋白LC3 Ⅱ/LC3 Ⅰ水平表达(P<0.01),降低p-AKT/AKT、p-mTOR/mTOR水平(P<0.01)(见图2、表3)。
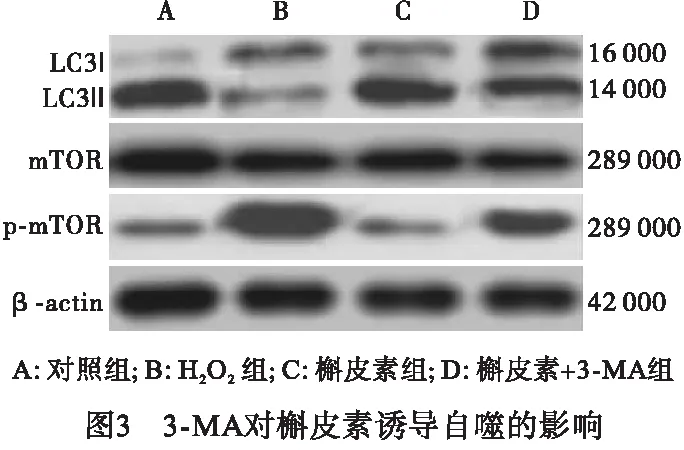
2.4 3-MA对槲皮素诱导自噬的影响 与对照组比较,H2O2组LC3 Ⅱ/LC3 Ⅰ明显降低(P<0.01),p-mTOR/mTOR明显增加(P<0.01),细胞活力明显下调(P<0.01);与槲皮素组比较,槲皮素+3-MA组LC3 Ⅱ/LC3 Ⅰ明显降低(P<0.05),p-mTOR/mTOR明显增加(P<0.05),细胞活力明显降低(P<0.05)(见图3、表4)。
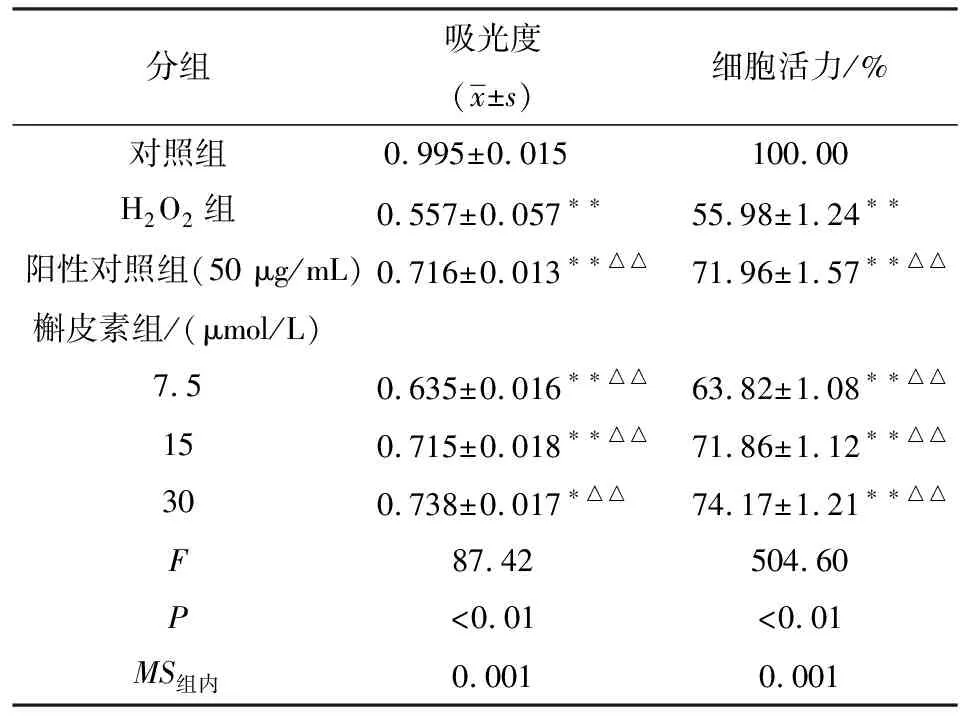
表1 槲皮素对细胞活力的影响(ni=3)
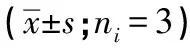
表2 各组HUVEC细胞MDC相对荧光强度
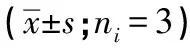
表3 槲皮素对自噬相关蛋白的影响
3 讨论
氧化应激被认为是一种高血糖条件下血管内皮细胞损伤的主要因素。文献[9]显示,槲皮素可被视为抗氧化剂。目前的研究显示,槲皮素可以改善 HUVECs 暴露于高浓度葡萄糖后的抗氧化防御系统。例如用槲皮素处理后,用 30 mmol/L 葡萄糖处理的HUVECs细胞的丙二醛和活性氧自由基显着降低[10]。因此,槲皮素对调节氧化剂/抗氧化剂失衡,减少氧化剂对血管内皮损伤具有一定的功能,即通过抗氧化剂清除氧自由基,减少氧化损伤和随后的细胞死亡,并可以通过自噬清除损伤的线粒体、细胞,提高细胞活力。在本研究中,7.5、15、30 μmol/L槲皮素能有效地提高HUVECs细胞活力,这也证实了上述的观点。并且30 μmol/L槲皮素处理HUVECs后,细胞活力达到了74.17%,因此后续验证槲皮素调控自噬的机制时,选择了该浓度进行了相关实验。
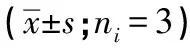
表4 3-MA对槲皮素诱导自噬的影响
槲皮素对H2O2引起的细胞损伤的有效抗氧化能力机制比较复杂,其中自噬作为一种分解代谢过程,能消除受损细胞器,在细胞稳态中发挥着至关重要的作用。自噬受自噬相关基因编码的一些特殊蛋白质的严格调控相关程序[10]。在这些蛋白质中,LC3 对于自噬体的生物发生或成熟是必不可少的,它还可作为选择性自噬的衔接蛋白发挥作用。根据多种文献,LC3 Ⅰ被转化为LC3 Ⅱ,这是自噬早期的一个众所周知的标志物[12]。而AKT/mTOR信号通路是负性调控自噬的经典途径,活化AKT使 AKT 发生磷酸化,之后将信号传至mTOR,触发mTOR磷酸化,从而激活AKT/mTOR信号通路,mTOR通过影响自噬体的形成,对自噬起负调控作用。本研究中,槲皮素会抑制HUVECs细胞中的AKT/mTOR信号传导,诱导自噬体形成和LC3 Ⅱ 的上调。自噬阻断 (3-MA) 可有效缓解槲皮素对自噬的影响,表明自噬激活有助于槲皮素促进细胞增殖。而且自噬阻断,还会进一步影响AKT/mTOR信号通路的分子水平,自噬抑制剂 3-MA和30 μmol/L槲皮素共同处理HUVECs细胞,LC3 Ⅱ表达水平较30 μmol/L槲皮素组明显减弱,mTOR磷酸化水平明显加强,而mTOR磷酸化水平受到p-AKT的调控,这些发现进一步表明 AKT/mTOR信号通路参与了 HUVECs细胞自噬,并调控细胞增殖。
总之,槲皮素可通过抑制 AKT/mTOR信号诱导细胞自噬并促进 HUVECs细胞增殖。这些数据阐明了槲皮素改善血管内皮功能的潜在机制,并表明其作为静脉内皮细胞自噬诱导剂的潜在治疗价值。

