气相色谱质谱联用法测定封窖泥中的两种土霉味物质
黄 箭,谢正敏,施 思,魏金萍,张 倩,范 涛,薛润萍
(宜宾五粮液股份有限公司 中国轻工业浓香型白酒固态发酵重点实验室,四川 宜宾 644000)
白酒是世界著名的六大蒸馏酒之一,其中浓香型白酒占据重要地位,其产量及市场占有率占整个白酒行业的70%左右[1-2]。众所周知,浓香型白酒工艺是采用泥窖固态发酵[3],其中封窖是浓香型白酒酿造生产中的重要工艺之一。封窖泥的质量是封窖工艺的关键,其质量的好坏,一方面决定了窖池封闭的严密性及是否染菌,另一方面直接影响到面糟酒的质量[4-5]。在长达60~80 d的发酵过程中[6],由于封窖泥敞露于窖池外,泥质容易干裂引起窖池出现裂痕污染杂菌,另外,封窖泥营养成分的不断减少,窖泥香味较差,容易产生糠臭味,影响面糟酒的质量。白酒的异味是相对于白酒的香味而言,具体地说,是指白酒产生不协调、偏离本品固有的香、味、风格的异味或杂味。白酒中常见的异味有涩味、苦味、泥臭味、酸味、糠味等[7-8]。随着科技和社会的发展,越来越多的学者的研究表明,土臭素(geosmin,GSM)和2-甲基异茨醇(2-methylisoborneol,2-MIB)为引起白酒糠嗅味的主要物质[9-11]。
常见的“土霉味”物质有土臭素、二甲基异茨醇等,由于其阈值较低,即使在很低的浓度也会有明显的土腥臭味,是造成水、鱼肉以及红酒中霉味或土味的主要原因[12-14]。尽管其在酒体中的含量较低,但人的嗅觉对其极其敏感,有研究表明[15],2-MIB嗅觉阈值约为5~10 ng/L,GSM嗅觉阈值约为1~10 ng/L,超过此阈值会产生令人厌恶的土霉味。
目前,针对GSM和2-MIB的分析主要集中在水体中的检测,前处理方法包括液液萃取(liquid-liquid extraction,LLE)[16]、搅拌棒吸附萃取(stir bar sorptive extraction,SBSE)[17]、固相萃取(solid phase extraction,SPE)[18]、固相微萃取(solid phase microextraction,SPME)[19-20]等,由于SPME前处理方法无需溶剂,检出限低,灵敏度高,GSM和2-MIB的分析国标GB/T 32470—2016《生活饮用水臭味物质土臭素和2-甲基异莰醇检验方法》[21]采用SPME-气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)法。针对其在酒行业中检测主要前处理方法也是SPME法,是因为GSM和2-MIB在酒中含量较低,且挥发性较强。DU H等[22-23]通过气相色谱-嗅闻(gas chromatography olfactometry,GC-O)结合GC-MS技术确定了中国白酒中糠味物质的化学本质为土臭素,通过追踪白酒发酵过程以及制曲过程,认为土臭素是由大曲中微生物的新陈代谢而产生的,并由大曲参与发酵带入原酒中;张灿[10]运用浸入式固相微萃取(directimmersion-solid phase microextraction,DI-SPME)结合气相色谱质谱联用对不同香型的白酒进行检测也发现了土臭素的存在。WEINGART G等[14]应用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合气相色谱与质谱联用(GC-MS)技术分析发现土味素和2,4,6-三氯苯甲醚在白葡萄酒和红葡萄酒中均会造成软木塞味、土霉味、霉臭味等异嗅。DARRIET P等[24]通过GC-O闻香技术结合GC-MS分析,也发现土臭素的含量超过其嗅觉阈值时会使葡萄汁和葡萄酒产生土霉味。由于土霉味在白酒中普遍存在,并对口感、香气的影响比较严重,浓香型白酒在发酵过程中需定期对窖泥进行养护,在养护过程中常在封窖泥表面发现长霉及伴随土腥臭味的现象,这些气味极可能会随着面糟酒的蒸馏而引入白酒,导致白酒品质变差。因此,本研究建立顶空固相微萃取(HS-SPME)结合气相色谱-质谱联用(GC-MS)分析封窖泥中的痕量2-MIB和GSM方法,旨在确定白酒中异味物质的来源及控制其含量提供技术支撑。
1 材料与方法
1.1 材料与试剂
GSM标准溶液(100 mg/L)、2-MIB标准溶液(100 mg/L):美国Supelco公司;NaCl、乙醇、甲醇(均为色谱纯):德国Merck公司;SPME萃取纤维头:50/30 μm二乙烯基苯/Carboxen/聚二甲基硅氧烷(DVB/CAR/PDMS)、65 μm聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)、75 μm Carboxen/聚二甲基硅氧烷(CAR/PDMS)、100 μm PDMS:美国Supelco公司。
1.2 仪器与设备
Agilent7890A-5975C气相色谱质谱联用仪:安捷伦科技有限公司;GERSTEL多功能全自动样品前处理平台MPS2:德国GERSTEL公司;Milli-Q纯水机:密理博有限公司;Centrifuge 5810R离心机:德国艾本德有限公司。
1.3 实验方法
1.3.1 样品前处理
在封窖泥上均匀选取5个点,取样深度大概3~5 cm左右,每个点取20 g左右窖泥,混匀窖泥后碾碎(避免均一性较差),待测。
常压蒸馏萃取:准确称取5.0 g混匀后的窖泥于250 mL蒸馏瓶中,加入75 mL 10%(V/V)乙醇水溶液作为溶剂,常压蒸馏,收集馏分15 mL为封窖泥提取液,冷藏待测。
超声波提取:准确称取2.0 g混匀后的窖泥于50 mL离心管中,加入10 mL 50%(V/V)乙醇水溶液,涡旋均匀,超声15 min(超声功率360 W、超声频率40 kHZ、超声温度25 ℃),8 000 r/min离心5 min,倒出上清液,重复以上步骤一次合并提取液待测。
1.3.2 超声波提取条件优化
提取溶剂的选择:取2 g封窖泥置于50 mL离心管中,分别加入体积分数为10%、30%、50%、100%乙醇水溶液10 mL作为溶剂,涡旋均匀后超声提取15min,再次涡旋振荡1 min,8 000 r/min离心5 min,上清液为封窖泥提取液,冷藏待测。
提取次数的选择:重复以上步骤3次,分别测的每次的提取结果,根据提取效率决定提取次数。
1.3.3 顶空固相微萃取条件的优化
分别考察不同类型萃取头(50/30μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、100 μm PDMS),萃取时间(30 min、40 min、50 min、60 min、70 min),萃取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃),提取溶剂(纯水、体积分数5%、10%、20%、40%的乙醇)对目标组分的萃取效率。
1.3.4 标准溶液的配制及标准曲线的建立
混合标准溶液的配制:分别吸取质量浓度均为100 mg/L的GSM和2-MIB标准溶液0.1 mL,用甲醇配制成10 mg/L的混合标准溶液;吸取混合标准溶液1 mL,用甲醇配制成质量浓度为0.1 mg/L的混合标准使用液,4 ℃冷藏待用。
顶空固相微萃取标准曲线的建立:吸取含有0.1 mg/L的GSM和2-MIB混合标准使用液,用体积分数为5%乙醇分别配制成10 ng/L、50 ng/L、100 ng/L、200 ng/L、400 ng/L、800 ng/L、1 500 ng/L的系列标准溶液。在优化的顶空固相微萃取的条件下,加入1.5 g NaCl,涡旋均匀后进行SPMEGC-MS的富集和测定。以待测物的质量浓度(X)为横坐标,对应的定量离子色谱峰面积(Y)为纵坐标建立标准曲线。
直接进样标准曲线的建立:吸取含有0.1 mg/L的GSM和2-MIB混合标准使用液,用甲醇逐级稀释配制成1 μg/L、5 μg/L、10 μg/L、20 μg/L、40 μg/L的系列标准溶液,在优化质谱条件下进行测定。以待测物的质量浓度(X)为横坐标,对应的定量离子色谱峰面积(Y)为纵坐标建立标准曲线。
1.3.5 HS-SPME-GC-MS分析检测条件
顶空固相萃取条件:热平衡5 min,萃取温度50 ℃,萃取时间50 min,然后250 ℃下解吸5 min;取0.5 mL封窖泥提取液于20 mL顶空瓶中,加入4.5 mL超纯水,1.5 g NaCl,涡旋均匀后插入装有65 μm PDMS/DVB固相微萃取自动进样器对封窖泥提取液进行萃取,用于GC-MS分析。
气相色谱条件:HP-5MS毛细管柱(30 m×250 μm×0.25μm);载气为氦气(He)(纯度>99.999%),流速1 mL/min;进样方式:不分流进样;柱温为起始温度60 ℃,保持1 min,以8 ℃/min升至200 ℃,保持1 min,以30 ℃/min升至280 ℃,保持2 min;进样口温度250 ℃;辅助加热温度280 ℃。
质谱条件:电子电离(electronic ionization,EI)源,电子能量70 eV,溶剂延迟5 min,离子源温度230 ℃,四级杆温度150 ℃。采集模式为选择离子监测(selected ion monitoring,SIM)模式,在SIM模式下对标准工作溶液及待测液进行分析。
定性定量方法:根据保留时间和定性离子进行定性,所得的质谱图与美国国家标准技术研究所(national institute of standards and technology,NIST)20比较,外标法定量。GSM定量离子112 m/z,定性离子125 m/z,182 m/z;2-MIB定量离子95 m/z,定性离子108 m/z,135 m/z。
2 结果分析
2.1 GSM和2-MIB的测定
封窖泥经超声波提取后,进行GC-MS分析,所得的质谱图与NIST 20比较,其中GSM与数据库的匹配度能达到94%,2-MIB的质谱碎片离子与谱库的匹配度达到91%。在相同条件下,对比了向封窖泥中添加标准混合物,通过GC-MS检测,比较添加前后的总离子流色谱图,见图1。由图1可知,可见未加标和加标GSM和2-MIB保留时间一致,可以确定该物质为GSM和2-MIB。
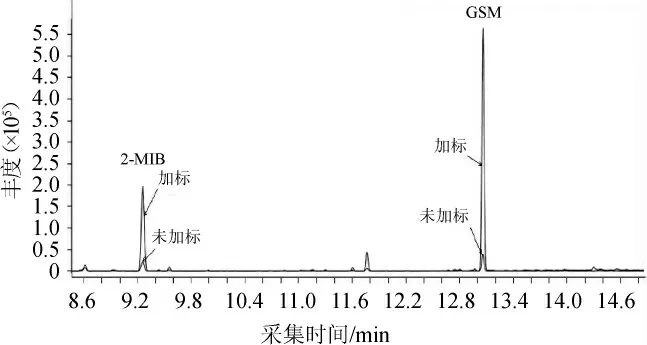
图1 封窖泥中添加标准混合物前后土臭素和二甲基异茨醇的GC-MS分析总离子流色谱图Fig.1 Total ion chromatogram of geosmin and 2-methylisoborneol in pit-sealing mud before and after addition of standard mixture analyzed by GC-MS
2.2 提取条件的对比
2.2.1 提取方法的选择
分别对比了常压蒸馏萃取和超声波提取两种方式对封窖泥中GSM和2-MIB的提取效果,结果见图2。由图2可知,超声波提取法的回收率和常压蒸馏法萃取回收率相差不大,均达到了90%左右。李炜等[25]以纯水为提取溶剂对比了常压蒸馏萃取和超声波提取大曲中的GSM,结果表明,常压蒸馏的回收率更高,分析其原因可能是由于GSM在纯水中的溶解性较低,本法将提取溶剂纯水改为了不同体积分数的乙醇,超声波提取效率显著提高,相较于常压蒸馏,超声波提取方法更加简单,高效,适用于大量样品的检测,而常压蒸馏操作步骤较为繁琐。为了操作简便,节约时间,因此,选择超声波提取封窖泥中的GSM和2-MIB。
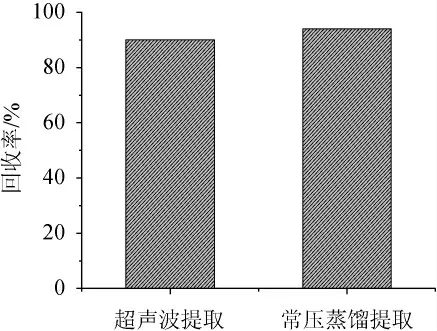
图2 不同提取方式对封窖泥中土臭素和二甲基异茨醇的提取效果比较Fig.2 Comparison of the extraction effect of different extraction methods on the geosmin and 2-methylisoborneol in pit-sealing mud
2.2.2 不同体积分数的乙醇对提取效率的影响
实验分别考察了用10 mL体积分数为10%、30%、50%、100%的乙醇水溶液对封窖泥中的GSM和2-MIB的提取效果,结果见图3。
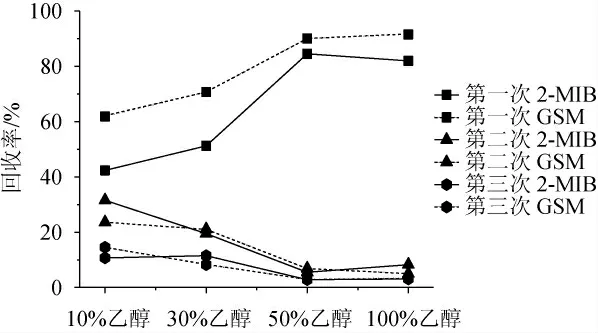
图3 不同体积分数的乙醇对封窖泥中土臭素和二甲基异茨醇的提取效果比较Fig.3 Comparison of the extraction effect of different volume fractions ethanol on the geosmin and 2-methylisoborneol in pit-sealing mud
由图3可知,体积分数为50%和100%的乙醇水溶液在第1次提取时,回收率便已达到90%左右,继续重复提取第2次、第3次的回收率已很低,故最终选取了提取两次,共20 mL提取溶剂;而体积分数为10%和30%的第一次的回收率只有60%左右,据文献表明,GSM和2-MIB为弱极性物质,其在乙醇中的溶解性远高于水中,随着乙醇含量的升高,回收率越来越好,但是由于高含量的乙醇会对固相微萃取的纤维头形成竞争吸附[25]。因此,选择体积分数为50%乙醇水溶液作为提取溶剂,提取溶剂的体积为20 mL,提取次数为2次。
2.3 顶空固相微萃取条件的优化
2.3.1 不同HS-SPME萃取头的选择
分别对比不同萃取头(50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、100 μm PDMS)的萃取效率,结果见图4。由图4可知,65 μm PDMS/CAR萃取头萃取效率明显高于其他萃取头。因此,选择最适萃取头为65 μm PDMS/DVB。
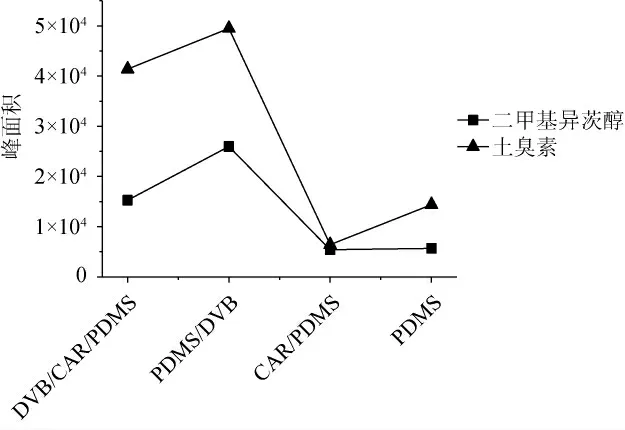
图4 不同萃取头对封窖泥中土臭素和二甲基异茨醇萃取效率的影响Fig.4 Effect of different extraction heads on the extraction efficiency of geosmin and 2-methylisoborneol in pit-sealing mud
2.3.2 萃取时间的选择
考察不同萃取时间(30 min、40 min、50 min、60 min、70 min)对65 μm PDMS/DVB萃取GSM和2-MIB效率的影响,结果见图5。由图5可知,随着萃取时间的增加,目标物的色谱峰面积也随着显著增加,在50 min时萃取达到平衡,萃取得到的峰面积最大,随着萃取时间继续增加,目标物组分色谱峰的面积增加不大。因此,选择最适萃取时间为50min。
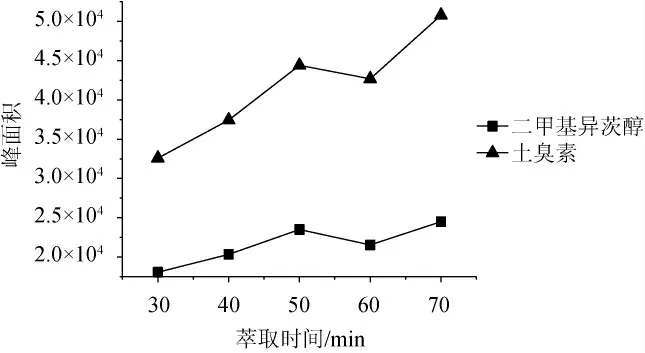
图5 不同萃取时间对封窖泥中土臭素和二甲基异茨醇萃取效率的影响Fig.5 Effect of different extraction time on the extraction efficiency of geosmin and 2-methylisoborneol in pit-sealing mud
2.3.3 萃取温度的选择
考察不同萃取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)对目标组分的萃取效率,结果见图6。由图6可知,随着萃取温度的增高,目标组分的峰面积逐渐增大,当萃取温度达到50 ℃时,2-MIB的峰面积达到最大,萃取温度达到60 ℃时,GSM的峰面积达到最大,随着萃取温度的继续增加,峰面积呈明显的下降趋势,可能是较高温度迫使水蒸汽附着在萃取头上,影响了目标组分与萃取头的进一步结合。因此,选择最适萃取温度为50 ℃。
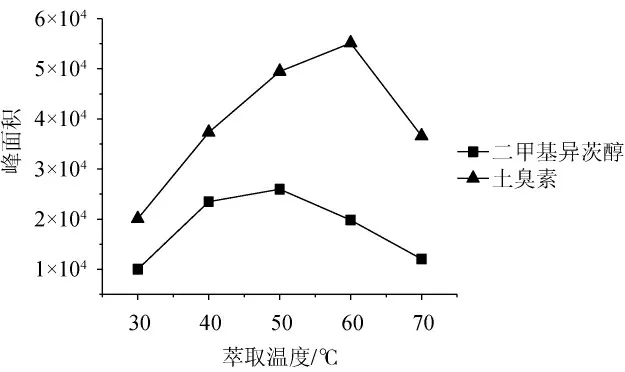
图6 不同萃取温度对封窖泥中土臭素和二甲基异茨醇萃取效率的影响Fig.6 Effect of different extraction temperature on the extraction efficiency of geosmin and 2-methylisoborneol in pit-sealing mud
2.3.4 不同体积分数的萃取溶剂对萃取效率的影响
由于封窖泥的循环使用,使得其成分复杂,富含有机质,并逐渐有了窖泥的芳香味。在对封窖泥中GSM和2-MIB的提取过程中,某些挥发性物质(如有机酸)也会被提取出来,和GSM和2-MIB形成竞争吸附,影响了SPME的萃取效率。考虑到GSM和2-MIB用固相微萃取具有较低的检出限,故将提取液通过稀释后降低其他成分对待测组分的干扰,分布考察纯水、体积分数5%、10%、20%、40%的乙醇富集效率,结果见图7。

图7 不同体积分数的溶剂对封窖泥中土臭素和二甲基异茨醇萃取效率的影响Fig.7 Effect of different volume fraction solvents on the extraction efficiency of GSM and 2-MIB in pit-sealing mud
由图7可知,随着乙醇体积分数的增加,SPME的富集效率在逐渐降低,这可能是因为乙醇和待测组分之间存在着竞争吸附,从而影响了GSM和2-MIB的富集效果。由于样品经超声波提取或常压蒸馏后的馏分乙醇体积分数为50%左右,将其稀释10倍不但可以提高GSM和2-MIB的萃取效率,还可以降低封窖泥中其他复杂成分对待测组分的干扰。因此,选择最适提取溶剂为体积分数5%乙醇。
2.4 HS-SPME和直接进样条件下检测方法的线性关系及检出限
在优化的顶空固相微萃取条件下,对系列标准溶液进行了SPME-GC-MS和直接进样两种方式的富集和检测,以标准溶液的质量浓度(X)为横坐标,待测物定量离子的峰面积(Y)为纵坐标,绘制标准曲线。以定量离子信噪比S/N=3对应浓度为检出限(limit of detection,LOD),S/N=10为定量限(limit of quantitation,LOQ)。由表1可知,SPME-GC-MS在10~1500ng/L范围内线性良好,相关系数R2≥0.997。在优化的GC-MS条件下,对系列标准溶液进行直接进样测定,在1000~40 000 ng/L的范围内线性关系良好,相关系数R2≥0.998。
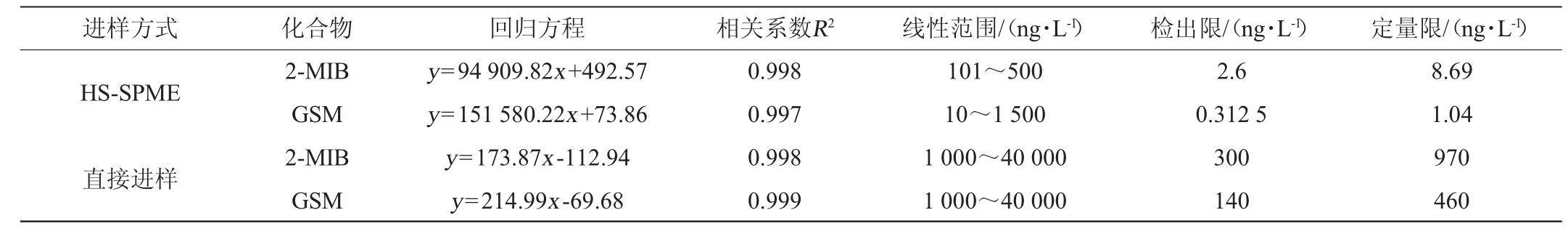
表1 HS-SPME和直接进样条件下的线性回归方程、相关系数、检出限、定量限Table 1 Linear equation,correlation coefficient,limits of detection,and limits of quantitation under HS-SPME and direct injection conditions
2.5 HS-SPME和直接进样两种条件下检测方法的加标回收率及精密度试验
取经粉碎混匀的封窖泥18份,平均分为三组,各组分别添加不同量的GSM和2-MIB标准混合溶液,在3个浓度的添加水平上,每个样品重复6次测定,HS-SPME和直接进样条件下加标回收率及精密度试验结果见表2。由表2可知,HSSPME条件下测定GSM和2-MIB的平均回收率在78.47%~106.75%之间,精密度试验结果相对标准偏差(relative standard deviation,RSD)为4.3%~12.9%。直接进样条件下测定GSM和2-MIB的平均回收率在83.25~110.24%之间,精密度试验结果相对标准偏差为3.9%~9.4%。结果表明,该检测方法准确度和精密度良好。
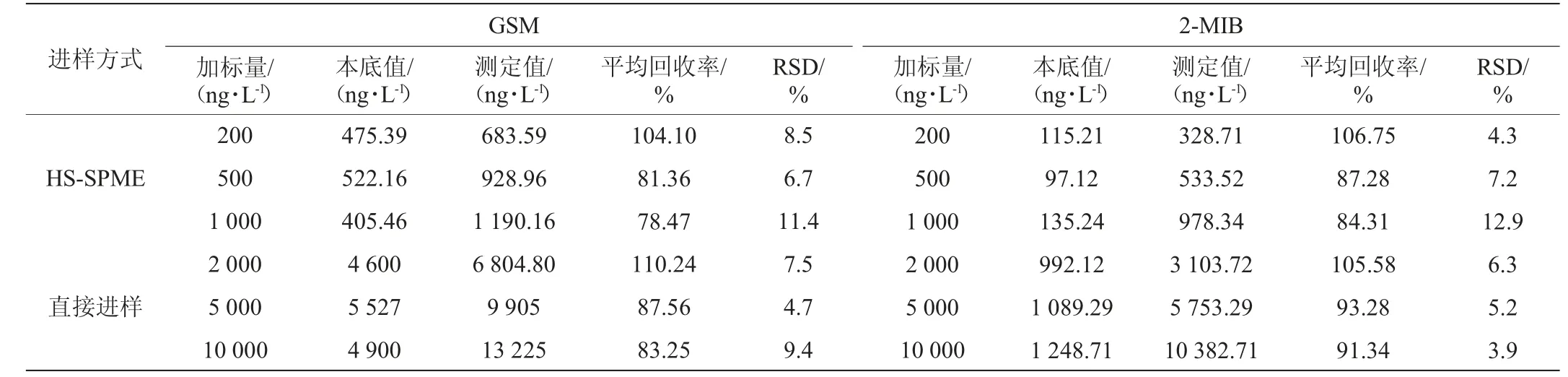
表2 HS-SPME和直接进样条件下加标回收率及精密度试验结果Table 3 Results of standard recovery rate and precision tests under HS-SPME and direct injection conditions
2.6 实际样品的测定
分别采用HS-SPME和直接进样两种条件下对生产车间的20个封窖泥样品(编号为Y1~Y20)中的GSM和2-MIB进行检测,结果见表3。

表3 封窖泥样品中土臭素和二甲基异茨醇测定结果Table 3 Determination results of geosmin and 2-methylisoborneol in pit-sealing mud μg/kg
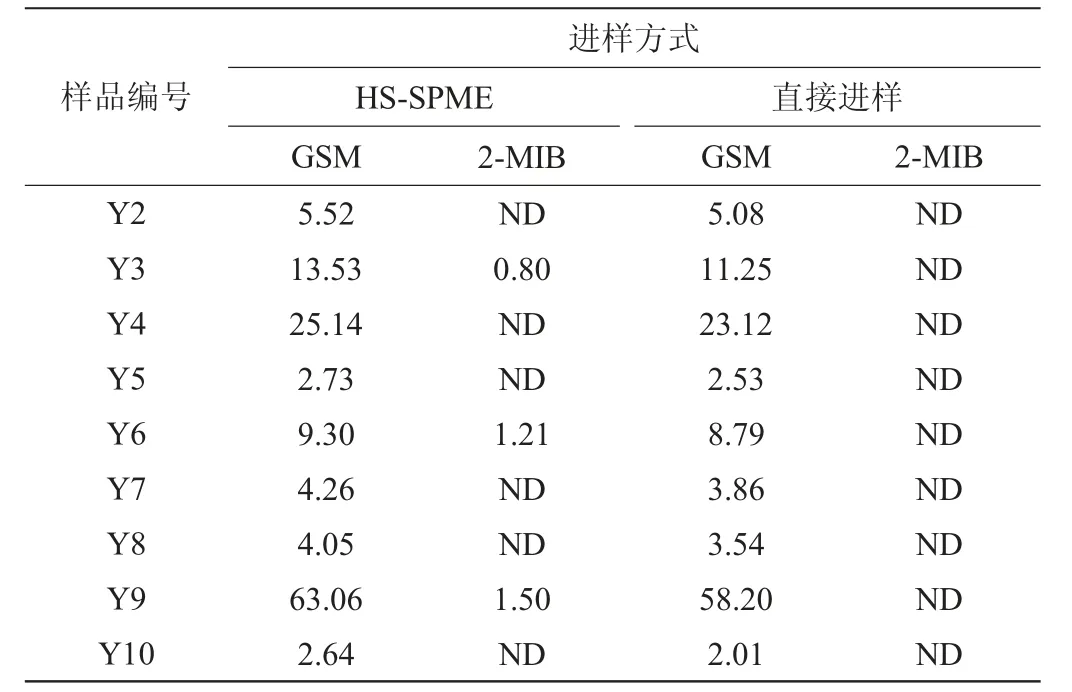
续表
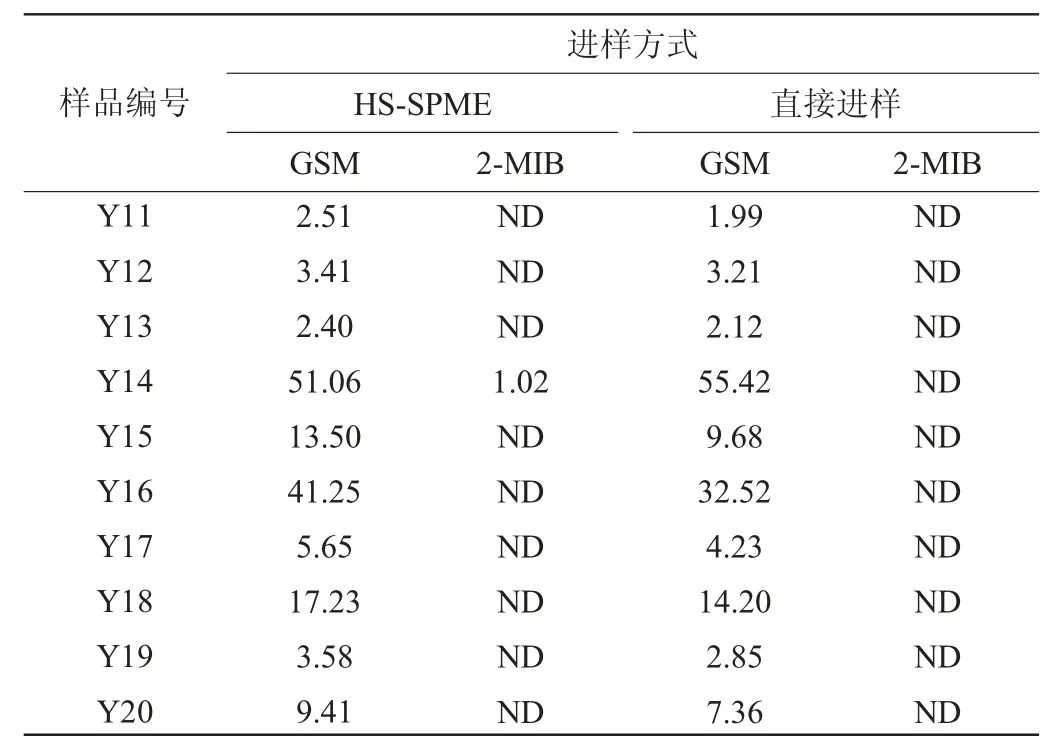
续表
由表3可知,20个样均有GSM的检出,范围为2.40~63.06 μg/kg,65%的样品GSM的检出含量<10 μg/kg,2-MIB的检出率较低,只有20%的样品被检出,范围为0.8~1.5μg/kg。
针对GSM两种进样模式的结果偏差在20%以内,而直接进样中未检出2-MIB,原因是2-MIB的含量较低。两种检测模式各有优缺点,直接进样适用于高含量的样品分析,因为直接进样的检出限不及HS-SPME,痕量样品的分析采用直接进样容易出现干扰,导致定性离子比值不对,易出现假阳性的检测结果。HS-SPME比直接进样具有更低的检出限,适用于痕量(<3 μg/kg)样品的分析,但HS-SPME较直接进样费时,同时萃取头昂贵。因此,在面对样品的检测时,应根据样品中待测物含量选择更加适合的检测模式。
3 结论
本研究建立了超声波提取结合HS-SPME-GC-MS法测定封窖泥中的GSM和2-MIB的方法,确定了超声波提取的最佳条件为:10 mL体积分数为50%的乙醇提取两次;HS-SPME萃取条件为:采用65 μm PDMS/DVB,萃取温度50 ℃,NaCl添加量为0.3 g/mL,萃取时间为50 min,平衡时间为5 min。比较了HS-SPME和直接进样两种模式的检测结果的差异,结果表明,在针对超痕量样品的检测,HS-SPME较直接进样更有优势,对高含量样品的检测,选择直接进样模式更加简便,经济。实际的检测工作中应根据样品中待测物的含量选择合适的检测方法,两种模式下方法的线性关系均良好,相关系数R2≥0.997,加标回收率在78.47%~110.24%之间。该方法的建立为酒类企业对封窖泥中的GSM和2-MIB提供了一种简便、灵敏的检测手段,对提高酒体质量,防止白酒生产中的异味产生具有重要意义。

