贝莱斯芽孢杆菌对小曲酒酿造过程中酵母菌生长及风味物质代谢的影响
蒲领平,邓 杰,卫春会,任志强,黄治国
(1.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 宜宾 644000;2.舍得酒业股份有限公司,四川 遂宁 629200)
白酒为中国特有的一种蒸馏酒,多使用细菌、酵母菌、霉菌等微生物进行固态发酵而成[1-2]。随着白酒产业的迅速发展,单一菌种发酵引起白酒风味特征同质化,商业竞争力降低的问题逐渐凸显出来。然而,接种发酵可以通过影响微生物群落的代谢活性,进而改善发酵食品的风味。如接种地衣芽孢杆菌(Bacillus licheniformis)能够增加酱香型白酒酒醅发酵液中的风味物质,提高感官评分[3];酿酒酵母(Saccharomyces cerevisiae)与巴氏醋杆菌(Acetobacter pasteurianus)的相互作用有利于乙酸乙酯的合成[4]。酵母菌在酒精发酵中起着主发酵的作用,芽孢杆菌类普遍存在于清香型小曲白酒酒醅中[5],贝莱斯芽孢杆菌(Bacillusvelezensis)作为重要的酿酒功能微生物,是白酒高温大曲的优势菌,具有较高的产蛋白酶和产淀粉酶能力,能通过调节代谢活性,改变大曲的原生菌群、酶活性和风味成分[6]。作为一种新兴的功能性菌种[7],被广泛应用于食品发酵领域[8-9]。贝莱斯芽孢杆菌在白酒领域的研究,主要是从大曲中分离出具有高发酵力和高活性的菌株[10-11]。目前,对于白酒中芽孢杆菌和酵母菌的基础研究和应用研究较多[12-13],而将贝莱斯芽孢杆菌用到强化酒醅的制作中,研究其在小曲清香型白酒酿造过程中对酵母菌影响的相关报道较少。因此有必要对贝莱斯芽孢杆菌和酵母菌之间的相互作用进行探究。
本研究通过在酒醅中强化添加不同量的贝莱斯芽孢杆菌(Bacillus velezensis),跟踪分析了在强化酒醅制作过程中酿酒酵母的变化,对其发酵液酒精含量进行测定,并利用气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪测定固态发酵产物中总酯和高级醇含量,探究了贝莱斯芽孢杆菌对酵母菌生长及风味物质的影响,旨在为芽孢杆菌在小曲清香型白酒生产中的应用提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
贝莱斯芽孢杆菌(Bacillus velezensis)BI1:由酿酒微生物技术与应用四川省重点实验室保藏;糖化发酵剂(酿酒曲)(含酿酒酵母109CFU/g):安琪酵母股份有限公司;高粱、糠壳:宜宾市售。
1.1.2 试剂
酵母浸粉、胰蛋白胨、琼脂粉(均为生化试剂)、磷酸二氢钾、氯化钠、硫酸镁、孟加拉玫瑰红、葡萄糖、无水乙醇(均为分析纯):成都艾科达化学试剂有限公司;2-辛醇(2 mg/mL)、乙酸戊酯(3 mg/mL)标准品(均为色谱纯):上海安谱实验科技股份有限公司。
1.1.3 培养基
LB培养基:氯化钠10.0 g/L、酵母浸粉5.0 g/L、胰白胨10 g/L(固体加入琼脂粉20 g/L),pH 7.0。
孟加拉红培养基:胰蛋白胨10.0 g/L、葡萄糖10.0 g/L、磷酸二氢钾1.0 g/L、硫酸镁0.50 g/L、孟加拉红0.03 g/L、琼脂粉20 g/L、氯霉素0.1 g/L、pH 7.0。
发酵培养基:高粱∶水(质量比)=1∶4,加10 U/gα-淀粉酶90 ℃液化1 h,150 U/g 糖化酶60 ℃糖化3 h,过滤离心,调节糖度至10 °Bx[14]。
以上培养基均在115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
AR2140电子分析天平:梅特勒-托利多仪器有限公司;LS-1201生化培养箱:上海三发科学仪器有限公司;7890A-5975B气相色谱-质谱联用仪:美国Agilent公司;DHG-9075A电热恒温鼓风干燥箱:上海齐欣科学仪器有限公司;A360紫外分光光度计:上海翱艺仪器有限公司。
1.3 方法
1.3.1 贝莱斯芽孢杆菌BI1种子液的制备
菌株的活化与保藏:挑取一环贝莱斯芽孢杆菌BI1菌体于10 mL LB液体培养基中,于37 ℃培养1 d后,取菌液分别稀释104、105、106倍后,取100 μL菌液,涂布于LB固体培养基上,在成功获取单菌落后再挑取单菌落进行平板划线,活化完成后,以斜面4 ℃保藏备用。
种子液的制备:挑取一环菌体于已灭菌的LB液体培养基中,于37 ℃、120 r/min培养14 h,使菌体达到对数生长期;取3~5 mL菌液用紫外可见分光光度计测定OD660nm值,当OD660nm为1.0时,进行下一步试验。
1.3.2 麸皮小曲制作工艺
称取100 g麸皮和100 mL水混匀,121 ℃灭菌20 min,烘干备用。取10 mL贝莱斯芽孢杆菌种子液于15 mL离心管中,6 000 r/min离心后,将菌体接种至灭菌后的麸皮中,37 ℃恒温培养3 d,于40 ℃烘箱中烘干后打碎备用。
1.3.3 白酒固态酿造工艺流程
参照小曲清香型白酒酿造工艺,以高粱为原料,5 L保温桶为发酵容器,将高粱均匀粉碎,添加0.4%酿酒曲,润粮4 h后与清水混合后蒸粮4 h,摊晾冷却后加曲拌糠,然后25 ℃培菌,最后将酒醅放入30 ℃房间发酵15 d。按照不同的发酵时间(0 d、5 d、10 d、15 d)在上、中、下层3个点取等量样品,混合均匀,用四分法缩分后,装入广口瓶中作为供试样品。小曲清香型白酒固态酿造工艺如下:
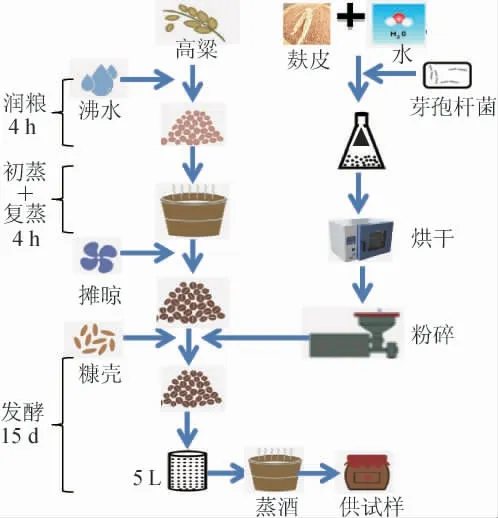
1.3.4 贝莱斯芽孢杆菌接种顺序对发酵的影响
(1)先接种酿酒酵母:在发酵培养基中接种1×106CFU/g酿酒酵母,12 h后分别接种0(空白对照组)、1×104CFU/g、1×105CFU/g、1×106CFU/g的贝莱斯芽孢杆菌,在发酵0 d、5 d、10 d和15 d取样测生物量。
(2)先接种贝莱斯芽孢杆菌:在发酵培养基中分别接种0(空白对照组)、1×104CFU/g、1×105CFU/g、1×106CFU/g的贝莱斯芽孢杆菌,发酵12 h后接种1×106CFU/g酿酒酵母,在发酵0 d、5 d、10 d和15 d取样测生物量。
1.3.5 测定方法
(1)酵母菌生物量的测定
称取5 g麸曲样品,加入装有45 mL无菌水的三角瓶中,在摇床上振荡30 min。吸取100 μL菌液到1.5 mL EP管,加入0.9 mL无菌水,稀释10倍。吸取100 μL上述稀释液,涂布于LB培养基和孟加拉红培养基上,分别于37 ℃培养24 h,28 ℃培养48 h。采用稀释涂布平板法测定酵母菌生物量。
(2)固态酿造酒醅酒精度测定
称取100 g发酵15 d的酒醅于500 mL圆底烧瓶中,加入200 mL水混匀,缓缓加热蒸馏,以100 mL容量瓶收集馏出液。参照国标GB/T 10345—2007《白酒分析方法》中的酒精计法测量酒精度。
(3)总酯和高级醇含量测定
根据文献[15],采用GC-MS法对发酵完成后发酵液的高级醇含量与总酯含量进行分析。
样品测定:参照GB/T 10345—2007《白酒分析方法》对酒醅进行处理,称取酒醅样本100 g,加入体积分数75%的乙醇溶液100 mL浸泡30 min,再加入100 mL去离子水,混匀,蒸馏出100 mL样液;取900 μL样液于进样瓶中,加入2 mg/mL的2-辛醇内标溶液和3 mg/mL乙酸戊酯内标溶液各50 μL,随后自动进样。
气相色谱条件:DB-WAX毛细管色谱柱(60.00 mm×0.25 mm×0.25 μm);载气为99.999%氦气(He);进样口温度为230 ℃;升温程序为初始温度40 ℃,保持1 min;3 ℃/min升到46℃,6 ℃/min升到64℃,保持2min;8 ℃/min升到117 ℃,保持1 min;15 ℃/min升到230 ℃并保持5 min;载气流速为1 mL/min。
质谱条件:电子电离(electronic ionization,EI)源,离子源温度为230 ℃;电子能量为70 eV;质量扫描范围为20~550 amu;四极杆温度为150 ℃。
定性方法:采用美国国家标准技术研究所(national institute of standards and technology)05a.L标准谱库比对,用GC-MS 化学工作站进行数据分析,并结合标准品的质谱图进行定性。
定量方法:以2 mg/mL的2-辛醇和3 mg/mL乙酸戊酯内标溶液为标准物,检测代谢产物的风味物质。采用内标法定量。
1.3.6 数据处理
设置3组平行,试验结果均用“平均值±标准差”(x¯±S)表示,采用SPSS 22.0统计分析软件对实验结果进行分析。
2 结果与分析
2.1 贝莱斯芽孢杆菌与酵母菌接种先后顺序的比较
糖化前接种贝莱斯芽孢杆菌与糖化后接种贝莱斯芽孢杆菌发酵对酵母菌数量的影响结果见图1。
酵母菌是白酒生产的关键,其生长的优劣直接影响白酒的品质和出酒率。由图1A可知,随着菌株BI1添加量的不断增大,酵母菌数量呈现下降的趋势,但都在一个数量级,菌株BI1添加量为104CFU/g发酵5 d时,酵母菌数量最大为(3.50±0.1)×108CFU/g,贝莱斯芽孢杆菌添加量为106CFU/g发酵15 d时,酵母菌数量最小为(6.98±0.4)×107CFU/g,说明酵母菌数量与该菌添加量呈负相关。由图1B可知,糖化后接种贝莱斯芽孢杆菌的培养基中,在发酵第5~10天酵母菌的数量差异显著(P<0.05),发酵第5天酵母菌的数量达到峰值,这可能是因为酵母菌的生长周期短,在5 d左右就进入对数生长期;而发酵10 d后,酵母菌的数量急剧减少,可能是由于较高生物量的菌株BI1影响了酒醅的微生物区系,使酒醅中酵母菌的生长受到一定抑制,这与先前报道结果一致[16]。因此,糖化前接种贝莱斯芽孢杆菌BI1更有利于白酒的发酵。
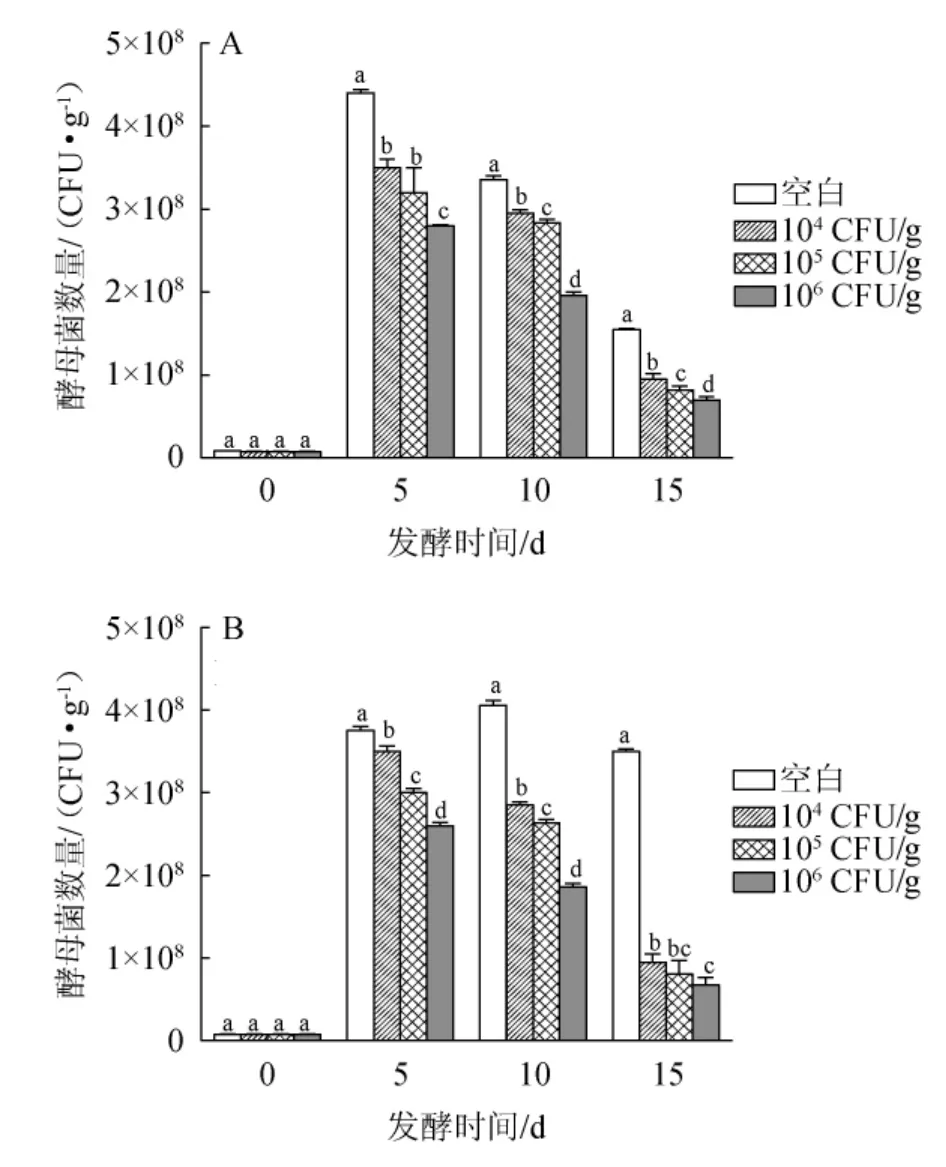
图1 不同接种顺序对酵母菌生长的影响Fig.1 Effect of different inoculation sequence on the growth of yeast
2.2 贝莱斯芽孢杆菌添加量对酒精度的影响
酒精含量是酵母细胞代谢途径和能量利用的外部表现,在白酒酿造中发挥极其重要的作用[17-19],这说明能够一定程度上反映出原酒出酒率和原酒质量,贝莱斯芽孢杆菌添加量对发酵液酒精度的影响结果见图2。
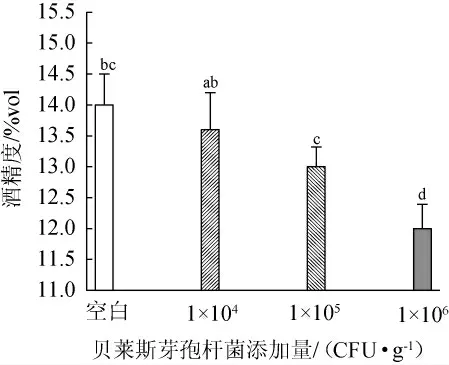
图2 贝莱斯芽孢杆菌添加量对酒精度的影响Fig.2 Effect of Bacillus velezensis addition on alcohol content
由图2可知,随着贝莱斯芽孢杆菌添加量的增加,酒精度呈下降趋势,可能是因为细菌能够抑制酵母菌的乙醇代谢[20];与空白对照组相比,添加1×106CFU/g贝莱斯芽孢杆菌的菌株BI1能显著降低发酵液的酒精度(P<0.05),可能是由于发酵过程中微生物间营养及氧气竞争[21-22],导致酵母菌的产醇能力会在与其他微生物的相互作用中而改变,导致乙醇产量降低,进而酒精度下降。因此,贝莱斯芽孢杆菌添加量为104CFU/g。
2.3 贝莱斯芽孢杆菌添加量对高级醇含量的影响
酵母菌利用发酵原料中游离的氨基氮,从而合成自身生长繁殖所需的蛋白质,当氨基酸中的氨基被利用后,残余的α-酮酸经过发酵脱羧与加氢还原,可以得到相应的高级醇[23],高级醇能够增加白酒的协调感和饱满感,但高级醇含量过高会对白酒品质产生不利影响[24-25],不同贝莱斯芽孢杆菌添加量对高级醇含量的影响见表1及图3。
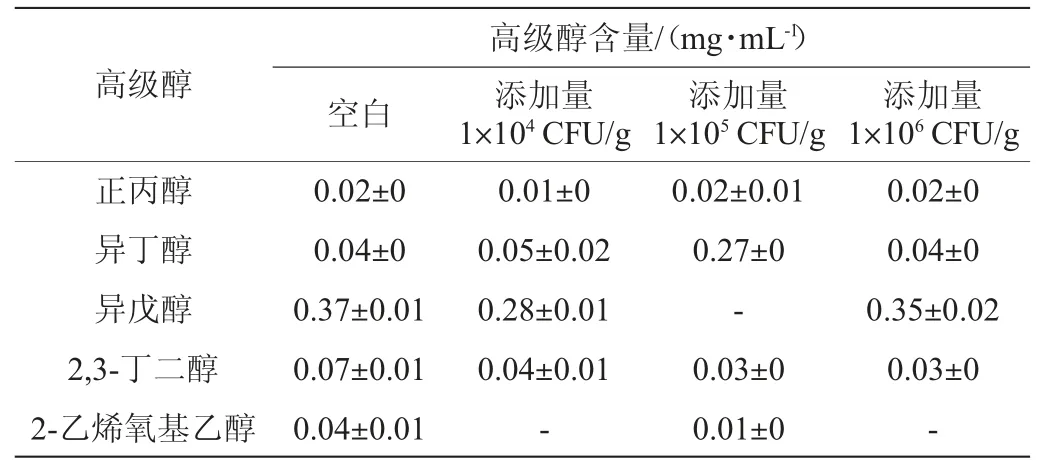
表1 不同添加量贝莱斯芽孢杆菌发酵液的高级醇含量Table 1 Higher alcohol contents in fermentation broth of Bacillus velezensis with different addition
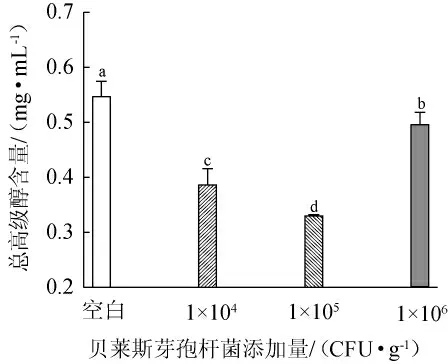
图3 贝莱斯芽孢杆菌添加量对高级醇含量的影响Fig.3 Effect of Bacillus velezensis addition on higher alcohol contents
由表1及图3可知,3种添加量贝莱斯芽孢杆菌产高级醇能力存在明显差异,总体上,产异戊醇最强,产2-乙烯氧基乙醇最弱,但这五种高级醇含量均低于空白对照组。随着贝莱斯芽孢杆菌添加量的增加,总高级醇含量呈先下降后上升的趋势,可能是因为在一定添加范围内,贝莱斯芽孢杆菌对于抑制高级醇的产生有一定的作用[26]。然而,大量贝莱斯芽孢杆菌添加后的生物扰动改变了微生物间的代谢活性,使得总高级醇含量上升[27];在不同菌株BI1添加量下,总高级醇含量均低于空白对照组,可能是由于菌株BI1的存在影响酵母菌代谢途径中关键酶和基因等发生改变,从而减弱了醇类物质合成。综合对总高级醇含量和对白酒的协调感的影响,最佳贝莱斯芽孢杆菌添加量为104CFU/g。
2.4 贝莱斯芽孢杆菌添加量对酯类物质含量的影响
酵母菌主要通过酯化反应途径、醇酰基转移酶途径和醇脱氢酶途径合成酯类物质[28]。酒醅中总酯的含量在一定程度上反映了其发酵情况,大量酯类物质有助于产生果香等[29]。贝莱斯芽孢杆菌添加量对酯类物质含量的影响见表2及图4。
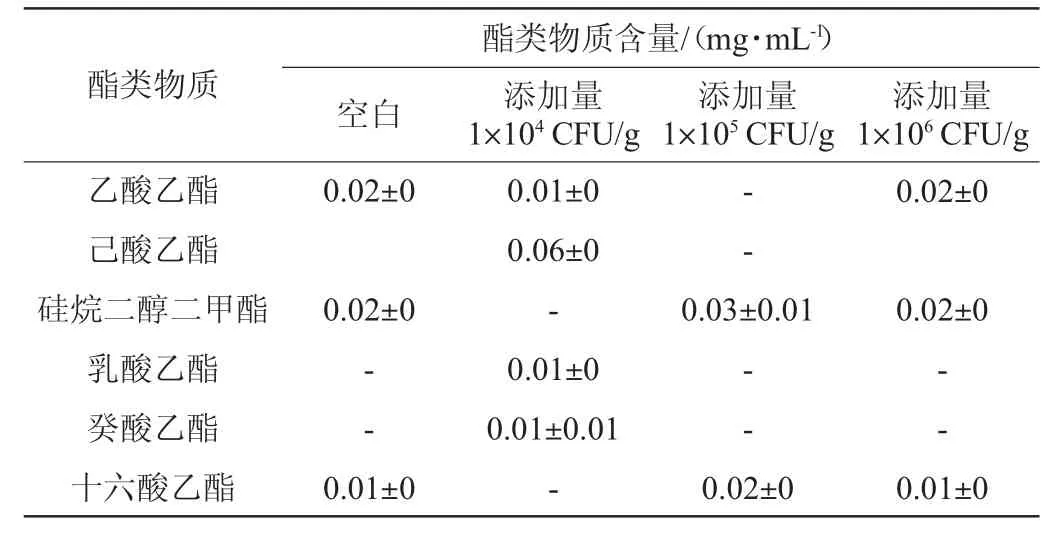
表2 不同添加量贝莱斯芽孢杆菌发酵液的酯类物质含量Table 2 Esters contents in fermentation broth of Bacillus velezensis with different addition
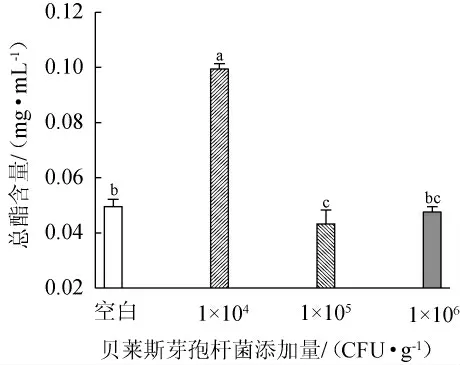
图4 贝莱斯芽孢杆菌添加量对酯类物质含量的影响Fig.4 Effect of Bacillus velezensis addition on esters contents
由表2及图4可知,与空白对照组相比,添加贝莱斯芽孢杆菌后,乙酸乙酯、乳酸乙酯和癸酸乙酯的含量均有提高,其中添加104CFU/g菌株BI1条件下,乙酸乙酯与乳酸乙酯的比例为1∶1,这表明此时酒体风格最佳。与空白对照相比,添加1×104CFU/g的菌株BI1能显著增加发酵液的酯类物质含量(P<0.05),然而添加105CFU/g菌株BI1能显著降低发酵液的酯类物质含量(P<0.05),这可能是由于接种了不同菌体浓度的芽孢杆菌菌株干扰了酒醅中其他微生物的生长代谢,导致发酵液中总酯含量有显著区别。贝莱斯芽孢杆菌添加量为104CFU/g时总酯含量最高,因此最佳芽孢杆菌添加量为104CFU/g。
3 结论
固态发酵具有能耗低,发酵过程易于控制的优点。本试验通过建立实验室固态酿造模型,用贝莱斯芽孢杆菌制成麸曲添加到酒醅中发酵,研究其对小曲酒发酵过程中酵母菌生长和风味物质的影响。结果表明,糖化前接种贝莱斯芽孢杆菌BI1更有利于白酒的发酵。贝莱斯芽孢杆菌对酵母有生长抑制效应,但是对固态发酵产物中酯类物质含量有一定的提高作用,强化酒醅发酵液中高级醇含量低,综合贝莱斯芽孢杆菌BI1对酒精度、高级醇和酯类物质的影响,贝莱斯芽孢杆菌BI1最佳添加量为104CFU/g。本实验结果对生产高级醇含量低的优质小曲清香型白酒有指导意义,但由于酒醅中微生物之间的作用较复杂,后续还需要进行更深一步的研究。

