氮源对葡萄酒酵母发酵性能影响的研究进展
原梦梦,李金宸*,李贺贺,孙宝国
(1.北京工商大学 中国轻工业酿酒分子工程重点实验室,北京 100048;2.北京工商大学 食品质量与安全北京实验室,北京 100048)
葡萄酒是一种以葡萄为原料的发酵型含酒精饮料,历史悠久,可追溯至公元前5 400年[1]。从早期的自然发酵,到现代大规模的工业化生产,酵母在发酵过程中扮演着重要的角色。酿酒酵母(Saccharomyces cerevisiae)是参与葡萄酒发酵的主要微生物,在执行酒精发酵的同时通过生成发酵香气物质赋予葡萄酒复杂多样的风味。随着微生物风土的提出,自20世纪90年代起,发酵特性多样的非酿酒酵母(non-Saccharomycesyeasts)逐渐受到关注[2]。非酿酒酵母是参与葡萄酒发酵的、除酿酒酵母外的其他酵母品种,早期一度被认为是污染酵母[3];随着研究的深入,其在发酵中的积极作用逐渐被揭示[3]。此类酵母的优良发酵特性包括改善葡萄酒风味品质、增加葡萄酒生物稳定性等,并通过生理代谢高产挥发性香气物质,体现不同产区、品种葡萄酒的风土特异性。尽管大多数非酿酒酵母对酒精耐受力低,不能独立完成酒精发酵,但是在与酿酒酵母混合发酵中可以发挥其特点,改善葡萄酒特性,提升葡萄酒品质。
酵母在葡萄酒发酵过程中有特定的营养需求。在影响酵母发酵的众多营养因素中,氮源作为葡萄的内源性营养物质,对酵母的生长代谢、发酵速率以及发酵香气的产生等有重要影响,是发酵过程中除碳源外的主要营养物质[4]。在葡萄酒发酵基质中,可被酵母直接利用的氮源称为酵母可同化氮(yeast assimilable nitrogen,YAN),主要包括除脯氨酸外的α-氨基酸、小分子多肽以及铵态氮[5]在内的有机氮和无机氮。在酒精发酵过程中,酵母吸收利用YAN及其他营养物质,以支持其生长、发酵等生理代谢活动,并产生包括发酵香气在内的次级代谢产物;研究发现发酵基质中120~140 mg N/L YAN可保证酿酒酵母正常发酵,并对酒的质量产生积极影响[6-7]。氮源含量过低会引起酵母生长停滞,从而导致发酵终止[8],及时补充氮源可解决该问题。此外,氮源的组成与含量直接影响酵母发酵香气的生成,进而对葡萄酒风味品质产生影响;如酵母氮代谢所产生的杂醇、酯类等挥发性物质,在低浓度时可增加葡萄酒香气复杂性,浓度过高时则会产生香气掩盖作用[9]。因此,解析酵母氮利用特性,阐明其代谢途径与调控机理可为实际生产中氮源管理及风味物质的定向调控提供理论支撑,并为酿酒酵母与非酿酒酵母混合发酵中的营养竞争机制研究奠定基础。
本文围绕葡萄酒酵母产香能力及氮源对于酵母的生长及发酵性能的影响进行总结,就目前的研究进展与未来研究方向展开论述,以期为我国葡萄酒酵母的发酵及产香特性的深入挖掘与研究提供借鉴与参考。
1 氮源条件对酿酒酵母生长和代谢的影响
在葡萄酒酿造过程中,酿酒酵母对于葡萄酒的品质有着至关重要的影响。酵母的生长周期分为迟滞期、对数期、稳定期和衰亡期四个阶段,与发酵速率密切相关。酵母在对数期与稳定期发酵旺盛,进入衰亡期后其发酵速率降低,并逐渐停滞。氮源通过直接影响酵母生长,从而影响发酵活动。因此,为确保发酵顺利进行,基于氮源对酵母生长与发酵速率影响的相关研究尤为重要。
氮源对于酿酒酵母生长及推动酒精发酵至关重要,在此基础上,酵母氮代谢是产生发酵香气的主要途径。发酵香气又称二级香气,是酵母在葡萄酒发酵过程中通过生理代谢活动产生的一类挥发性香气物质,对于葡萄酒总体香气的复杂性有重要贡献,杂醇类和酯类是其中重要的组成物质。杂醇类物质由葡萄糖代谢和氨基酸脱氨产生,异戊醇、2-苯乙醇和异丁醇等是葡萄酒中重要的香气物质,其阈值较低,具有较强的香气贡献度;酯类物质的形成与脂肪酸的生物合成和氨基酸代谢相关,包括乙酸乙酯、乙酸异戊酯和己酸乙酯等,是构成葡萄酒发酵香气的重要物质[10]。这些香气物质在适当浓度下可增添葡萄酒香气复杂性,对葡萄酒质量有积极影响。
在葡萄酒酿造过程中,氮源不仅影响酿酒酵母生长及发酵进程,还可通过影响其代谢来调节发酵香气的生成,从而影响葡萄酒的品质。研究发现,不同酿酒酵母对氮源需求不同,氮源对其生长和发酵影响存在菌株特异性。不同氮源条件对酿酒酵母的生长、发酵速率和发酵香气产量的影响见表1。
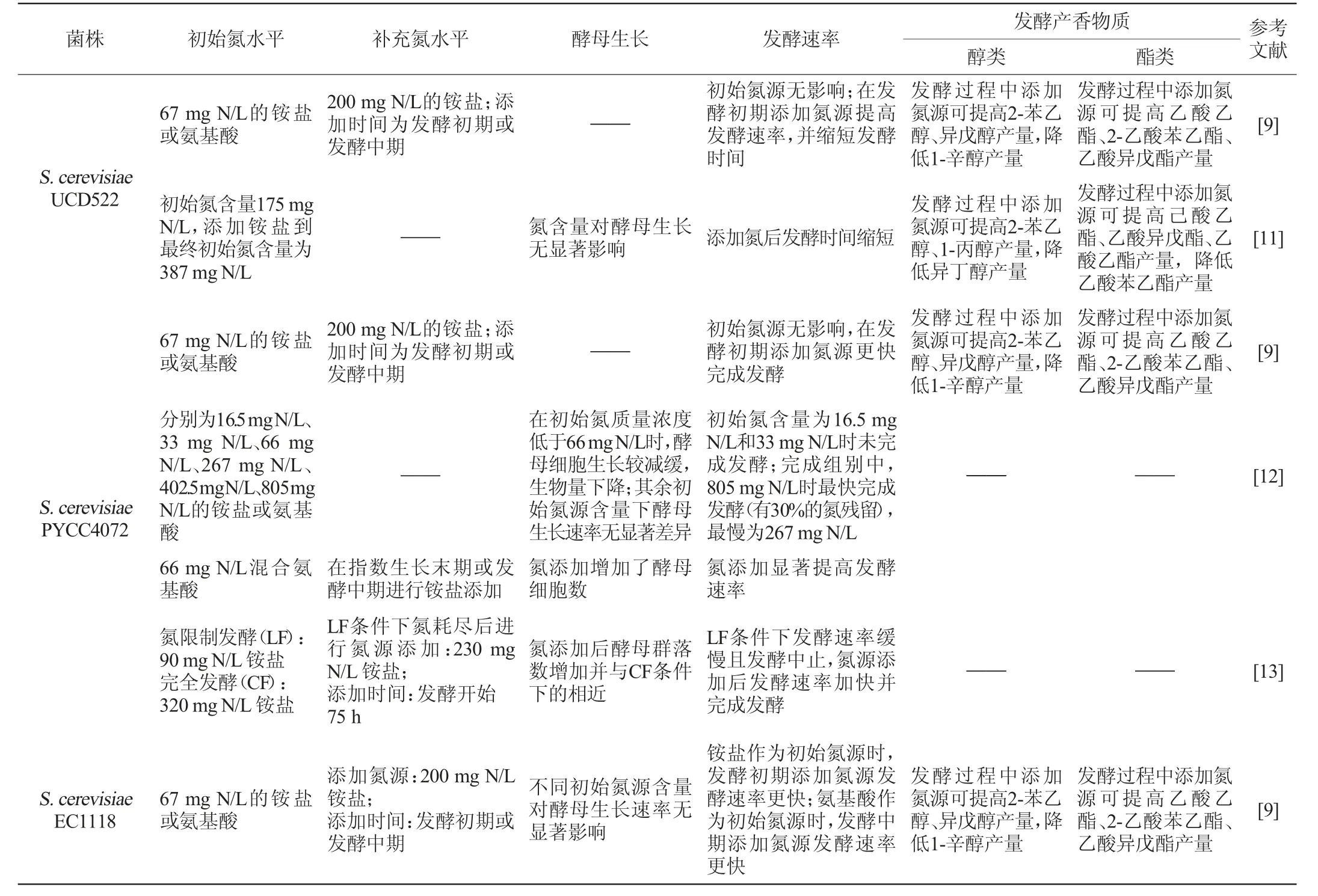
表1 不同氮源条件下酿酒酵母菌株的生长及代谢特性Table 1 Growth and metabolic performances of Saccharomyces cerevisiae strains under different nitrogen sources
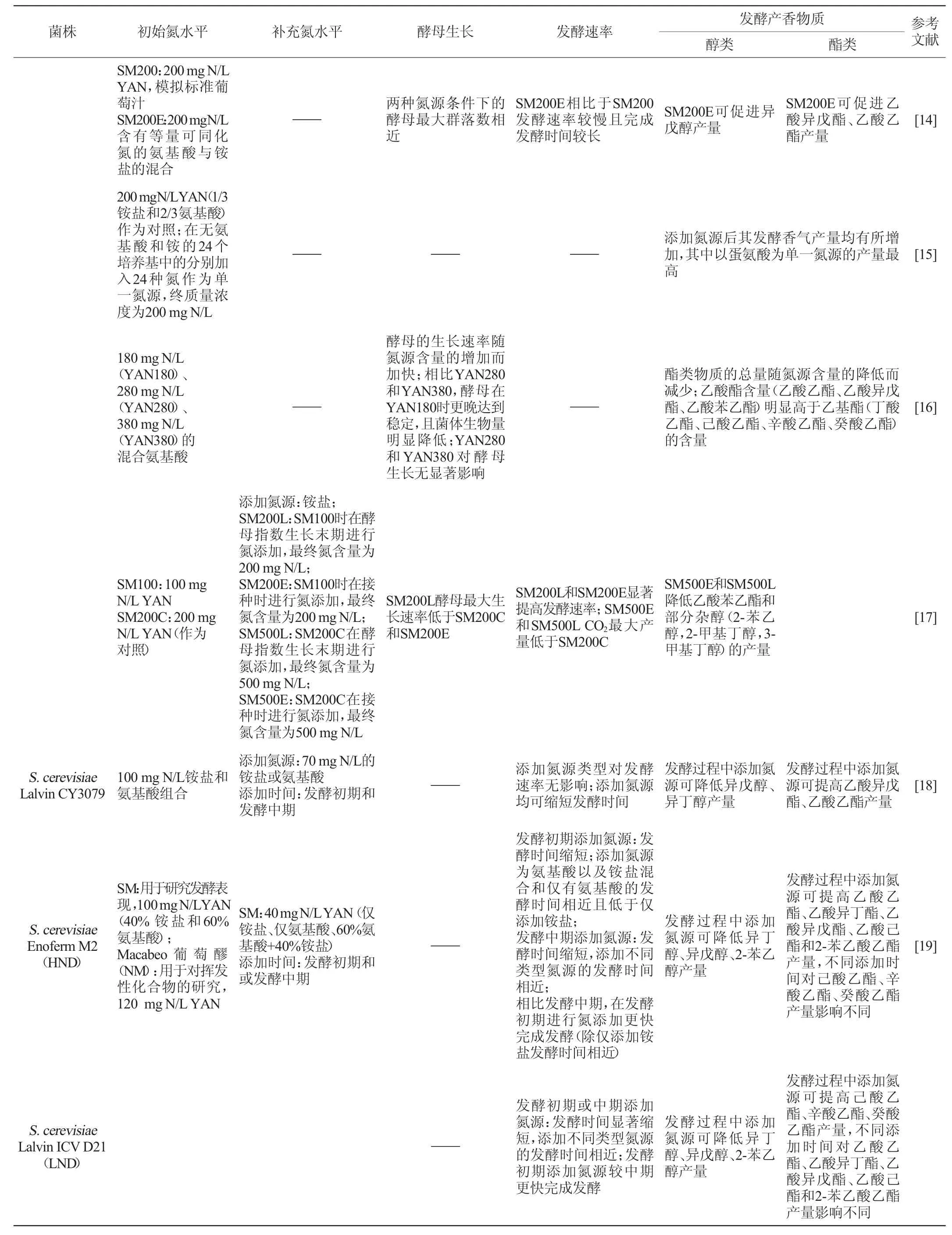
续表
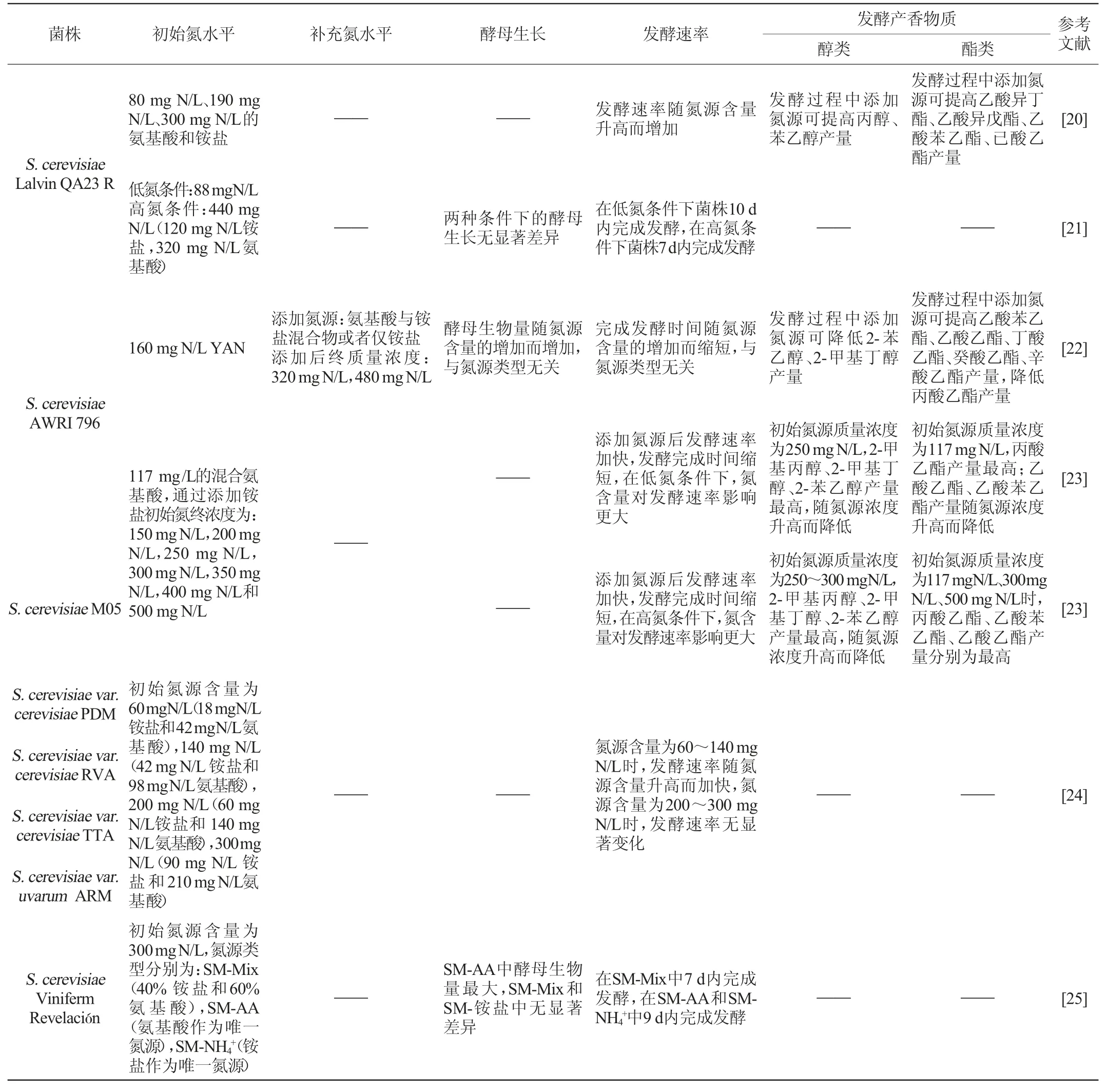
续表
1.1 初始氮源对酿酒酵母发酵性能的影响
研究发现,发酵基质中初始氮源的组成和含量可直接影响酿酒酵母的生长及发酵性能,且该影响有菌株特异性。
初始氮源的组成是重要影响因素之一。S.cerevisiaeEC1118在模拟葡萄汁的氮源条件下相较等比例的氨基酸与铵混合氮源条件下的发酵速率更快,完成发酵时间更短,但发酵香气包括异戊醇、乙酸乙酯和乙酸异戊酯在等比例混合氮源条件下的产量更高[14];其在不同氮源间生物量差异显著,在含有不同氮源的合成培养基中生物量最高,仅含单一氮源时生物量较低,尤其是以铵为单一氮源生物量最低[26];此外在该菌株以24种氮源分别作为单一氮源的研究中发现,以蛋氨酸为单一氮源时发酵香气产量最高[15]。S.cerevisiaeUCD522与S.cerevisiaePYCC4072的表现相似,两者的发酵速率与初始氮源组成无关,但发酵香气的产生受氮源组成影响较大,2-苯乙醇、异戊醇、2-乙酸苯乙酯和乙酸异戊酯在以铵盐为初始氮源时产量高于氨基酸为初始氮源[9]。S.cerevisiaeViniferm Revelación在混合氮源(铵与氨基酸)中比在单一氮源(仅存在铵或氨基酸)条件下更快完成发酵;然而其在以氨基酸为氮源的培养基中生物量积累以及发酵速率比非酿酒酵母均更高,而在混合氮源或仅有铵态氮时生长无显著差异[25]。不同发酵性能的酿酒酵母对氮源的利用存在较大差异,这可能与酿酒酵母的氮代谢调控机制相关,其促使酿酒酵母偏好性地选择有利于其生长发酵的氮源。
初始氮源的含量对酿酒酵母的生长和发酵表现同样有重要影响。研究发现,初始氮源含量为60~140 mgN/L时,S.cerevisiaevar.cerevisiaePDM,RVA,TTA和S.cerevisiaevar.uvarumARM的发酵速率随氮源含量升高而增强,氮源含量为200~300 mg N/L时,发酵速率无显著变化[24]。S.cerevisiaePYCC4072在不同初始氮含量下(66~805 mg N/L)的生长无显著差异,但其发酵在低氮条件下(16.5~33 mg N/L)停滞,随着氮含量升高,其发酵速率逐步提高,在高氮条件下(805 mg N/L)最快完成发酵,但会有氮残留[12];也有研究表明,其在氮限制条件下(90 mg N/L)发酵速率缓慢[13]。S.cerevisiaeEC1118的生长速率随初始氮源浓度的升高而加快,且在高氮条件下的生物量积累显著高于低氮条件;其酯类物质的总产量随着初始氮源浓度的降低而减少,其中乙酸酯含量明显高于乙基酯的含量[16]。S.cerevisiaeLalvin QA23 R在不同初始氮源含量下的酵母生长无显著差异,但在氮含量较高时发酵速率明显高于低氮条件[21];并且氮含量的提高对其醇、酯类物质的产量有积极影响[20]。S.cerevisiaeAWRI 796的发酵速率相比于高氮条件,在低氮条件下受氮含量影响更大,其丙酸乙酯在初始氮含量高于117mgN/L时产量显著下降,乙酸乙酯在氮源含量为200~300 mg N/L产量最低,而S.cerevisiaeM05的发酵速率在高氮条件下的变化更为显著,其丙酸乙酯在较低氮含量下产量较高,在300 mg N/L时产量最低,乙酸乙酯在高氮条件下的产量最高[23],两者表现在一定程度上体现了菌株特异性。此外有研究发现,发酵基质中初始氮含量超过一定水平会造成部分杂醇类物质的产量下降[11]。因此,葡萄酒酿造中可以通过控制氮含量使发酵速率达到较高水平,同时调节发酵香气的产生,使发酵向利于葡萄酒品质提升的方向进行。
初始氮源的含量与组成类型对酿酒酵母生长、发酵性能及产香能力均有不同影响。然而,关于初始氮源对酵母发酵的影响仍缺乏相关机制研究。此外,葡萄酒发酵基质组成复杂,发酵条件多样;葡萄品种、基质含糖量、基质pH、发酵温度等多种非生物因素,结合基质中初始氮源水平,均会对酿酒酵母的生长与发酵产生影响,但目前相关研究较少。因此,未来可更加重视基于多因素的酵母发酵性能影响表现及机制研究,相关机理的明晰有利于深入挖掘葡萄酒酿酒酵母的发酵调控机制,并为葡萄酒生产中的高效氮源管理提供理论支撑。
1.2 氮源添加对酿酒酵母发酵性能的影响
初始氮含量不足会造成发酵迟缓甚至停滞,为保证发酵顺利完成需进行氮源补充。发酵过程中添加YAN可直接影响酿酒酵母生长及酒精发酵表现(见表1),该影响依添加量、添加类型以及添加时机而异。不同初始氮源类型下,氮添加对酿酒酵母发酵性能的影响也有所不同。
研究表明,在发酵过程的不同时期进行氮添加均可提升发酵速率,缩短发酵时间[18]。相比于发酵中期,在发酵初期进行氮添加,这一变化更为显著[9,19];亦有研究表明,相比在酵母对数期进行氮添加,接种时添加氮源可提高其最大生长速率[17]。此外,氮添加时机与初始氮源类型可共同影响发酵速率。对于S.cerevisiaeEC1118,以铵盐为初始氮源时,相较于发酵中期,在发酵初期添加氮源可加快发酵速率;以氨基酸为初始氮源时,相较于发酵初期,发酵中期进行氮添加可促进酵母更快完成发酵[9]。同时,氮源添加时机对醇酯类物质的产量有着不同影响。研究发现,在发酵中期进行氮添加更有利于多数发酵香气产量的提高[18-19],如S.cerevisiaeUCD522和S.cerevisiaePYCC4072,与发酵初期相比,在发酵中期进行氮添加,2-苯乙醇、异戊醇和2-乙酸苯乙酯产量更高,而对乙酸异戊酯产量的影响正好相反[9]。对于一些杂醇和乙基酯类物质,添加氨基酸和铵混合氮源时杂醇产量下降,仅添加氨基酸时产量升高,添加铵盐时产量无显著变化[19]。
在众多研究中,普遍使用磷酸二氢铵或硫酸铵等铵盐作为添加氮源,而有研究表明,使用氨基酸混合物作为氮源补充剂相比铵盐更能有效提高酵母的发酵速率,对不良挥发性化合物的产生也有一定的抑制作用[5]。在进行氮添加时,氮源的选择对酿酒酵母生长发酵十分重要,如添加苯丙氨酸和缬氨酸对酿酒酵母的生长有较好的支持作用,而天冬酰胺的添加不利于酿酒酵母的生长,丁醇和丙酸水平相比于添加氨基酸受铵盐的影响更为显著[27]。基于不同氮源对酿酒酵母发酵表现的影响,可以通过控制氮添加的类型和含量来预测香气变化。
针对氮源添加可普遍提升发酵速率这一现象,MENDESFERREIRA A等[12]对其机理展开深入研究。为研究发酵中途补充氮源(添加磷酸二氢铵)对于酵母生长发酵的促进作用,研究者在发酵72 h后添加磷酸二氢铵,并同时加入胞内蛋白质从头合成抑制剂环己酰亚胺,结果发现,该条件下S.cerevisiaePYCC 4072的整体发酵速率近似于未做氮添加处理组,由此推断添加磷酸二氢铵是通过促进酵母细胞内蛋白质从头合成来影响酿酒酵母的生长发酵。
研究发现,发酵过程中补充氮源对酵母生物质产生和酒精发酵有直接影响,且酵母生物量增加可提升发酵速率并缩短发酵完成时间,但对酵母发酵副产物积累无显著影响[28]。基于此,可初步推测发酵过程中补充氮源是通过促进酵母生物量积累来影响发酵速率,然而相关研究目前多聚焦于探索不同氮源添加条件与酵母菌株差异对于发酵表现的影响,基于葡萄酒发酵环境中氮源补充对酵母生长、发酵性能的影响机制研究仍处于初级阶段。MENDESFERREIRA A等[12]的研究表明添加氮源(磷酸二氢铵)可促进酵母细胞内的蛋白质从头合成,该研究以单一时间点、单一氮源补充展开,为氮源添加对酵母的影响机制研究开创先河。后期相关研究可基于酵母生长发酵不同阶段、补充氮源的不同类型,利用同位素示踪法结合相关基因表达分析等手段,对发酵过程中氮源补充对于酵母生长与发酵的影响进行全面系统研究。
1.3 氮源与其他非生物因素交互作用对酿酒酵母发酵和代谢的影响
葡萄醪(汁)作为成分复杂的发酵基质,其发酵过程受多因素共同调控。氮源是其中重要的非生物因素之一,此外,基质种类、糖度、酸度、发酵温度、其他营养物质含量等均为影响酵母生长、发酵的重要非生物因素。目前,多数研究致力于解析单一因素对于发酵的影响,亦有少量研究针对两个及以上因素的交互影响展开探索。
1.3.1 基质含糖量
糖作为酵母最重要的营养物质,主要来源于葡萄原料。其为酵母生长提供主要碳源,并参与酵母代谢,直接影响发酵副产物的生成。碳、氮源共同对酵母生长代谢产生重要影响。研究发现S.cerevisiaeEC1118的生物量积累随初始糖浓度的增加而增加,当基质的含糖量为200 g/L和240 g/L时,该菌株在不同氮源类型下的生物量积累存在差异,在含糖量为280 g/L时,氮源水平升高对酵母生物量积累无显著促进作用。在含糖量为240 g/L时,相较于单一氮源条件,混合氮源可显著缩短发酵时间[26]。目前,研究主要聚焦于糖和氮源对酵母发酵动力的影响,然而针对酵母代谢产物生成的研究仍存在空白。此外,基质含糖量与发酵环境中的氮源水平对酵母生长发酵的交互影响作用及机制值得深入研究,相关机理的明晰有助于在保证发酵顺利完成的前提下,为葡萄酒风味品质的提升提供理论支撑。
1.3.2 发酵温度
在葡萄酒发酵过程中,温度会对酿酒酵母的生理状态、生长代谢及最终葡萄酒成分构成产生影响。有研究通过建立葡萄酒发酵动力学的物理数学模型来探究温度对发酵的影响,酵母在不同发酵温度(11~35 ℃)、初始含糖量(265~300 g/L)和氮含量(70~350 mg N/L)下进行发酵,研究表明酿酒酵母在较高发酵温度30~35 ℃时未充分吸收利用氮源,并且发酵温度过高(30~35 ℃)、氮含量不足(80 mg N/L)会导致发酵缓慢直至停滞[29],除此之外,温度对酿酒酵母的生物量积累以及发酵性能都有很大影响[30]。因此,在氮缺乏培养基中进行低温发酵时,选用低氮耐低温菌株与酿酒酵母进行种间杂交获取的杂交菌株,在此条件下发酵速率与氮源消耗速率均更高,且具有更强的竞争能力,并可高产乙酸酯和高级醇,增加葡萄酒香气强度和复杂性[31]。然而,根据葡萄原料的氮源水平及酿造工艺不同,未来相关研究可针对不同发酵温度与氮源水平的共同影响及作用机理展开。
1.3.3 脂质
脂质作为酵母的一类生长要素,对酵母能量传输、细胞凋亡以及细胞间信息传递等具有重要作用,因此在酵母发酵中扮演着十分重要的角色。研究表明,氮源与植物甾醇对酿酒酵母的影响存在相互作用,可造成酵母的氨基酸代谢能力和发酵香气合成动力学的差异,这种交互影响在高氮条件下更为显著,同时也具有菌株特异性[32]。此外,发酵基质中脂质水平对于酵母氮代谢十分重要。在以麦角甾醇为脂质来源的发酵基质中,当麦角甾醇含量过低时,高氮水平易导致酵母细胞较高的死亡率[33]。这种交互作用亦发现于酿酒酵母发酵副产物的产生,ROLLERO S等[34]通过研究表明,植物甾醇与氮源可协同促进酿酒酵母生成异丁醇、异戊醇等发酵香气,促进葡萄酒风味品质提升。
1.3.4 其他因素
除上述讨论的因素外,葡萄品种、基质酸度、发酵环境氧气含量等均是葡萄酒发酵中重要的非生物因素,可对发酵产生重要影响。在酿酒酵母发酵过程中,氮源作为重要营养物质,为酿酒酵母生长及代谢提供能量与物质来源,其缺乏会导致酒精发酵缓慢甚至停滞。然而,酒精发酵的顺利进行以及优良次级代谢物的产生,仅依靠氮源管理无法充分实现;因此研究多种非生物因素对于酿酒酵母生长与发酵的交互影响尤为重要。目前相关研究较少,基于三个因素及以上的多因素影响酿酒酵母氮源利用的研究未见报道。后续相关研究可基于统计学模型,以模拟葡萄汁溶液为发酵基质,对包括氮源水平在内的多因素交互作用影响展开研究;并利用代谢组学等技术,解析酿酒酵母在多因素调控下的代谢通路,结合分子手段,明晰不同因素对于酿酒酵母生长发酵的交互作用机制。
2 氮源对非酿酒酵母生长与发酵性能的影响
在酿酒酵母与非酿酒酵母的混合发酵中,非酿酒酵母通过分泌多种胞外酶及自身代谢途径生成大量挥发性香气物质,进而影响葡萄酒风味[35-36]。葡萄酒中常见的非酿酒酵母主要有假丝酵母(Candida)、有孢汉逊酵母(Hanseniaspora)、梅奇酵母(Metschnikowia)、有孢圆酵母(Torulaspora)和毕赤酵母(Pichia)等。在葡萄酒酿造过程中可以利用非酿酒酵母来改善葡萄酒的风味,如水解芳香化合物前体物质,合成一些醇酯类物质[37]。此外,不同属种的非酿酒酵母的发酵特性存在一定差异,对发酵香气的贡献也各有千秋。非酿酒酵母种类繁多,发酵中的营养利用能力各不相同;发酵基质中以氮源为代表的营养物质含量与构成可直接影响非酿酒酵母的生长与发酵,甚至对葡萄酒风味品质产生影响。因此,针对非酿酒酵母氮源利用能力的研究尤为重要。
2.1 初始氮源对非酿酒酵母发酵性能的影响
氮源在非酿酒酵母的生长与发酵过程中扮演了重要角色,且存在明显的种内/种间特异性。有研究表明,氮源含量较高时可加快非酿酒酵母发酵速率[20],也有研究发现,氮源含量对其生长和发酵速率无显著影响[14],但可以缩短发酵时间[11]。此外,氮源组成也具有重要影响。混合氮源(氨基酸和铵盐)对有些菌株例如德尔布有孢圆酵母(Torulaspora delbrueckii)Viniferm和Lachancea thermotolerans2的生物量积累与发酵速率可产生积极影响,而葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)CECT 1444和美极梅奇酵母(Metschnikowia pulcherrima)CECT 13131在纯无机氮或纯有机氮中有更高的生物量积累及更快的发酵速率;L.ther motolerans2只有在混合氮源条件下可单独完成发酵,也有些菌株比如M.pulcherrimaCECT 13131和Starmerella bacillarisCECT 13129,在任何氮源条件下也无法完成发酵[25]。研究发现,Hyphopichia pseudoburtoniiIWBT Y963,Pichia burtoniiIWBT Y951,Zygoascus meyeraeIWBT Y826和异常威克汉姆酵母(Wickerhamomyces anomalus)IWBT等部分菌株的发酵香气产量相似,在含有等比例氨基酸与铵的混合氮源条件下,大部分醇类和酯类物质的产量都要高于模拟葡萄汁氮源条件下的产量[14]。SEGUINOT P等[15]研究发现,M.pulcherrimaFlavia和T.delbrueckiiBiodivaTM发酵香气的产生取决于氮源的性质,以铵为单一氮源时总产量较低,而以蛋氨酸为单一氮源时总产量最高,与S.cerevisiaeEC1118表现一致,这可能与酵母间氮源利用和代谢途径的相似性有关。
相较于酿酒酵母,初始氮源的含量及类型对非酿酒酵母生长、发酵的影响研究仍处于初级阶段。然而,随着非酿酒酵母的广泛应用,全面了解其氮源的吸收利用能力及代谢调控规律将有助于混合发酵的管理。目前该领域研究成果相对较少,且主要聚焦于探索非酿酒酵母在不同初始氮源条件下的发酵特异性表现,研究方向较为单一。未来相关研究可基于酿酒酵母现有研究思路与方法,结合非酿酒酵母种类复杂性特点;利用组学技术,探索归纳基质初始氮源对非酿酒酵母生长发酵的影响,并深入探索相关机理。
2.2 补充氮源对非酿酒酵母发酵性能的影响
发酵过程中补充氮源对非酿酒酵母发酵香气的产生有不同影响。在季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)发酵过程中,氮添加除可略微提升乙酸乙酯产量外,其他酯类与醇类物质产量均无显著变化或略有减少[11]。而对于葡萄园有孢汉逊酵母(Hanseniasporavineae),2-苯乙醇和2-乙酸苯乙酯的产量随氮添加稍有增加之后又逐渐下降,在75~100 mg N/L达到最高值,而乙酸苯乙酯和异丁醇的产量在氮添加后有所下降[38]。目前,仅有的相关研究表明氮添加对非酿酒酵母发酵的影响较小,且研究的菌株与方向较为单一,无法全面揭示其相关特性。未来相关研究可结合非酿酒酵母种间/内差异,针对不同的氮源补充含量和类型以及添加时间,对非酿酒酵母不同发酵阶段的生长与发酵表现进行全面系统的研究,并解析其相关作用机理,有助于更好利用非酿酒酵母的发酵特性。
2.3 混合发酵中酵母对氮源的竞争作用
由于非酿酒酵母酒精耐受力较低,常被用来与酿酒酵母进行混合发酵,而酿酒酵母在混合发酵中对氮源利用存在较强的竞争力[39]。在H.vineaeT02/5A 或M.pulcherrimaM03/26 G与S.cerevisiaeALG804混合发酵的研究中发现,若在中期和后期进行氮源补充,可缓解酵母间营养竞争;而在发酵初期进行氮添加或在任意时间添加较高水平氮源时,酿酒酵母的竞争力占据主导地位;此外,补充铵盐可促进M.pulcherrimaM03/26 G的发酵速率[40]。酿酒酵母与非酿酒酵母进行混合发酵时可能会出现缓慢发酵的现象,若及时进行氮源补充,则可促进发酵顺利进行[40]。由于酿酒酵母在发酵过程中会竞争性取代非酿酒酵母,因此,在混合发酵中,为保证发酵平稳进行,充分利用非酿酒酵母的发酵特性,提升葡萄酒风味质量,不同酵母间对于氮源等营养物质的竞争利用机制值得深入研究。
温度可影响部分酵母菌株在混合发酵中的竞争。例如耐低温的有孢汉逊酵母相比酿酒酵母在低温下适应能力较强,由此削弱了酿酒酵母的竞争力,甚至会取代酿酒酵母[41],该酵母占据主导会对发酵进程及最终葡萄酒成分产生不良影响。因此,温度的调控对酵母发酵十分重要,后续研究可围绕温度因素研究不同酵母对氮源的竞争作用,在保证酿酒酵母正常发酵的情况下,有效发挥非酿酒酵母的优良特性,使其向更利于葡萄酒品质的方向发展。
混合发酵可减弱非酿酒酵母不良风味物质的生成量,这与酿酒酵母与非酿酒酵母的接种比例有一定关系。研究发现,通过调节非酿酒酵母的接种比例,可定向调控乙酸乙酯、乙酸苯乙酯、2-苯乙醇、2-甲基-1-丁醇等挥发性化合物的最终浓度[42]。因此,为促进葡萄酒风味品质提升,深化研究结果的实践价值,后续在进行混合发酵中酵母对氮源等营养物质竞争机制的相关研究时,可结合不同酵母接种比例进行全面综合探索。
3 结语和展望
近年来,非酿酒酵母因其优良的发酵特性而备受关注,常被用于与酿酒酵母的混合发酵中,其潜在产香能力可以改善葡萄酒品质。因此,在葡萄酒酿造过程中,氮源对于非酿酒酵母产香能力的影响值得更多关注。此外,非生物因素,例如发酵温度、基质含糖量、基质酸度等对于酵母的氮源吸收与利用亦有影响[5,10];然而,此类研究仍处于初级阶段。基于多因素的酵母氮源利用研究及相关机制探索可被列入未来研究方向。
氮源对酵母生长和发酵的影响具有种内/种间特异性,为进一步挖掘酵母发酵特性与共性,深化对酵母种质资源的理解与利用,后续研究应重视针对酵母氮源利用与代谢的分子机制探索。同时,作为氮源吸收同化的调控途径,氮代谢物阻遏效应(nitrogen catabolite repression,NCR)和SPS(Ssy1-Ptr3-Ssy5)机制已在酿酒酵母中被详尽研究[5,43]。然而,相关调控路径在非酿酒酵母中尚未完全阐明;相关机理的深入探索对于混合发酵中酵母间的营养竞争研究具有重要意义。
发酵终止在葡萄酒酿造中时有发生。研究发现,发酵终止后,即便及时进行补救,葡萄酒质量也会被严重影响[44]。氮源缺乏是引起发酵中止的众多因素之一,目前普遍解决方式是补充氮源,但由于菌株特异性等原因,补充氮源对酵母生长及发酵的影响无法完全预测,研究发现发酵中补充氮源会降低部分发酵香气物质产量,对葡萄酒质量产生负面影响[19]。因此,后续在针对发酵过程中补充氮源进行研究时,可结合氮源与其他酿酒环境中非生物因素的交互作用,利用多组学手段,对多因素影响机理进行深入挖掘,并解析混合因素影响下酵母的分子调控机制。

