近5年肺移植科及呼吸科患者细菌碳青霉烯酶分布及耐药调查
李梦雪,李子尧,鲁炳怀
(中日友好医院 呼吸中心,中国医学科学院呼吸病学研究所,国家呼吸医学中心,北京 100029)
随着临床上抗菌药物的大规模和不合理应用,耐药菌株的分离率逐年增多,这对公共卫生造成了严重威胁[1]。近年来,革兰阴性杆菌的耐药问题日益严峻,耐碳青霉烯类肠杆菌目(carbapenem-resistantEnterobacteriaceae,CRE)受到广泛关注[2]。然而,目前对CRE 在肺移植感染患者中的流行及其耐药的调查较少。
本研究收集北京某医院2017 年6 月—2021年5 月肺移植及呼吸病患者中分离的CRE 菌株,对其标本来源、碳青霉烯酶分布及其他抗生素敏感率进行分析,以期为临床医生提供参考。
1 材料与方法
1.1 临床资料
临床分离菌株标本取自北京某医院2017年6月—2021 年5 月肺移植科(简称LT 组)、呼吸科(简称nLT-nS 组)及重症呼吸科(简称nLT-S 组)患者。本研究经中日友好医院伦理委员会审批通过(审批号:2021-YKY-14)。参与者的书面知情同意书被豁免,相关受试者的隐私不受影响。
1.2 常规药敏实验
从标本中分离的亚胺培南或美罗培南耐药(VITEK-2全自动分析鉴定仪检测)的肠杆菌目细菌,依据保留同一患者第一株相同细菌的原则,剔除重复菌株后纳入最终分析。同时使用纸片扩散法对纳入菌株进行复核,确证纳入菌株的表型。记录VITEK-2 全自动分析检定仪的药物敏感性实验结果。
1.3 碳青霉烯酶抑制试验
碳青霉烯酶抑制试验参照文献[3]进行,并有一些修改。将待检菌株调整至0.5标准麦氏浊度,使用棉签涂布在MH 琼脂平板上。将4 个含有IPM(10μg)(Becton Dickinson,美国)的纸片分别放置在该平板上后,立即将10μl 0.1M EDTA(索莱宝,中国)溶液加到IPM 纸片上,命名为R1。将10μl 30mg/ml 3-氨基苯硼酸溶液(APBA,索莱宝,中国)加到IPM纸片上,命名为R2。将10μl 0.1M EDTA溶液+10μl 30mg/ml APBA 溶液加到IPM 纸片上,命名为R1+R2。最后一个没有添加任何内容命名为R0。将培养板在35°C下培养16~20h,并用游标卡尺测量区域直径。R0 和R2 的直径差>5mm,判定为产A类碳青霉烯酶;R0和R1的直径差>5mm,则判定为产B类碳青霉烯酶。
1.4 多重实时荧光定量PCR 检测碳青霉烯酶耐药基因
碳青霉烯酶耐药基因检测参考文献[4]。将每个引物与探针按适当比例混合,并添加适量的DNA 模板。将TaqMan™ Fast Advanced Master Mix(ABI,美国)添加到反应体系中,使其终浓度为1X。然后用ddH2O 将反应体系稀释至20μl。使用QuantStudio 5(ABI,美国)进行多重实时定量PCR。如果有代表相应基因的荧光信号被收集到,表示检测到相应的碳青霉烯酶耐药基因。检测blaKPC,blaNDM,blaIMP,blaVIM及blaOXA-48基因。
1.5 质量控制
全自动微生物分析仪和药敏纸片扩散法均按照美国临床实验室标准化协会(CLSI)要求进行质量控制。质控菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603、阴沟肠杆菌 ATCC 700323、铜绿假单胞菌ATCC 27853,每周进行1次质控。
1.6 统计学分析
应用SPSS22.0 软件进行统计学分析。对肺移植科及非肺移植科的计数资料数据,比较采用卡方检验及Fisher 精确概率法。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 菌株分类与来源
本研究中LT 组共纳入58 株CRE。菌株来源的患者中男49 例,女9 例;年龄17~72 岁,四分位数为53 岁,中位数为61.5 岁。标本类型以呼吸道标本为主,占77.59%(45/58),2 株菌株分离自尿液,1株菌分离自血液。详见表1。
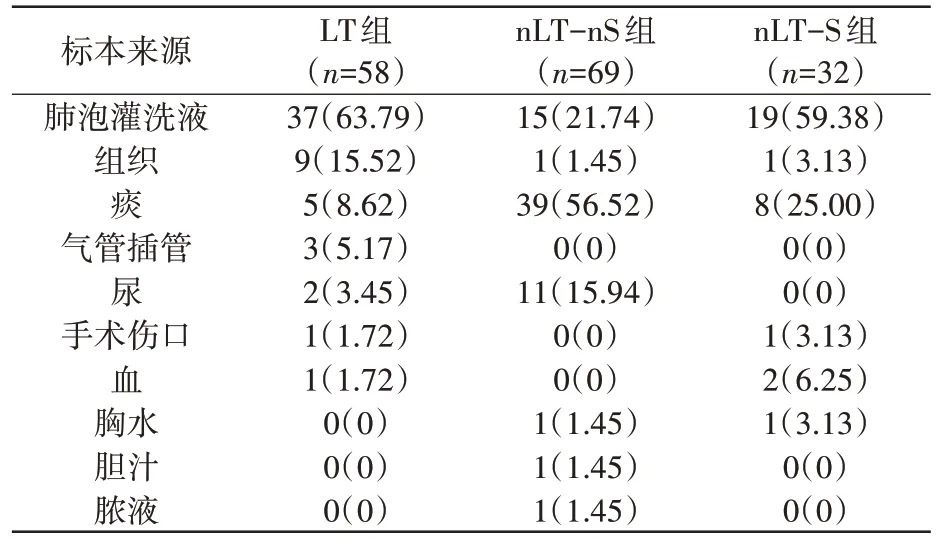
表1 CRE的标本来源 n(%)
nLT-nS 组纳入69 株CRE。来源于呼吸科患者,其中男16 例,女53 例;年龄19~102 岁,四分位数为57岁,中位年龄为68岁。标本类型以呼吸道标本为主,占78.26%(54/69),另有11 例标本分离自尿液标本,其余分离于组织、胸水、胆汁及脓液共计4例。详见表1。
nLT-S 组纳入32 份CRE。来源于重症呼吸科患者,其中男5 例,女27 例;年龄23~92 岁,四分位数为61.5 岁,中位数为65.5 岁。菌株主要分离自呼吸道样本,占84.38%(27/32),另2 株分离于血液,其余样本分离于胸水,组织及手术伤口各1株。详见表1。
2.2 CRE细菌种类分布(图1)
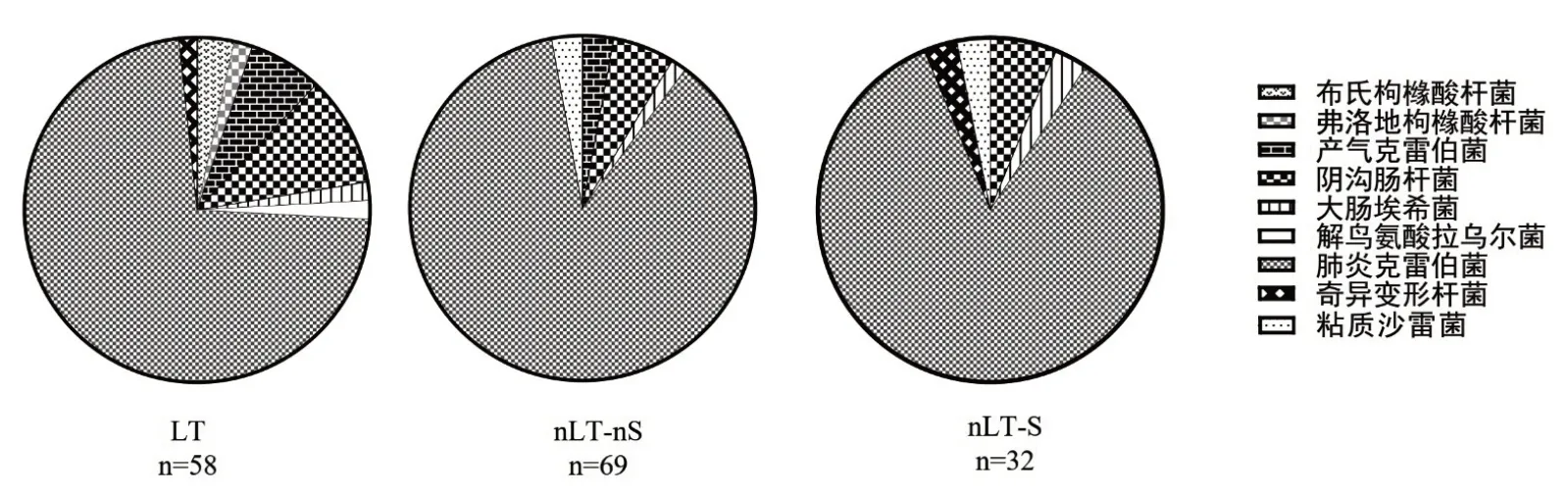
图1 CRE的菌种分布
LT组分离的菌株中,以肺炎克雷伯菌最为多见,占72.41%(42/58),阴沟肠杆菌占10.34%(6/58),产气克雷伯菌约6.90%(4/58)。
nLT-nS 组同样以肺炎克雷伯菌最为多见,占86.96%(60/69),阴沟肠杆菌占5.80%(4/69)。
nLT-S组中,肺炎克雷伯菌最常见,占84.38%(27/32),阴沟肠杆菌占6.25%(2/32),大肠埃希菌、奇异变形杆菌及粘质沙雷菌仅分离1株。
2.3 碳青霉烯酶抑制试验
本研究的3 组标本共159 株CRE 中全部检出碳青霉烯酶,具体见表2。
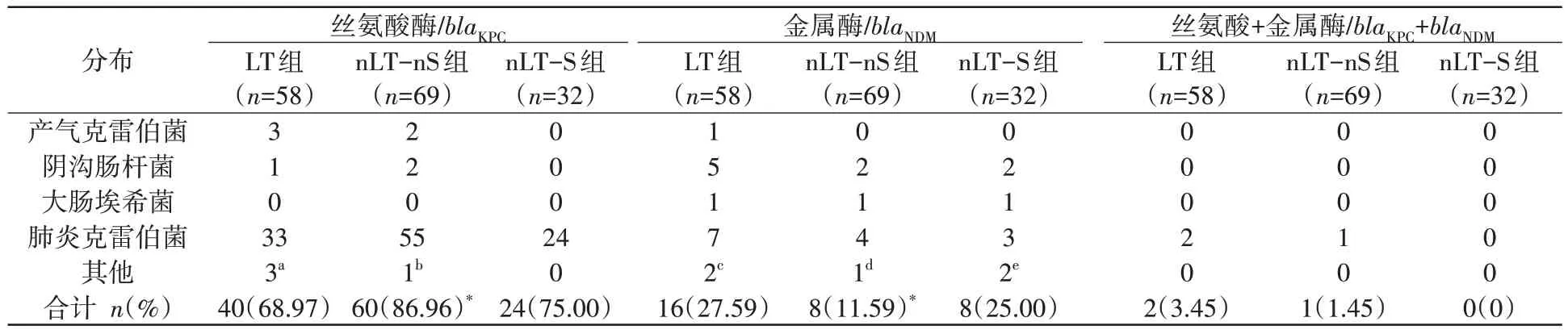
表2 碳青霉烯酶分布情况
LT 组检出单一丝氨酸酶40 株(68.97%),单一金属酶16 株(27.59%),金属酶和丝氨酸酶共存菌株2株(3.45%),且均为肺炎克雷伯菌。肺炎克雷伯菌中丝氨酸酶分布最广泛(78.57%,33/42)。产气克雷伯菌(75%,3/4)、布氏枸橼酸杆菌(100%,2/2)与弗劳地枸橼酸杆菌(1/1,100%)也主要产丝氨酸类碳青霉烯酶。
nLT-nS 组中,单产丝氨酸酶的菌株共60 株(86.96%),单产金属酶菌株8株(11.59%),金属酶和丝氨酸酶共产菌株仅1 株,且为肺炎克雷伯菌。肺炎克雷伯菌中丝氨酸酶分布最广泛(91.67%,55/60)。产气克雷伯菌(100.00%,2/2)、阴沟肠杆菌(50.00%,2/4)及粘质沙雷菌(50%,1/2)也主要产丝氨酸酶类碳青霉烯酶。
nLT-S组中,24株(75.00%)菌检出丝氨酸酶,且均为肺炎克雷伯菌;另8 株菌(25.00%)均检出金属酶,且肺炎克雷伯菌及阴沟肠杆菌最多。无携带双酶的菌检出。
单一丝氨酸酶及金属酶分布在LT 组与nLTnS组之间有统计学差异,丝氨酸酶在nLT-nS组的分布较广泛(P<0.05),而金属酶在LT 组检出较多(P<0.05)。其他单酶及双酶分布不具有统计学差异(P>0.05)。
2.4 碳青霉烯酶耐药基因的鉴定
该159 株菌经多重实时荧光定量PCR 鉴定,均存在碳青霉烯酶基因。其中在上述表型鉴定为丝氨酸酶的菌株均携带blaKPC基因,表型鉴定为金属酶的菌株均存在blaNDM基因。未检出blaIMP,blaVIM及blaOXA-48基因。详见表2。产β-内酰胺酶(Klebsiella pneumoniae carbapenemase,KPC)及新德里金属-β-内酰胺酶(New Delhi Metallo-beta-lactamase,NDM)的碳青霉烯酶在LT 组与nLTnS组的分布具有统计学差异(P<0.05)。
2.5 其他药敏分析
LT、nLT-S 与nLT-nS 组之间,其他抗生素的药敏结果上没有统计学差异(P>0.05)。各组中,单环β-内酰胺(氨曲南)的敏感率均较低,均低于10%;喹诺酮类抗生素(环丙沙星与左氧氟沙星)的敏感率更低,均低于5%。而氨基糖苷类抗生素(妥布霉素和阿米卡星)与复方新诺明药物敏感率相对较高,均高于20%。详见表3。

表3 各组标本检测对其他抗生素耐药的敏感率 n(%)
3 讨论
3.1 CRE对碳青霉烯类抗菌药物耐药的机制
机制主要包括碳青霉烯酶的产生、膜孔蛋白的改变和外排泵活性的增加等[5~7]。其中,以碳青霉烯酶的产生最为常见。碳青霉烯酶主要分布在Ambler 分类系统中的A、B 和部分D 类酶中。A(KPC 为代表)和D 类酶(OXA-48 为代表)称为丝氨酸酶(丝氨酸作为其活性位点)能水解大多数β-内酰胺药物,但可被新型β-内酰胺酶抑制剂包括阿维巴坦、瑞来巴坦和维博巴坦所抑制[8~10],而B 类酶(NDM 为代表)称为金属酶(金属锌作为其活性中心)可水解除氨曲南以外的大多数β-内酰胺类药物,β-内酰胺酶抑制剂无效,但可被EDTA所抑制[8,11,12]。
3.2 CRE在肺移植患者中的流行情况
CRE已经成为威胁全球人类健康的重要病原体。实体器官移植是治疗各种终末期器官疾病的公认疗法[13]。革兰阴性杆菌感染是引起移植后患者发病及死亡的主要原因[14],器官移植后长期使用免疫抑制剂的患者更易感染CRE,且临床预后不佳[15,16]。然而,目前对CRE 在肺移植患者的流行情况报道较少,对其耐药机制更是知之甚少。本研究对中国某医院肺移植患者及呼吸科患者分离到的CRE 进行了分析,探究其标本来源与碳青霉烯酶分布情况。
本研究中肺移植科菌株来源主要是呼吸道标本(77.59%),包括肺泡灌洗液、痰、气管插管。这说明肺移植术后患者肺部容易感染细菌,这与以往报道的文献相似[17,18]。在尿液和血液中也有部分病原菌分离,说明肺移植患者也可出现其他部位感染。在呼吸科患者中,痰标本中分离到致病菌的比率较高,说明非肺移植患者呼吸系统以外的感染比率相对较低。
与以往多数文献报道相近,引起肺移植患者感染的CRE主要是肺炎克雷伯菌[17,19]。这可能与我国广泛且大量使用抗菌药物有密切关系,同时也可能与欧美地区同我国的菌种分布差异相关。来自于意大利的研究显示,肠杆菌属分离率最高,大肠埃希菌次之,然后是肺炎克雷伯菌[20]。移植术后患者易引起继发性血流感染,这对患者来说非常危险,需引起临床的重视[21,22]。本研究中肺移植科与呼吸科患者结果相近,均以肺炎克雷伯菌与阴沟肠杆菌的分离多见。
本研究中碳青霉烯酶在肺移植科及呼吸科患者中的分布差异具有统计学意义。呼吸科患者中KPC 占比高达86.96%,肺移植科仅为68.97%;金属酶分别为11.59%和27.59%。但两者均主要以KPC 分布为主,且集中在肺炎克雷伯菌中。这可能与产KPC 的肺炎克雷伯菌在我国广泛传播相关[23]。肺移植患者中,枸橼酸杆菌属主要产KPC,大肠埃希菌与阴沟肠杆菌主要产NDM,这与之前的报道一致[24]。产气克雷伯菌也主要产KPC,这可能和产气克雷伯菌与肺炎克雷伯菌的亲缘关系较近相关[25]。头孢他啶-阿维巴坦在临床上是对抗CRE 非常有效的药物,尤其是针对产KPC 的菌株,在肺移植患者的效果也很好[26]。但此药物对产NDM 的菌株无效,由于其金属酶的高分离率,因此肺移植患者分离出大肠埃希菌、阴沟肠杆菌等需慎重考虑用药。同时本研究也发现了2 株共产KPC与NDM的菌株。
另外,我们还调查了肺移植和呼吸病患者对其他抗菌药物的敏感率,发现对单环β-内酰胺(氨曲南)、喹诺酮类抗菌药物(环丙沙星、左氧氟沙星)的药物敏感率最低;对氨基糖苷类抗菌药物(妥布霉素、阿米卡星)及复方新诺明的敏感率相对较高。药物敏感率在3 组患者间无统计学差异,这可能和本研究样本量较少相关。因此,氨基糖苷及复方新诺明也是合适的选择,但尚未检索到相关药物敏感率的文献。
综上,本研究中呼吸道标本是分离菌株的主要来源,且均以产KPC 的肺炎克雷伯菌为主,NDM 集中分布在大肠埃希菌及阴沟肠杆菌中。肺移植患者中金属酶分布较呼吸病患者高,差异具有统计学意义。因此,临床对分离出阴沟肠杆菌的患者用药更加慎重。

