面筋蛋白咸味肽的分离纯化及结构鉴定
温青玉,张 雨,李天齐,张康逸,*
(1.河南省农业科学院农副产品加工研究中心,河南省全谷物小麦制品加工国际联合实验室,河南省全谷物鲜食加工工程技术研究中心,河南 郑州 450002;2.河南省安康食品科技研究院,河南 郑州 450047;3.河南省安康未来食品科技有限公司,河南 郑州 450066)
咸味是食品的5 种基本口味之一[1]。食盐作为目前最基础、应用最广泛的咸味剂,可以维持机体正常生理功能,调节细胞渗透压[2]。但过多摄入会对心、脑、肾等器官产生损害,增加高血压的发病率[3-4]和抑郁症的患病风险[5]。世界卫生组织建议成人盐摄入量不超过6 g/d,而调查显示我国居民实际盐摄入量在12 g/d左右[6]。目前,食盐替代物主要有咸味肽、咸味增强肽、风味改良剂等[7]。其中,咸味肽作为一种可呈现咸味的多肽,是一种较为理想的食盐替代物[8],其来源于天然动植物,开发与应用前景广阔,具有重要的社会意义和经济价值。
近年来,通过生物酶法制备呈味肽或生物活性肽成为大宗低值蛋白深加工的研究热点[9],咸味肽的开发逐渐被研究者重视起来。吴迪等[10]通过响应面分析优化酶水解小黄鱼(Larimichthys polyactis)蛋白制备咸味肽。杨文君等[11]通过风味蛋白酶深度酶解豌豆蛋白制备咸味肽,其中小分子肽(<1 kDa)占比65.60%,为植物蛋白酶解制备咸味肽提供了理论依据。然而,酶解物一般为蛋白质、肽和氨基酸的混合物,其中咸味肽占比低,咸味不突出,高纯度的咸味肽需要经过分离纯化获得。目前,肽的分离纯化主要有膜分离技术、色谱技术、电泳技术等。其中,膜分离技术以及色谱技术具有分离效率高、产物纯度高、分离速度快等特点,是制备纯化天然产物的极好手段[12-15]。李迎楠等[16]将牛骨粉碎酶解,通过超滤膜过滤,使用SephadexG-25凝胶色谱和制备型高效液相色谱仪对酶解液逐级纯化,最终得到分子质量小于1000 Da的短肽咸味肽。吴阳[17]通过分离纯化技术从双孢菇中分离出浓厚感风味物质,并利用超高效液相色谱-四级杆飞行时间串联质谱进行鉴定得到序列Gly-His-Gly-Asp。彭增起等[18]从大豆蛋白中分离纯化得到高纯度咸味肽,并通过蛋白质测序仪得到咸味肽氨基酸序列为Gly-Lys。面筋蛋白中谷氨酸和脯氨酸含量尤为丰富,一级结构中富含呈味肽序列,是制备呈味肽和咸味香精的良好原料[19],但小麦中的咸味肽序列还未见报道。
本研究利用食品级蛋白酶复合对面筋蛋白粉进行酶解,通过逐级纯化酶解液对小麦中的咸味肽进行分离,选用超滤膜过滤、Sephadex G-15凝胶色谱对冻干后咸味组分进行纯化并收集,并通过液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)对纯化后的组分进行结构鉴定分析,旨在为咸味肽的开发利用提供一定技术支持,有利于咸味肽在食品加工中的应用。
1 材料与方法
1.1 材料与试剂
小麦面筋蛋白 河南省封丘县华丰粉业有限公司;混合酶(46000 U/mL风味蛋白酶∶28000 U/g碱性蛋白酶∶44000 U/g复合蛋白酶=0.45∶0.36∶0.19)诺维信(中国)生物技术有限公司;氢氧化钠(食品级)天津市津华化工厂;盐酸(食品级) 河南省开封市旭信化工有限公司;食盐 河北绿海康信多品种食盐有限公司;甲醛、甲醇、乙腈(均为色谱纯) 赛默飞世尔科技(中国)有限公司;大孔树脂DA201-C 天津市海光化工有限公司;平膜UE001、UE003、UE005 中科瑞阳膜技术(北京)有限公司。
1.2 仪器与设备
YP-N型电子分析天平 上海精密仪器仪表有限公司;DSHZ-300型多用途恒温水浴振荡器 江苏太仓市实验设备厂;JW1042低速离心机 安徽嘉文仪器装备有限公司;K1100全自动凯氏定氮仪 山东省济南海能仪器有限公司;SXJD-V6-10箱式电阻炉马弗炉 江苏省苏州江东精密仪器有限公司;101-3EBS电热鼓风干燥箱 北京市永光明医疗仪器有限公司;FD-100S真空冷冻干燥机 北京惠城佳仪科技有限公司;SA402B型电子舌 日本INSENT公司;1260(四元泵)高效液相色谱仪 安捷伦科技(中国)有限公司;MSM2011实验用膜分离装置 上海摩速科学器材有限公司;玻璃层析柱(2.6 cm×60 cm) 上海创赛科学仪器有限公司;HL-2B数显恒流泵 上海精科实业有限公司;Easy-nLC 1200高效液相色谱仪、Q ExactiveTMHybrid Quadrupole-Orbitrap™ MS仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 面筋蛋白咸味酶解液的制备
根据前期实验结果[20],在最优条件下制备面筋蛋白咸味酶解液。配制5 g/100 mL小麦蛋白悬浊液,按照3800 U/g酶活力加入混合酶,在pH 7.5、55 ℃条件下酶解6 h。反应结束后沸水浴15 min灭酶,4000 r/min离心25 min,获得上清液为咸味酶解液。
1.3.2 咸味酶解液脱盐
采用大孔树脂DA201-C对面筋蛋白咸味酶解液进行脱盐处理。用无水乙醇将大孔树脂DA201-C浸泡24 h,使树脂充分溶胀,用去离子水洗至上清液在220 nm波长处无吸收峰且无乙醇气味,抽滤备用[21]。将处理过的DA201-C大孔树脂装入250 mL锥形瓶中,加入面筋蛋白咸味酶解液进行静态吸附和解吸,脱盐条件为:上样pH 5.0,酶解物质量浓度为30 mg/mL,解吸剂为75%乙醇溶液,收集样品旋转蒸发后冻干备用。根据凯氏定氮法、GB 5009.4—2016《食品中灰分的测定》[22]和GB 5009.3—2016《食品中水分的测定》[23]测定脱盐前后蛋白含量、水分和灰分变化。
1.3.3 超滤分离
采用膜分离装置对脱盐后小麦面筋蛋白咸味粗肽进行不同分子质量截留。将小麦面筋蛋白咸味粗肽用去离子水溶解,然后在温度25 ℃、压力2.5 MPa、转速400 r/min条件下依次通过滤膜UE005(5 kDa)、UE003(3 kDa)、UE001(1 kDa),分别收集4 部分(>5 kDa;3~5 kDa;1~3 kDa;<1 kDa)并命名为F1、F2、F3、F4,浓缩干燥成粉末后进行感官评价。
1.3.4 凝胶过滤色谱分离
将超滤后咸度较高的组分用去离子水配制成质量浓度为100 mg/mL,经0.45 μm水相过滤后,用凝胶层析柱再次进行分离纯化。预处理的Sephadex G-15装满2.6 cm×60 cm的玻璃层析柱,以去离子水作为洗脱液,上样量5 mL,流速1.0 mL/min,紫外检测仪波长为220 nm。通过谱图分别收集各个洗脱峰,命名为P1、P2、P3、P4、P5,冷冻干燥成粉末,并进行感官评价。
1.3.5 分子质量分布测定
参考Zhou Xue等[24]的方法并略作修改。样品过0.22 µm微孔滤膜,选择TSK G2000 SWXL色谱柱(300 mm×7.8 mm,5 μm)进行测定,流动相为乙腈∶水∶三氟乙酸=20∶80∶0.1,进样量20 μL,柱温平衡在35 ℃,流速0.5 mL/min,在220 nm波长处检测流出物。以细胞色素C(12500 Da)、抑肽酶(6512 Da)、VB12(1300 Da)、四肽GGYR(451 Da)和三肽GGG(189 Da)为标准品构建校准曲线,通过比较样品中不同组分的保留时间计算样品的分子质量分布。
1.3.6 LC-MS/MS鉴定
LC条件:色谱柱预柱为Acclaim PepMap RPLC C18(300 μm×5 mm,5 μm,100 Å),分析柱为Acclaim PepMap RPLC C18(150 μm×150 mm,1.9 μm,100 Å);流动相A:99.9%水+0.1%甲酸,流动相B:0.1%甲酸+80%乙腈;梯度洗脱程序:0~2 min,96%~92% A、4%~8% B;2~45 min,92%~72% A、8%~28% B;45~55 min,72%~60% A、28%~40% B;55~56 min,60%~5% A、40%~95% B;56~66 min,5% A、95% B;流速600 nL/min。
将肽段用500 μL上样缓冲液(含99.9% H2O、0.1%甲酸)溶解后,以4 ℃、13200 r/min离心20 min,取上清液,直接进入Q Exactive MS仪进行在线检测。
MS 条件:一级M S:分辨率70000;AGC目标3×106;最大喷射时间100 ms;扫描范围m/z300~1800。二级MS:分辨率17500;AGC目标1e5;最大喷射时间50 ms;TopN 20;NCE/steppedNCE 28。
1.3.7 咸味评价
参考李微等[25]的咸味评价方法,对面筋蛋白咸味酶解液和分离纯化各组分进行感官评价。感官评价小组由经过专业培训的8 名男性和8 名女性组成,年龄在20~35 岁之间。咸味评分采用10 分制(0表示没有咸味,3表示咸味微弱,5表示咸味适中,7表示咸味强烈,10表示咸味非常强烈)。0.2%食盐溶液的咸味作为参照(咸味得分为5)。评定过程在(25±2)℃的感官评价室进行,感官评价人员每次先取1.0 mL 0.2%食盐溶液,然后再取1.0 mL样品评定其咸味(不考虑其他味道),10 s后吐出漱口,每个样品间隔1.0 min,每次测定样品个数不超过6 个。以感官评分的平均值作为最终咸味得分。
1.4 数据处理
2 结果与分析
2.1 面筋蛋白咸味酶解液脱盐后成分分析
由表1可知,大孔树脂纯化脱盐后小麦面筋蛋白咸味粗肽中蛋白质质量分数由71.37%提高至91.18%,灰分质量分数由12.37%下降到1.83%,说明DA201-C大孔树脂对小麦面筋咸味粗肽脱盐效果较好,但面筋蛋白酶解液的咸味没有显著增加,说明酶解液中盐离子对酶解液的咸味影响不大。

表1 脱盐前后面筋蛋白咸味酶解产物的成分和咸味评分Table 1 Composition and saltiness score of the salty enzymatic hydrolysate of gluten before and after desalting
2.2 面筋蛋白咸味酶解液超滤膜分离分析
超滤膜分离常用于蛋白制品的分离纯化,具有工艺流程短、耗用化学试剂少等优点[26]。将脱盐后的酶解液通过超滤装置进行初步分离纯化,通过3 种不同分子质量滤膜可将小麦面筋蛋白咸味酶解液分成4 个组分:F1、F2、F3、F4。
由表2可知,脱盐后酶解液为棕黄色浊液,经5 kDa超滤膜处理后,截留液成深棕黄色,与酶解液相比更加浑浊;同时,经过3 kDa与1 kDa超滤膜的分离,透过液呈浅黄色,色泽澄清透明,说明通过超滤可以有效去除酶解液中的浑浊物质。通过感官评定将不同组分与0.2%食盐溶液进行对比,可以看出,分子质量3 kDa以上的截留液的咸味值相对较弱,而分子质量3 kDa以下的组分咸味值明显超过了0.2%食盐溶液。其中,1~3 kDa截留液的咸味值与脱盐后酶解液接近,而小于1 kDa的透过液的咸味值最高。综上所述,酶解液中呈咸味的成分可能主要集中在3 kDa以下。

表2 超滤各组分咸味评价Table 2 Saltiness evaluation of ultrafiltration fractions
对超滤后得到的4 个组分肽分子质量分布进行测定,如表3所示,超滤膜能够富集并浓缩不同分子质量的肽段。通过逐级分离,分子质量小于1 kDa的肽段比例不断增加,最终可达到84.23%的收集效率,比脱盐后的小麦面筋蛋白咸味粗肽中小于1 kDa的比例增加9.47%。然而,超滤膜并不能达到100%完全富集的效果,截留液中存在比超滤膜更小的组分。这主要是因为采用超滤膜分级超滤时,尽管可以通过不断稀释样液以延长超滤时间提高小于膜组分的透过效率,但样液中小于膜的组分仍无法完全透过超滤膜[27]。而截留液中存在比超滤膜较大的组分,可能是因为酶解液中肽的分子结构大部分呈线性结构,在膜附近由于自身的可变形范围较大,再加上压力的驱动作用会使部分大分子质量的肽通过超滤膜进入透过液,因此超滤膜实际有效截留分子质量大于理论截留分子质量。
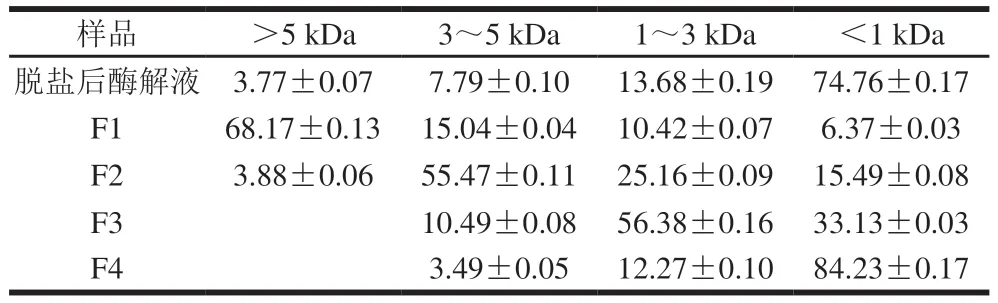
表3 超滤膜处理后不同组分肽分子质量分布Table 3 Molecular mass distribution of peptides in different ultrafiltration fractions%
2.3 Sephadex G-15阳离子层析结果与分析
凝胶柱Sephadex G-15被用来分离小于1000 Da的肽段,同时具有较好的脱盐作用[28]。由图1可知,F4组分被分离成5 个组分(P1、P2、P3、P4、P5),保留时间在125~460 min之间,各峰之间距离适中,说明分离效果较好。其中,P1出峰时间最早,分子质量最大;P2的峰型窄而尖,响应值较大,说明此肽段纯度较高;P3、P4、P5峰型比较圆滑且较宽,说明这些峰的肽段分子质量范围跨度较大,含有多种物质[29]。经多次分离,分别收集各组分,冷冻干燥后进行感官评价。

图1 超滤所得组分凝胶渗透色谱图Fig.1 Gel filtration chromatogram of F4
超滤后F4组分经Sephadex G-15凝胶柱分离得到的5 个组分咸味评价如表4所示,P1、P2组分咸味值相对较高,尤其是P2组分,与超滤后的F4组分相比咸味值明显提升。而洗脱时间越靠后的组分(P3、P4、P5),咸味值越小,说明咸味肽主要集中在P1与P2组分中。此外,P1峰较宽,且收集到的样品颜色最深,可能杂质色素含量较高;P2组分中咸味肽含量最高且肽段较纯,因此选择P2组分进行结构鉴定。

表4 凝胶层析分离组分的咸味评价Table 4 Salty taste evaluation of subfractions separated by gel filtration chromatography
2.4 咸味肽序列的鉴定
多肽键中酰胺键易于断裂,产生较多b和y离子。通过分析二级MS中的b和y离子碎片,得到多肽的氨基酸序列[30]。咸味组分P2通过LC-MS/MS系统分析检测,通过手动测序及数据库对比后得到5 种响应值较高的咸味肽氨基酸序列(图2):PFGQQ(Pro-Phe-Gly-Gln-Gln)、PFSPQ(Pro-Phe-Ser-Pro-Gln)、QPFP(Gln-Pro-Phe-Pro)、PDFP(Pro-Asp-Phe-Pro)、FDDP(Phe-Asp-Asp-Pro),分子质量分别为576.28、575.28、488.25、475.22、493.21 Da。Zheng Yingying等[31]在天然酵母FA31中发现Asp-Asp、Glu-Asp、Asp-Asp-Asp、Ser-Pro-Glu和Phe-Ile 5 种咸味肽。从5 条肽段的氨基酸序列可以看出,这些肽段包含已报道的咸味二肽或三肽序列,这可能是造成这5 条肽段呈咸味的重要原因。
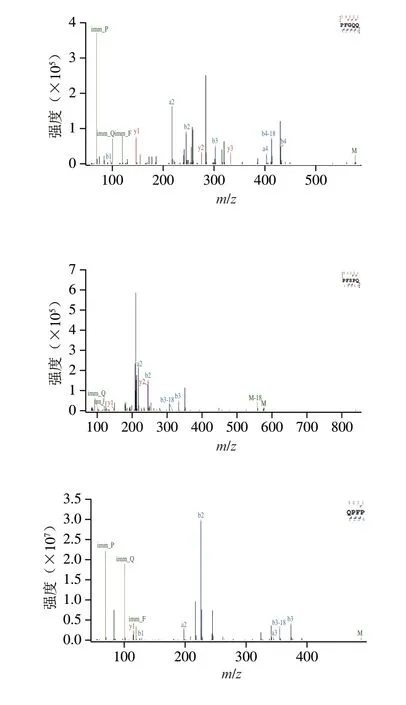

图2 P2组分中5 个肽段的二级MS图Fig.2 Secondary mass spectra of 5 peptide fragments in subfraction P2
3 结论
利用食品级蛋白酶复合对面筋蛋白粉进行酶解,通过逐级纯化酶解液对小麦中的咸味肽进行分离,选用超滤膜过滤、Sephadex G-15凝胶色谱对冻干后咸味组分进行纯化并收集,并通过LC-MS/MS对纯化后咸味肽含量最高且肽段较纯的组分进行结构鉴定。经LC-MS/MS鉴定出5 种咸味肽序列,分别为PFGQQ、PFSPQ、QPFP、PDFP、FDDP,其分子质量分别为576.28、575.28、488.25、475.22、493.21 Da,此序列包含已报道的咸味二肽或三肽序列。该结果为面筋蛋白咸味肽的开发提供了一定理论指导,对于咸味肽的发展具有重要意义。

