基于磁共振肝脾影像组学特征结合临床影响因素联合模型诊断显著性肝纤维化的效果评价
李佳家,王兆洪,倪仲琳,陈辉,周斌,童洪飞
温州医科大学附属第二医院 肝胆外科,浙江 温州 325027
肝纤维化是全球面临的公共卫生问题,在常见疾病所致死亡病因中,肝纤维化所致死亡排在第11位[1]。肝纤维化是一种慢性肝损伤的修复反应,其特征为细胞外基质和胶原蛋白沉积[2]。早期常无明显临床症状,随着肝纤维化进展,后期有多器官受累,常出现上消化道出血、肝性脑病、严重感染等并发症。许多临床研究表明早中期肝纤维化通过治疗干预是可逆转的[3],因而,早期诊断对肝纤维化的诊治有重要意义。目前肝组织穿刺活检是肝纤维化分期的金标准[4],常用METAVIR评分系统将肝纤维化分为F0~F4期[5-6];但肝活检是一种有创性操作,存在出血、感染等风险,患者接受度低,且存在抽样误差和观察者间的主观差异,不适合作为监测肝纤维化进展的随诊检查方法。目前,在临床资料研究方面,有研究显示高龄及性别(男性)是发生肝纤维化的高危因素,且也有相关研究指出雌激素的缺乏可能与肝纤维化进展相关[7-8]。在血清学研究方面有相关研究指出对于慢性乙型肝炎,FIB-4 指数(fibrosis 4 score)<1.45 者往往无明显肝纤维化或只有≤F2级肝纤维化,而此结果与肝穿刺结果的符合率为94.7%[9]。折文利等[10]发现单一的血清学指标在诊断肝纤维化存在敏感性及特异性低等不足。因此寻找一种整合临床、血清学、影像组学进行综合评分来诊断显著性肝纤维化的方法,对肝纤维化的个体化治疗具有重要临床意义。
1 资料和方法
1.1 一般资料 选取2017年5月至2022年5月在温州医科大学附属第二医院接受肝脏组织活检或肝脏手术后经病理证实为肝纤维化,并于6个月内行腹部MRI平扫检查的患者110例。纳入标准:①具有病理诊断分期;②具有完整的临床实验室检查及MRI影像资料。排除标准:①MRI影像资料不完整;②临床资料不完整;③图像质量不佳;④肝脏弥漫性病变影响感兴趣区(regions of interest,ROI)勾画者;⑤脾脏病变影响ROI勾画者。根据上述纳入标准和排除标准,最初收集肝纤维化患者235例,6个月内行MRI平扫检查患者175例,排除患者65例,最终纳入符合条件患者110例。按7∶3比例随机将患者分成训练集(77例)和测试集(33例)。本研究经温州医科大学附属第二医院伦理委员会批准(审批号:2022-YL-46-01)。
1.2 临床及血清学检查资料 收集患者临床及实验室血清学检查资料,包括性别、年龄、身高、体质量、是否为乙肝患者、天冬氨酸氨基转移酶(aspartate transaminase,AST)、丙氨酸氨基转移酶(alanine transaminase,ALT)、血清白蛋白(albumin,ALB)、国际标准比值(international normalized ratio,INR)、血小板计数(platelet,PLT),所有血清生化指标均检测于病理活检前1周。
1.3 肝纤维化病理分期标准 尽量取与MRI扫描ROI相符合的区域组织,进行石蜡包埋,HE染色,在对患者基本情况未知的情况下,由两位高年资病理科医师参照METAVIR评分系统进行肝纤维化分期诊断:F0为无纤维化;F1为汇管区纤维化,无纤维间隔形成;F2为汇管区纤维化,少量纤维间隔形成;F3为大量纤维间隔,无硬化结节;F4为肝硬化[5]。本研究中F≥2定义为显著性肝纤维化组,F<2定义为无或非显著性肝纤维化组。
1.4 MRI检查相关参数 所有患者行腹部MRI平扫检查前空腹大于6 h,并进行呼吸和屏气训练以获得良好的配合。采用GE DISCOVERY MR750 3.0T扫描仪,采集的磁共振常规平扫序列包括:T1WI序列、T2WI序列、DWI序列,由DWI序列重建表观扩散系数(apparent diffusion coeffcient,ADC)图。MRI平扫序列参数:①T1WI:重复时间(time of repeatation,TR)为4 ms,回波时间(time of Echo,TE)为2 ms,层厚3.6 mm,视野(field of vision,FOV)为360 mm×360 mm;②T2WI:FOV为360 mm×360 mm,TE为77 ms,TR为2 400 ms,层厚8 mm;③DWI:FOV为360 mm×360 mm,TE为51 ms,TR为5 000 ms,b=0、1 000 s/mm2。
1.5 图像预处理及标注目标区域 从PACS系统以DICOM格式下载影像资料,T1WI选择T1序列的水相,单独保存水相,以T1水相为标准图像,应用3D Slicer软件(version 4.13.0)对T2WI序列、DWI序列进行配准,所有图像以NIFTI格式保存。本研究采用两种方法对肝脏ROI进行标注,第一种标注方法(肝脏特征1)在肝脏肿瘤层面周围选取5个圆形区域[大小为(10±0.5)mm],上下共选取6个层面(共30个),标注时避开大血管、胆管、病灶、肝脏边缘及伪影等。第二种标注方法(肝脏特征2)在沿门静脉右支右肝前叶选取局部信号均匀大小为(15±0.1)mm的圆形区域进行标注。脾脏ROI全脾脏标注。以上操作均在一位高年资MRI诊断医师指导下完成。
1.6 影像组学模型建立 利用Python中Pyradiomics包分别对T1WI、T2WI、ADC序列进行肝脏、脾脏特征提取,提取的特征包括一阶直方图统计特征、二阶纹理特征。
在特征筛选前,将基于T1WI、T2WI、ADC各序列提取的肝脏特征所筛选出的特征进行拼接(前融合),对原始影像组学特征数据进行正则化处理。在训练集中进行特征筛选,步骤如下:①第一步进行Spearman相关性分析,剔除冗余特征。②第二步使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)减少特征维度。得到相应的非零回归系数,通过系数加权求和计算影像组学评分(radiomics score,Rad-score)。分别构建基于两种肝脏标注方法所获得的Rad-score,并用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)评价模型性能。选择模型性能更优的肝脏特征与脾脏特征前融合再次进行如上步骤,获得肝脏-脾脏联合特征影像组学评分。
使用支持向量机(support vector machine,SVM)算法分别构建基于肝脏特征、肝脏-脾脏联合特征的影像组学模型,采用AUC、召回率、F1分数评价在训练组和测试组中机器学习预测模型的性能。
1.7 统计学处理方法 采用SPSS26.0软件统计学分析,正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,非正态分布的计量资料以M(P25,P75)表示,2组间比较采用秩和检验。计数资料以用频数和百分比表示,2组间比较采用χ2检验或Fisher确切概率法。采用二元Logistic回归建立肝脏-脾脏联合特征影像组学模型,用AUC评估模型性能,用Logistic回归筛选出临床影响因素构建临床预测模型,综合肝脏-脾脏联合影像组学特征对应的影像组学评分和临床影响因素构建联合预测模型。应用R软件(版本3.6.3,https∶//www.rproject.org/)决策曲线分析(decision curve analysis,DCA)评估临床预测模型和联合模型的临床受益,进行诊断性能的ROC曲线分析及列线图预测模型建立,AUC的多重和成对比较使用Delong非参数方法。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 110例患者按病理分级:F0级21例(19%)、F1级27例(24.5%)、F2级15例(13.6%)、F3级11例(10%)、F4级36例(32.7%)。无或非显著性肝纤维化组和显著性肝纤维化组患者间年龄、PLT、AST、APRI指数、FIB-4指数、性别、是否乙肝感染和FIB-4 指数组间差异有统计学意义(P<0.05)。见表1。
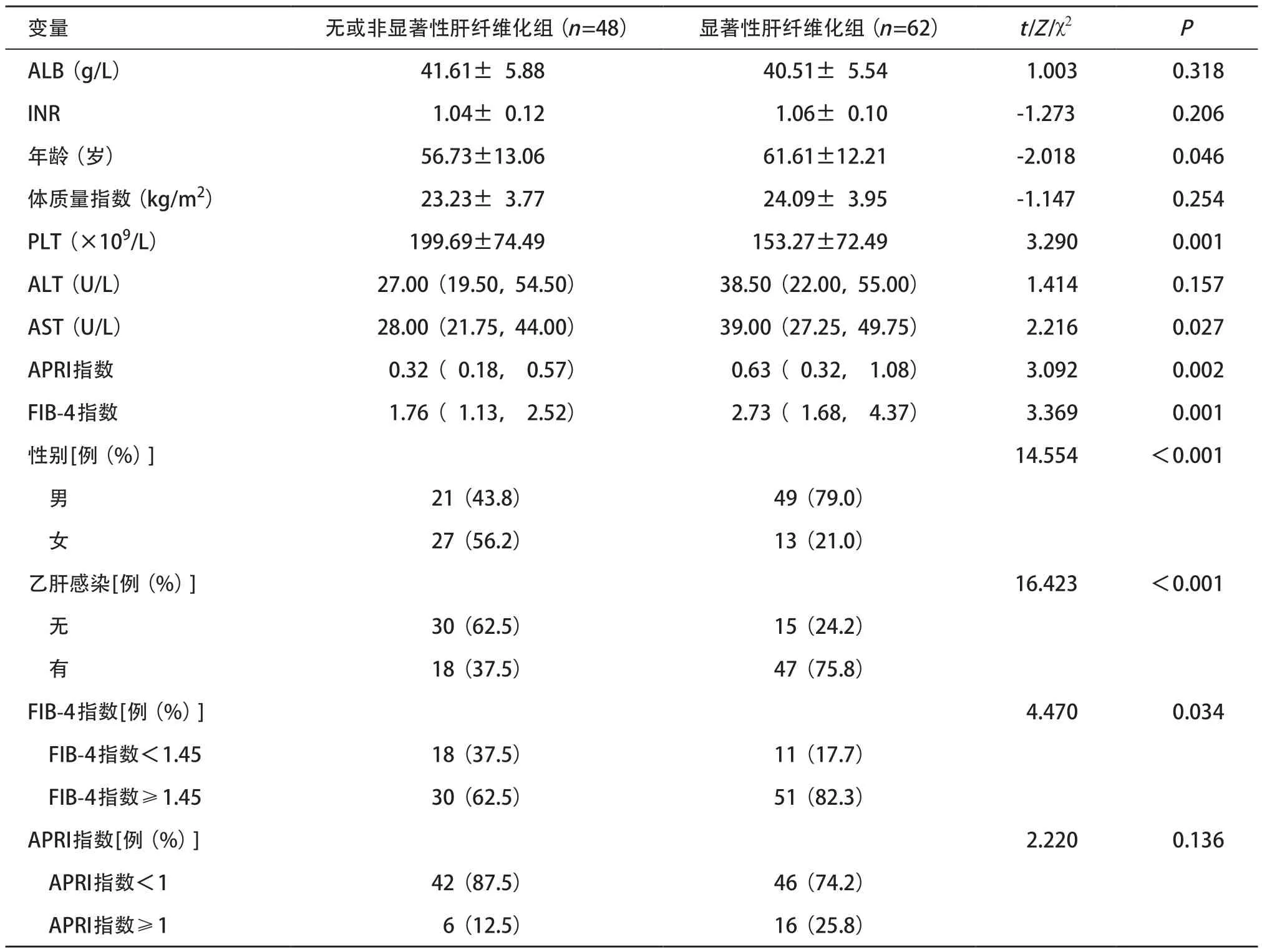
表1 研究人群临床、血清学指标分析结果
2.2 影像组学模型构建
2.2.1 基于肝脏特征的显著性肝纤维化影像组学模型构建:前融合T1WI、T2WI、ADC三个序列基于肝脏特征提取94 个影像组学特征。将肝纤维化病例按F0-1、F2-4(显著性肝纤维化)分组进行特征筛选,当λ值为0.029时剩余22个特征,包括6个形状特征、5个一阶特征、2个灰度共生矩阵(gray level co-occurrence matrix,GLCM)特征、2个灰度游程矩阵(gray level run-length matrix,GLRLM)特征、1 个灰度依赖矩阵(gray level dependence matrix,GLDM)特征、3个灰度区域大小矩阵(gray level size zone matrix,GLSZM)特征、3 个领域灰度差矩阵(neighboring gray tone difference matrix,NGTDM)特征,见图1A、图1B。剩余22个特征相关系数图、特征权重图见图1C。两种标注方法(肝脏特征1、肝脏特征2)在诊断显著性肝纤维化模型中AUC分别为0.828(95%CI=0.749~0.906)和0.663(95%CI=0.562~0.764),故本研究后续选用肝脏特征1进行分析。

图1 基于肝脏特征的显著性肝纤维化影像组学特征提取
2.2.2 基于肝脏-脾脏联合特征的显著性肝纤维化影像组学模型构建:前融合T1WI、T2WI、ADC三个序列基于肝脏、脾脏特征提取197个影像组学特征。进行特征筛选可得最佳λ值为0.014时剩余36个特征,包括8个形状特征、10个一阶特征、3个GLCM特征、2个GLRLM特征、9个GLSZM特征、4个NGTDM特征,见图2A、图2B。剩余36个特征权重图见图2C。

图2 基于肝脏-脾脏联合特征的显著性肝纤维化影像组学特征提取
2.3 机器学习影像组学模型效能评价 显著肝纤维化分组经SVM机器学习算法构建模型的相关评价指标见表2,在肝脏-脾脏联合特征SVM分类器中各组的准确率、AUC、召回率、F1分数均高于肝脏特征SVM分类器,说明增加脾脏特征可增加模型对正类样本识别的能力(召回率),也可提升模型的精确度(F1分数)。

表2 SVM机器学习算法构建影像组学模型的相关评价指标
2.4 Logistic影像组学模型效能评价 110例肝纤维化患者的Rad-score瀑布图见图3A,在两种特征所构建模型验证ROC曲线中(见图3B),肝脏特征影像组学、肝脏-脾脏联合特征影像组学模型AUC值分别为0.828、0.917,说明联合特征诊断性能较佳,以其作为模型,以是否为显著肝纤维化级别为结局变量(显著性肝纤维化为1,非显著性肝纤维化为0),算得Rad-score回归系数为7.218(P<0.001),表明Rad-score与显著性肝纤维化分级显著相关。

图3 Logistic影像组学Rad-score瀑布图及ROC曲线
2.5 影像组学评分结合临床影响因素构建联合预测模型 患者临床资料及血清学特征的单因素Logistic回归分析结果表明患者的性别、是否乙肝感染、PLT、FIB-4指数≥1.45与显著性肝纤维化分期关系密切,差异有统计学意义(P<0.05)。多因素Logistic回归分析结果显示患者的性别(女性)、年龄、乙肝感染、APRI指数是预测显著性肝纤维化的独立影响因素。见表3。将显著肝纤维化分组患者的临床独立影响因素建立的临床预测模型和本研究中得到的基于肝脏-脾脏联合特征得到的Rad-score建立预测显著性肝纤维化的联合预测模型。临床预测模型、影像组学预测模型、联合预测模型在训练组、测试组的AUC分别为:0.873、0.906、0.948和0.763、0.944和0.963,见图4A、图4B;DCA显示联合预测模型较单一临床预测模型获益大,见图4C。Delong检验结果提示临床预测模型与联合预测模型差异有统计学意义(P<0.05),即联合预测模型优于临床预测模型。联合预测模型列线图见图4D。

图4 三种预测模型的ROC曲线、DCA和联合模型列线图

表3 患者临床资料及血清学特征的多因素Logistic回归分析结果
3 讨论
根据欧洲肝病学会发布的《慢性肝病诊治指南(EASL2017版)》和中国中西医结合学会肝病专业委员会发布的《肝纤维化中西医结合诊疗指南(2019版)》中提到慢性肝病患者如经肝组织病理检查确定纤维化程度在F2以上(即显著性肝纤维化),应进行抗纤维化治疗[11-12]。近年来影像组学技术的发展使得医学影像所提取出的灰度、纹理等特征得以量化,为影像组学无创诊断肝纤维化提供了基础。
有研究通过构建大鼠肝纤维化模型发现当大鼠发生肝纤维化时,由于肝纤维化时细胞外胶原、蛋白多糖等大分子的积累,会限制水分子的扩散和血流,MRI上表现为T2WI、ADC图像信号减低[13]。SCHAWKAT等[14]发现T1WI序列纹理参数在区分是否为进展期肝纤维化(肝纤维化分期≥F3期)和磁共振弹性成像表现出相似的区分能力。也有相关研究表明ADC图的直方图特征和肝纤维化分期相关[15],融合多个序列的MRI往往能获得更多的影像组学特征。目前对肝纤维化程度无创评估多以肝脏特征为主,但对于脾脏特征的研究较少,随着肝纤维化程度的进展,脾脏血流动力学继发性改变,出现充血性脾肿大,有研究发现通过磁共振弹性成像(magnetic resonance elastography,MRE)测量脾脏硬度值可以评估肝纤维化分期[16-17]。YIN等[18]发现基于肝脏-脾脏联合特征拥有比单一肝脏特征的CT影像组学在诊断F4期肝硬化上拥有更好的诊断性能,故本研究进行对肝脏-脾脏联合特征提取的多模态MRI影像组学构建Rad-score,结合临床影响因素构建联合预测模型,对联合预测模型与临床预测模型进行效果评价。
关于肝脏ROI的标注目前暂无统一的标注指南,张谍等[19]总结目前影像组学肝脏ROI标注方法多选择肝门或门静脉右支水平的图像沿肝缘或肝右叶进行广泛标注,也可选择范围较小的、局部信号均匀的区域作为ROI标注区域。HOUSE等[20]研究提示全肝脏标注ROI或局部肝脏标注ROI所提取出的影像组学特征没有显著差异。由于肝纤维化是一个可逆、不均匀发展的过程[21],本研究在标注肝脏ROI上选取了两种方法,通过影像组学评分构建相应模型,结果表明标注方法1能取得更佳的诊断效能。后续可对不同标注方法对于诊断的影响进行进一步研究。
NI等[22]使用四氯化碳和橄榄油构建大鼠F0-F4肝纤维化模型并对其采集T1WI图像,结果显示SVM分类器模型是预测肝纤维化的最佳分类器。SCHAWKAT等[14]在对62例肝纤维化患者的前瞻性研究中发现,基于T1WI图像特征的SVM分类器对进展期肝纤维化(S0-2/S3-4)区分的准确性达85.7%,AUC达0.82(95%CI=0.59~0.95)。ZHAO等[23]基于肝脏特征T1WI-MRI图像的影像组学SVM分类器模型训练组和测试组AUC分别为0.87和0.82,训练组和测试组准确率分别为0.84和0.80,这与本研究结果相近。在本研究中,基于肝脏特征的多模态MRI影像组学SVM分类器模型训练组和测试组AUC分别为0.93和0.84,训练组和测试组准确率分别为0.88和0.81,表现出比单模态MRI更好的诊断性能;而基于肝脏-脾脏联合临床特征的多模态MRI影像组学SVM分类器模型训练组和测试组AUC分别为0.99和0.88,表现出比单一特征更好的诊断性能。在本研究中整合肝脏-脾脏联合特征多模态MRI影像组学评分和临床影响因素的联合预测模型,在DCA中,该联合模型比单一临床模型可能更多净获益,该联合预测模型列线图相较临床预测模型可使显著性肝纤维化患者的诊断更加个体化。
本研究存在的局限性:第一,本次研究样本量较小,且缺乏外部验证,很难避免选择性偏倚的存在;第二,本研究仅对于显著性肝纤维化分期建立了一种二分类模型,后续研究应进行多分类模型研究;第三,本研究纳入的肝纤维化患者大多数为慢性乙型肝炎患者,缺乏其他病因致肝纤维化患者,可能会影响模型对非乙肝患者所致肝纤维化的判断准确性。
综上所述,基于多模态MRI提取肝脏-脾脏联合特征的影像组学模型较单一肝脏特征相较于单一的临床预测模型具有更好的诊断效能,有望提高现有无创诊断显著性肝纤维化的诊断价值。

