源于白鹤球虫新种分子鉴定
王 艳,张志忠,徐前明
(1.合肥野生动物园 230031;2.安徽农业大学动物科技学院 230036 )
白鹤是濒危灭绝的动物之一,因其对环境适应能力较差,不能适应于人类经济活动导致的生存条件剧烈变化。因此, 野外白鹤数量正在急剧减少。根据国际鹤类研究中心发布的数据,60年代初期有几千只白鹤,而到了1978年全世界只剩下两百多只。国际生物学界认为白鹤濒临灭绝, 将白鹤收录在《红皮书》中作为警示。
球虫病﹑血液原虫病是导致白鹤大批死亡的主要疾病。我国禽类感染球虫较为常见,野生禽类也较为普遍,但白鹤发生该病较为少,白鹤球虫在国内外报道资料不为常见,累积资料较少,尚无详尽统计资料给予描述ITS基因在球虫虫种鉴定上的应用。本次对所分离的白鹤球虫进行鉴定,以便为白鹤球虫分类奠定基础。
1 材料与方法
1.1 病例来源
采集粪便样品来自合肥野生动物园救助野生白鹤。
1.2 细胞与载体
提供自安徽农业大学动物科技学院寄生虫实验室的大肠杆菌DH5α;从TaKaRa公司购买的pMD-19T载体。
1.3 主要仪器
PCR仪(Applied Biosystems公司);DYY-6C型电泳仪(北京市六一仪器厂);全自动凝胶成像分析仪(上海培清科技公司,型号JS680D);DHP恒温培养箱(上海实验仪器厂有限公司,型号XMT-A7000);冷冻高速离心机(赛默飞世尔科技)。
1.4 主要试剂
琼脂糖,SDS和Tris碱(均购自北京鼎国生物技术有限公司);Blood DNA kit(上海索莱宝生物科技有限公司);胶回收试剂盒(QIAGEN公司);营养琼脂培养基(购自上海瑞楚生物科技有限公司);普通肉汤(上海乔羽生物科技有限公司);实验室提供的鲜血营养琼脂平板。PCR扩增所用试剂:TaqDNA聚合酶﹑PCR缓冲液﹑MgCl2﹑dNTPs﹑DNA Maker DL2000﹑蛋白酶K均为TaKaRa公司产品。姬姆萨染料(购自Sigma公司)。
2 方法
2.1 PCR扩增目的基因
2.1.1 球虫卵囊分离与纯化
从合肥市野生动物园收集白鹤粪便,按照张龙乐等【2】报道的方法,采用饱和食盐水漂浮法进行球虫卵囊分离与纯化。
2.1.2 DNA提取
第一,将上述收集的1×105个球虫卵囊用玻璃珠打碎,加入300μL细胞裂解液和20μL蛋白酶K作用4h,再向每管再加入酚和氯仿各200μL,小心颠倒混匀几下。13000 rpm 离心13 min。转移上清至新管。
第二,加入600μL氯仿:异戊醇(24:1),震荡10s,14000rpm离心3min。
第三,取上清液至新管,再向该EP管中加入2倍体积即200μL的无水乙醇。
第四,在-20℃的冰箱中冷冻保存30min。13000rpm 离心13min。丢弃上清。
第五,加入500μL的75%乙醇注入EP管中,轻轻地转上几下,清洗下EP管,然后去掉液体。
第六,干燥箱内干燥20min。
第七,加入30μL的TE缓冲液,来回吹打几次即可,所提取的基因组用于PCR反应。
2.1.3 引物的设计
根据GenBank.U88565用Primer5.0设计一对引物,预计扩增的片段为539bp,引物由华大基因生物技术有限公司合成。
2.1.4 PCR扩增目的基因
取根据模板的编号进行相应编号的EP管按照下面的体系加样:

mix(Taq酶和dNTP) 12.5µl上下游引物 各1µl DNA模板 1µl dd水 9.5µl Total 25µl
PCR反应参数如下:预变性:94℃ 5min;变性:94℃45s;退火:56℃ 30s;复性:72℃ 30s;进行35个循环,完成后在72℃ 延长10min,于4℃下保存。
2.1.5 琼脂糖电泳检测PCR扩增产物
将PCR产物经琼脂糖凝胶电泳(100V,40min)后,全自动凝胶成像仪分析并拍照。
2.2 PCR产物的纯化
按照回收试剂盒回收PCR产物。
2.3 重组质粒PMD19-T- ITS-1的构建
2.3.1连接PCR产物与T载体
连接体系如下:

PMD-19T 1µl SolutionⅠDNA回收片段ddH2O5µl 3µl 1µl总体积 10µl
短暂离心后于4℃下保存过夜。
2.3.2 转化
方法步骤如下:
第一,10µL连接产物与100µL感受态细胞混匀后,冰上作用30min。第二,然后42℃作用90s。第三,加入1µLLB培养基,180r /min振荡培养1h。第四,12000 r/min离心20s,去掉800µL,剩余的用涂棒均匀涂布在Amp平板上,放置10min后,倒置恒温培养16h。
2.3.3阳性菌的克隆鉴定
用灭菌的枪头从平板上挑取4个单菌落,置入灭菌的LB培养基中培养(含50μg/ ml Amp)至饱和。然后采用菌落PCR方法对其鉴定。
2.3.4基因的测序与比对
将经PCR鉴定为阳性的克隆送至上海生物工程公司进行测序鉴定,测定的序列经NCBI中Blast工具进行序列比对,同时采用DNAstar软件对其抗原性进行分析。
3 结果与分析
3.1 卵囊分离结果

图1 白鹤球虫卵囊形态特征(400×)
将所得球虫进行孢子化试验(置入2.5%重铬酸钾溶液,28℃),发现该球虫最早孢子化时间约为23h。对其卵囊形态观察,其大小约为16-18μm×8-12μm,孢子化后4个孢子囊,每个孢子囊中含有2个子孢子。在外形上,一端窄,一端稍顿,无极孔和极冒等结构。初步判定属于艾美耳球虫属。
3.2 PCR扩增目的基因结果
用自行设计并由华大基因生物技术有限公司合成的一对引物,分别扩增该粪便基因组DNA,得到PCR产物,将产物用1%琼脂糖凝胶电泳后,参照2000 DNA Marker 标记,在500~750 bp间出现一条DNA特异性条带,与预期在539bp相符,没有非特异性条带出现,扩增成功,琼脂糖凝胶电泳图:

图2 PCR扩增结果
3.3 ITS-1基因序列测定结果
CGGcCAGTGcCAaGCTTGCATGCCTGCAGGTCGACGATTTTGGTCAGGAAGTTACTTAAATAGAGCCCTCTAAAGGATGCAAAACTCGTAACACGGTTTCCGTAGGTGAACCTGCGGAAGGATCATTCACACTTGTTCGAAATGATAATGGAATGGATCTTCCTTATCGATTTCGGATGATTTCCCACCGCATTGTATCAATCATTGAATCCGTGGCGTCTGCATGCATGGATTGGTGGCCGGCCCATCCGTGCATACCAATGGGATCATATGGATATTCACCCCACAAAGGTTTCTCTTTTTTATTTAAAGCTTAACTACTACTGCATATATACGGCGATTTGCGCAAAATGAGGAGCCGCATGCGGGTCGGCATGCAGCCCCGGGCAGTGGGGCATTGCACGGCGGCGAGGATGTGACCTTGTGTCACTTCGCTCCCCGGGCAAACATCGTTATGAAATCGCGATCTATATACCCACGGGTATTATGTTGTATGTTATTTTAAAAACTTTTTACAATGGATGTCTTGGCTCGTGCAT
所得基因经华大生物公司测序,所得序列长度为539bp,其中G+C含量为48.2%,A+T含量为51.8%。
3.4 序列同源性分析
将测序结果与GenBank中其他分离株基因序列进行了序列比对,结果发现,该分离株的基因与其他毒株的核苷酸同源性均在96%以上,由绘制的进化树分析可知,该分离株与艾美球虫属(A株)(登录号为MF356556.1)亲缘关系最近,与其他分离株的核苷酸同源性为77%~96%.
3.5 ITS-1基因遗传进化树分析
由图3可知,采用Mage软件分析,运用最大简约法计算白鹤球虫(Grane eimeria)ITS-1与所报道的E. gruis在遗传距离上最为接近,而与其他球虫不在同一分支上,且离隐孢子虫(Cryptosporidium parvum)遗传距离差距最大。
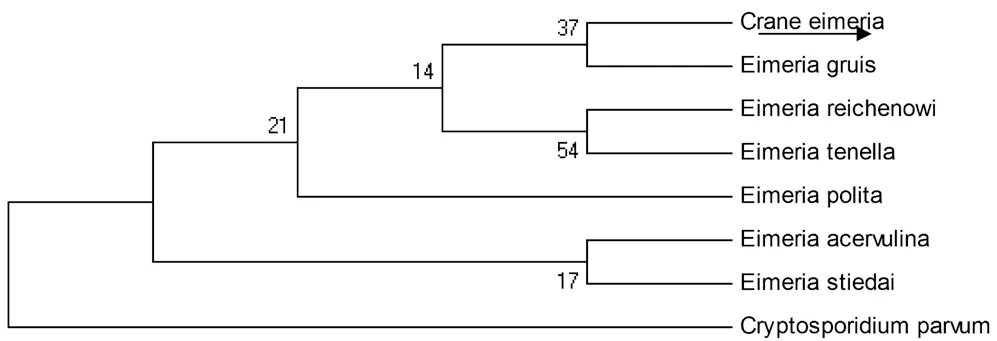
图3 所得基因遗传进化树分析结果
4 讨论
4.1 白鹤球虫种类鉴定
根据临床资料及实验室检验结果, 本园白鹤发生的疫病主要为球虫感染所致。根据形态学鉴定,采用孢子化时间测定,卵囊指数和卵囊大小,外形特征和内部结构。所测的指数与鸡球虫均不完全相同,与孔雀球虫也不一致。与万雪﹑刘冰许等报道丹顶鹤球虫种类也不一致,他们发现丹顶鹤球虫大小为卵囊大小约为18μm ×16μm,这种球虫宽度明显大于本次发现的球虫宽度,其外形是宽椭圆形,而本次发现白鹤球虫是长椭圆形[3,4]。采用分子生物学鉴定方法,根据ITS-1基因对其种类鉴定,这种方法以备广泛采用和实践,如辛玲等人采用该方法鉴定鸡球虫种类[5]。ITS-1基因在不同种球虫是存在差异性的,是作为种类鉴定的理想靶分子基因,不同物种ITS基因差异是较大的,这样可以较好地区别出不同种类球虫。本次扩增出ITS-1基因在同源性上,与已知柔嫩艾美耳球虫﹑火鸡球虫等差异性较大,同源性最高为96%(但只是扩增539bp中的部分序列),部分同源性更低,只有77%,初步说明本次白鹤球虫与已报道球虫ITS-1基因序列并不是同一序列,差异较大,可推测为它不同于其他球虫。在对作遗传进化树分析,发现其与所报道的Eimeria gruis在遗传距离上最为接近,而与其他球虫不在同一分支上,且离隐孢子虫(Cryptosporidium parvum)遗传距离差距最大。
4.2 球虫病的发生与环境卫生﹑饲养密度﹑气候﹑饲养管理﹑鹤鸟日龄大小等因素呈密切相关的。所以球虫病防治必须搞好场地环境卫生, 搞好舍内卫生制度, 做好消毒措施, 并保持笼舍干燥清洁, 保持饮水和食物的干净清洁。营养条件是控制球虫病另外重要手段,应供给鹤群充足营养的饲料, 补充足够维生素A和C,发病时减少饲料中的钙含量等,对于球虫病控制也是十分必要的。一旦发生球虫病,除了药物,应给予鱼肝油配合治疗,提高疗效。

