内质网应激在骨关节炎中作用的研究进展
金 涛,杨青山,吴树金,朱晓燕,史宇悰,牛建雄,刘 林*
1.甘肃中医药大学 第一临床医学院,甘肃 兰州 730000; 2.甘肃省人民医院 骨科,甘肃 兰州 730000;3.兰州大学 药学院,甘肃 兰州 730000
骨关节炎(osteoarthritis)是一种常见的以关节软骨进行性退变为主要特征慢性疾病。随着骨关节炎的发展,其不仅会影响关节软骨,还会影响软骨下骨、关节囊、滑膜及关节周围肌肉,对整个关节造成严重损害。根据预测到2030年时,骨关节炎的发病率将影响全球20%的成年人,并将很快成为导致残疾的最大原因[1]。但是由于对骨关节炎发病机制的不了解,限制了对其早期的发现以及靶向治疗,到晚期骨关节炎时患者将只能接受关节置换术的治疗。
在真核细胞中,内质网是一个动态细胞器,负责蛋白质的合成、转位、折叠和翻译后修饰,其有效的功能对细胞内稳态至关重要。在软骨细胞中,内质网负责细胞外基质分子的合成和周转。当细胞产生应激反应随后引起内质网功能的紊乱,这一状态被称为内质网应激(endoplasmic reticulum stress, ER stress)。一般来说, 软骨细胞凋亡是骨关节炎发生和发展的重要过程,而内质网应激在调控软骨细胞凋亡方面发挥了不可忽视的作用。因此本文将对内质网应激如何调控骨关节炎做一综述,并总结从内质网途径治疗骨关节炎的可能方法。
1 内质网应激在骨关节炎中发挥的作用
关节软骨主要由软骨细胞和细胞外基质组成,是一种无血管的组织,因此软骨细胞对潜在的缺氧以及营养物质的耗竭比较敏感。当发生骨关节炎时,关节软骨原有的压力和氧气梯度被改变,软骨细胞受到刺激后进到应激状态,内质网的稳态随之紊乱导致蛋白质在内质网中错误折叠并积聚,这一状态即内质网应激。为了限制内质网应激的有害影响并恢复蛋白质稳态,真核细胞具有一种进化上保守的适应性反应,即未折叠蛋白质应答(unfolded protein response,UPR)[2]。
内质网中的UPR主要由3种不同的信号蛋白质来介导,即肌醇需要蛋白1α(inositol-required enzyme 1 alpha, IRE1α)、蛋白激酶RNA样内质网激酶(protein kinase-RNA-like endoplasmic reticulum kinase,PERK)和激活转录因子6(activating transcrip-tion factor 6,ATF6)[3]。当未折叠或错误折叠的蛋白质在内质网管腔内积聚后,内质网应激随之启动,内质网传感器感知应激信号,并与分子伴侣解离。解离的分子伴侣与未折叠或错误折叠的蛋白质结合,以修饰产生的蛋白质并降低内质网应激的程度。UPR中常用的分子伴侣系统主要包括免疫球蛋白重链结合蛋白(binding-immunoglobulin protein,Bip)、钙网蛋白和蛋白质二硫键异构酶[4]。然而当内质网应激持续存在时,UPR将导致内质网功能障碍,从而激活相关的凋亡途径来介导细胞死亡(图1)。
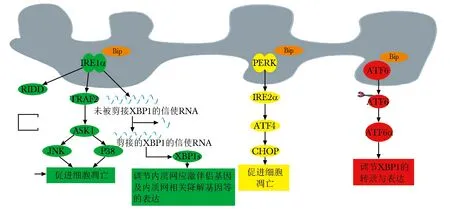
图1 未折叠蛋白质应答(UPR)的信号通路
1.1 IRE1调节相关通路致软骨细胞凋亡
IRE1是一种具有丝氨酸/苏氨酸激酶和核酸内切酶活性的双酶,其有两种亚型:IRE1α和IRE1β。当内质网应激发生后,分子伴侣Bip从IRE1α的管腔结构域中解离出来,促进其同源二聚和自磷酸化,并激活其激酶和核酸内切酶结构域。被激活的IRE1α以其底物X-box结合蛋白1(X-box binding protein1,XBP1)的信使RNA为标靶剪接出26个核苷酸,导致其翻译框架移动,从而产生转录因子XBP1s[5]。这种转录因子可以进入细胞核,调节如内质网应激伴侣基因及内质网相关降解基因等的表达[6],从而达到调节内质网应激的目的。在采用使内侧半月板脱位模型小鼠研究创伤诱导的骨关节炎中,小鼠手术后Bip的表达显著增加,清楚地表明内质网应激和UPR参与了骨关节炎的发病[7]。
IRE1α是一种具有腔内结构域和细胞质结构域的单一跨膜蛋白,它们在内质网膜的两侧执行不同的任务[8]。在内质网应激下,细胞将启动UPR以降低应激程度并减缓对细胞的损伤,IRE1α在此时表现出剪接XBP1的活性。但若内质网中蛋白质错误折叠速率超过了UPR所能承受的最大负荷,IRE1α在此时则表现为一种被称为调节的IRE1依赖衰变(regulated IRE1-dependent decay,RIDD)的活性。剪接XBP1可以促进细胞生存,而RIDD则促进细胞凋亡[9]。在内质网应激时,RIDD主要通过降解编码生存因子的信使RNA和针对促凋亡因子的microRNA来促进细胞凋亡。在骨关节炎中炎性因子的持续释放导致慢性内质网应激,从而使大量错误折叠的蛋白质在内质网腔内积聚,进而主要通过IRE1α信号通路触发软骨细胞凋亡[10]。
此外,激活的IRE1α可通过其细胞质结构域与肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2)相结合,随后再与凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)结合形成凋亡复合物。ASK1是一种丝氨酸/苏氨酸蛋白激酶,可以激活下游的c-Jun氨基端激酶(c-jun n-terminal kinase,JNK)和p38通路。在人骨关节炎关节软骨细胞中,活性JNK和活性p38的表达水平均高于正常软骨,表明该通路与关节软骨细胞死亡有关。活跃的JNK通过调节B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)家族成员来施加凋亡信号。这些Bcl2家族成员活性的改变会激活促凋亡因子,将凋亡信号从内质网传递到线粒体,并通过caspases执行细胞凋亡。在骨关节炎软骨细胞中,BCL-2交互调节蛋白(BCL-2 interacting mediator,BIM)被JNK信号激活,并在软骨退变过程中诱导软骨细胞凋亡[11]。同样,在骨关节炎患者的软骨组织和培养的人骨关节炎软骨细胞中,促凋亡的BCL-2相关X蛋白(Bcl-2-associated X protein,Bax)的表达水平增加,这证明IRE1α-TRAF2-ASK1通路在软骨细胞凋亡中发挥了不可忽视的作用。目前环状RNA在软骨细胞凋亡中的作用机制已成为研究热点,在白细胞介素-1β诱导的软骨细胞损伤模型中,环状RNA-0114876可诱导TRAF2表达增加,而抑制环状RNA-0114876可增强软骨细胞活性,减轻炎性反应,减少细胞凋亡[12],环状RNA可能通过IRE1α-TRAF2-ASK1信号通路来介导软骨细胞凋亡。
1.2 PERK调节相关通路致软骨细胞凋亡
PERK是一种定位于内质网的Ⅰ型跨膜蛋白,Bip与其管腔结构域的解离促进了其二聚化和自磷酸化。激活的PERK直接磷酸化真核细胞翻译起始因子2(eukaryotic initiation factor 2,EIF2)的α亚基,随后它可以抑制蛋白表达,并选择性地增强内质网驻留伴侣蛋白的表达以及翻译调节因子的表达[13]。骨关节炎软骨细胞中PERK的减少会导致Ⅱ型胶原的表达减少以及Ⅰ型胶原的表达增加,而Ⅱ型胶原的减少和Ⅰ型胶原的增加正是已知的会导致关节软骨功能减弱的重要原因[14]。
转录因子4(activating transcription factor 4,ATF4)是环磷酸腺苷反应元件结合蛋白家族的一个转录因子,作为PERK-EIF2α的下游因子,当EIF2α磷酸化时其被激活。总的来说,PERK介导的UPR有两个不同的作用:一是减轻内质网在应激条件下的蛋白质合成超负荷,二是通过增加ATF4的产生来保护细胞免受各种内源性和外源性应激的影响。除此之外,ATF4还可诱导C/EBP 同源蛋白(C/EBP homologous protein,CHOP)的转录,CHOP是一种亮氨酸拉链转录因子,UPR的3条通路均能诱导CHOP的转录,但PERK-EIF2α-ATF4这条通路在对CHOP的转录中发挥了主要作用。在骨关节炎小鼠模型中,缺乏CHOP基因的小鼠的关节软骨的退变和软骨细胞凋亡较正常小鼠轻[15],这表明CHOP介导的UPR加剧了骨关节炎。CHOP诱导细胞凋亡的机制之一是下调内质网膜上促生存蛋白BCL-2的表达,Bcl-2对细胞的保护作用是通过调节内质网及Ca2+水平来实现的,而这种活性则被JNK介导的磷酸化所抑制。CHOP还调节软骨细胞中白细胞介素-1β(IL-1β)的凋亡和分解代谢反应,导致一氧化氮和基质金属蛋白酶-13的上调,并抑制腺苷酸活化蛋白激酶的信号传导,从而加剧骨关节炎的发生。
哺乳动物雷帕霉素复合物1靶基因(mammalian target of rapamycin complex 1,MTORC1)是EIF2α-ATF4信号的下游因子,当内质网应激发生时,其被激活并导致活化蛋白激酶B的磷酸化被抑制,使IRE1α-JNK通路被选择性激活,进而导致细胞凋亡的发生[16]。在内质网应激的条件下,这种机制在骨关节炎颞下颌关节的软骨细胞中是活跃的。在骨关节炎的早期阶段,MTORC1在颞下颌关节软骨细胞中被抑制,但当骨关节炎发展到晚期细胞凋亡占优势时,MTORC1被激活[17]。因此,抑制MTORC1为骨关节炎的预防和治疗提供了一种潜在的治疗策略。
1.3 ATF6相关通路
ATF6是一种Ⅱ型跨膜蛋白,其在哺乳动物中广泛表达的有两种亚型,即ATF6α和ATF6β。当内质网应激发生时Bip从其腔结构域解离,ATF6α从内质网移位到高尔基体,并被Site-1蛋白酶(site-1 pepsin,S1P)和Site-2蛋白酶(site-2 pepsin,S2P)切割。随后其胞质部分片段被释放并运输到细胞核,并与内质网应激反应元件相结合来启动XBP1的转录表达,以响应内质网应激。然而,敲除Atf6的骨关节炎小鼠关节软骨正常,其骨关节炎发展的速度与未敲除Atf6的对照组的发展速度相同[7],这表明ATF6在维持内质网稳态方面可能只起到很小的作用。
2 从内质网途径治疗骨关节炎的总结
骨关节炎是一种多因素疾病,内质网应激诱导的软骨细胞凋亡是其中的一个促成因素。因此,靶向内质网应激本身或干预UPR信号可能是未来骨关节炎治疗的希望,以下将对这些潜在的靶点做一总结。
2.1 单一UPR通路的抑制剂
褪黑素是一种内质网应激抑制剂,可减弱内质网应激标志物的激活。最近的一项研究表明,褪黑素可显著减轻博莱霉素诱导的小鼠肺组织EIF2α及IRE1α的磷酸化并抑制IRE1途径的下游靶点JNK[18]。因此在软骨细胞中褪黑素也可能作为一种潜在的药物来减轻内质网应激从而达到治疗骨关节炎的目的。姜黄素是一种抗氧化和抗感染药物,可通过促进软骨细胞中沉默信息调节因子 2 相关酶类 1的表达来调节PERK-EIF2α-CHOP通路, 可以使CHOP减少以及软骨降解减慢,从而保护骨关节炎模型大鼠软骨[19]。
2.2 小分子化学伴侣
4-苯基丁酸(4-phenylbutyric acid,4-PBA)是一种小分子化学伴侣,其能有效地扩散到软骨外植体培养中,并以剂量依赖的方式减少软骨细胞中过度的内质网压力[20]。在大鼠交叉韧带横断致骨关节炎模型中,灌胃给予4-PBA的大鼠表现出组织损伤减轻,内质网应激标志物如Bip及CHOP等的下调,细胞凋亡减少[21]。另一种具有类似作用的化学伴侣是牛磺酸脱氧胆酸,用其处理的骨关节炎软骨细胞的内质网应激水平显著下降[22]。
2.3 内质网相关降解和自噬的激活剂
海藻糖是由两个葡萄糖分子组成的一个非还原性双糖,它被认为可以加速自噬通量,同时减少软骨细胞凋亡,从而减少骨关节炎软骨的退化。研究表明在小鼠骨关节炎模型中,在饮用水中添加海藻糖显著降低了小鼠的国际骨关节炎研究协会(Osteoarthritis Research Society International,OARSI)评分和滑膜炎严重程度评分。此外,海藻糖还能减少细胞凋亡,降低凋亡标志物蛋白的水平,如裂解的caspase-3、细胞色素C和CHOP[23]。
3 问题与展望
关节软骨主要由软骨细胞和细胞外基质组成,在内质网应激的压力下细胞外基质中的胶原蛋白是如何调节还需要进一步的阐明。此外,软骨细胞在内质网应激下UPR从促进生存的信号转为促进凋亡信号的具体临界值也尚不清楚。激活转录因子6β(activating transcription factor 6β,ATF6β)是ATF6在软骨细胞中的另一种表型,其生长板软骨细胞中能够控制软骨细胞的增殖和聚集聚糖酶的表达,而这两个过程可以也参与了骨关节炎的发病,未来的研究应进一步阐明其具体机制。因此,未来可通过体内外实验寻找更多调控内质网应激所引起的软骨细胞凋亡的蛋白及基因,并能够以此为靶点,在骨关节炎引起关节软骨的结构变化及功能障碍之前准确诊断和治疗骨关节炎。

