全杜仲胶囊对自发性高血压大鼠肠壁微血流灌注的影响
王 琴,张晓艳,刘雪婷,李炳蔚,李宏伟,杨义力,韩建群*
1.中国医学科学院 北京协和医学院 微循环研究所,北京 100005;2.国际遗传工程和生物技术中心中国区域研究中心(泰州),江苏 泰州 225300
高血压是心血管疾病进展的主要危险因素[1]。近年来的研究认为,高血压可导致肠道屏障功能受损[2],使小肠硬度增加,炎性反应升高。慢性炎性反应可导致肠道微循环系统结构和功能异常,包括内皮细胞功能障碍,糖萼降解,血液流变学和血管反应性改变,以及微血管结构的变化,如血管生成和血管重构。这些变化都可能影响微循环血流灌注,最终导致器官功能性毛细血管密度下降,并影响氧气的输送。微血管内皮细胞(microvascular endothelial cell, MVEC)在调节和维持微血管张力中发挥着重要作用,高血压时MVEC功能异常可能是微循环功能障碍的重要原因。激光多普勒血流仪(laser Doppler flowmetery, LDF)可以无创地评估组织微循环血流灌注[3]。LDF血流信号的频谱分析能够揭示血流在频率0.009 5~1.6 Hz间发生的振荡,进而反映调控微血流的不同生理机制。小波变换是一种可对LDF血流灌注信号进行时频分析的方法[4]。
杜仲(EucommiaulmoidesOliv.,EU)为中国特有的多年生落叶乔木,属于杜仲科杜仲属,广泛分布于中国的山西、甘肃、浙江、河南,湖北,四川,贵州和云南等地。在东亚地区,尤其是中国,韩国和日本,传统中药杜仲(CortexEucommiae)常指杜仲的干燥树皮,被用于治疗腰椎间盘突出、膝痛、骨质疏松、高血压等在内的多种疾病[5-6]。此外,杜仲黄酮类通过Nrf2信号通路降低氧化型谷胱甘肽(GSSG)浓度和GSSG/GSH的比值,降低了小肠氧化应激水平,进而改善了仔猪的肠道功能[7]。松脂醇二葡萄糖苷(pinoresinol diglucoside,PDG)是从杜仲树皮中分离出来的主要木脂素之一,具有抗炎、降压、预防骨质疏松等多种药理作用[8]。然而,到目前为止,尚未有研究从微循环角度报道阐述杜仲的降压作用。
本文旨在探讨全杜仲胶囊(Quanduzhong Jiaonang, QDZJN)和PDG对自发性高血压大鼠(spontane-ously hypertensive rats, SHRs)肠壁微循环激光多普勒血流信号的影响,同时利用小波变换分析与此相关的生理调控机制。
1 材料与方法
1.1 实验动物及试剂
1.1.1 实验动物:SPF级雄性的6只正常血压Wistar-Kyoto(WKY)大鼠和30只自发性高血压大鼠(spontaneously hypertensive rats, SHRs),7~8周龄,体质量175~195 g,由北京维通利华实验动物有限公司提供[动物检疫许可证号:SCXK(京)2016-0006]。所有大鼠均饲养于温度:21~25 ℃,湿度:45%~65%,12 h明暗交替的环境中。期间,均自由饮水和进食。
1.1.2 试剂:全杜仲胶囊(QDZJN)(国药准字Z20055116,产品批号200101),每粒含0.48 g棕褐色粉末状内容物(相当于原药材2.5 g),由江西普正药业集团股份有限公司生产。本品采用加热回流法结合煎煮法提取杜仲中包括松脂醇二葡萄糖苷和绿原酸在内的活性成分,其中,每粒含松脂醇二葡萄糖苷(PDG)(C32H42O16)≥1.25 mg。松脂醇二葡萄糖苷(PDG纯度>98%)购自成都瑞芬思生物科技有限公司。
1.2 实验方法
1.2.1 大鼠的分组及处理:将30只SHRs随机分为SHR,SHR+QDZJN,SHR+PDG (L),SHR+PDG (M)和SHR+PDG (H)组,每组6只。对照组(control/WKY)为6只WKY大鼠。其中,对照组和SHR组大鼠行纯净水灌胃。SHR+QDZJN,SHR+PDG (L),SHR+PDG (M)和SHR+PDG (H)组则进行相应药物灌胃。使用纯净水溶解QDZJN粉末,按照1.15 g/kg体质量,灌胃容量15 mL/kg体质量进行灌胃。PDG (L),PDG(M)和PDG(H)的给药剂量分别为8.75 mg/kg,17.5 mg/kg和35 mg/kg。每日灌胃一次,连续灌胃2个月。
1.2.2 大鼠尾动脉血压测量:使用智能无创鼠尾血压计(Softron BP-2010A,日本)对大鼠尾动脉收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP)进行测量并记录。
1.2.3 大鼠肠壁激光多普勒血流信号检测和血流成像分析:灌胃2天后检测。将麻醉后的大鼠取仰卧位固定于加热垫上,刮除腹部毛发,先后用碘酒和含75%酒精的棉球消毒腹部皮肤后,沿腹部中线剪开一个长度约3~4 cm切口,找到回盲部,轻拉一段小肠肠袢。使用高功率针式激光多普勒血流检测仪(laser Doppler flowmetry, LDF; Moor VMS,Moor Instruments公司),配套VP4探头,对肠壁血流灌注(blood perfusion)、血流速度(blood speed)及红细胞浓度红细胞浓度(RBC concentration)进行定量监测。使用激光多普勒血流成像系统(Doppler perfusion imaging,LDPI;moor LDI-HIR,Moor Instruments公司)进行肠壁的血流成像分析,使用mLDI Version 5.3软件对血流灌注水平进行分析。
1.2.4 小波变换(wavelet transform):对灌胃2个月后的大鼠进行检测。由于大鼠肠壁的激光多普勒信号是非线性的,且信号振荡的频率范围广。因此,对于低频率区需要高的频率分辨率,高频区需要良好的时间分辨率。在Morlet母小波的基础上进行连续小波变换,实现时域和频域的最优化。因此,小波变换可将激光多普勒血流信号转换为代表不同生理调控机制的5个特征性频段,其中,0.009 5~0.02、0.02~0.06、0.06~0.15 Hz、0.15~0.4 Hz和0.4~1.6 Hz分别代表了内皮源性、神经源性、肌源性、呼吸源性和心源性对微血流灌注的贡献。采用仪器自带的Moor VMS PC 3.1软件将经过小波变换后的LDF血流信号生成二维频谱图和三维时-频图。由于内皮细胞在调控微血管张力方面的重要作用,本研究比较了各组大鼠肠壁一氧化氮(nitric oxide, NO)依赖性和非依赖性的内皮源频段特征。
1.3 统计学分析
2 结果
2.1 全杜仲胶囊和PDG对SHRs血压的影响
各组大鼠尾动脉SBP和DBP在治疗前差异均无统计学意义。QDZJN或PDG治疗1个月后, SHR组的SBP和DBP均显著高于WKY组(P<0.001),QDZJN和高剂量(H)PDG治疗1个月均可显著降低SHRs的SBP和DBP(图1)。
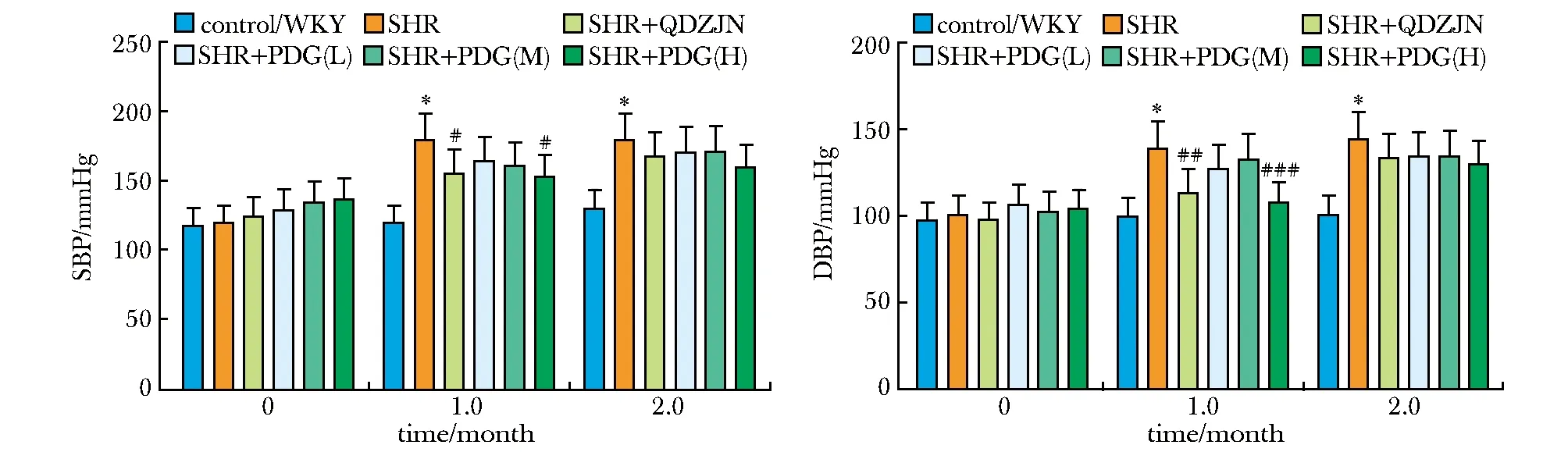
*P<0.001 compared with WKY group; #P<0.05, ##P<0.01, ###P<0.001 compared with SHR group; 1 mmHg=0.133 kPa
2.2 全杜仲胶囊和PDG对SHRs肠壁微血流灌注的影响
与WKY大鼠相比,SHRs的肠壁血流灌注水平显著降低(P<0.001),QDZJN和各剂量PDG治疗2个月后,SHRs大鼠肠壁血流灌注显著升高。此外,LDPI可以检测微循环中营养血管(毛细血管)和非营养血管(微动脉、微静脉和动-静脉吻合支)的血流灌注情况。与对照组相比,SHRs肠壁血流灌注显著降低(P<0.01),全杜仲胶囊和中、高剂量PDG治疗2个月后,SHRs肠壁血流灌注显著增加(图2)。

A.microcirculatory blood perfusion of intestinal walls detected by LDF;C.LDPI, B,D.their quantification analysis; *P<0.01, **P<0.001 compared with WKY group; #P<0.01, ##P<0.001 compared with SHR group
2.3 全杜仲胶囊和PDG对SHRs肠壁微循环血流速度和红细胞浓度的影响
与对照组相比,SHRs肠壁微血流速度显著加快(P<0.001),QDZJN和中、低剂量PDG治疗2个月后,SHRs肠壁微血流速度显著降低(均P<0.001),恢复至与对照组相当的水平。而高剂量PDG则进一步加快了SHRs肠壁微血流速度(P<0.001)(图3A,B)。与WKY大鼠相比,SHRs肠壁微血管红细胞浓度显著升高(P<0.001)(图3C,D), QDZJN和各剂量PDG治疗2个月后,SHRs肠壁微血管红细胞浓度则显著降低(均P<0.001),并且,QDZJN和中、高剂量PDG治疗2个月后红细胞浓度恢复至正常水平。
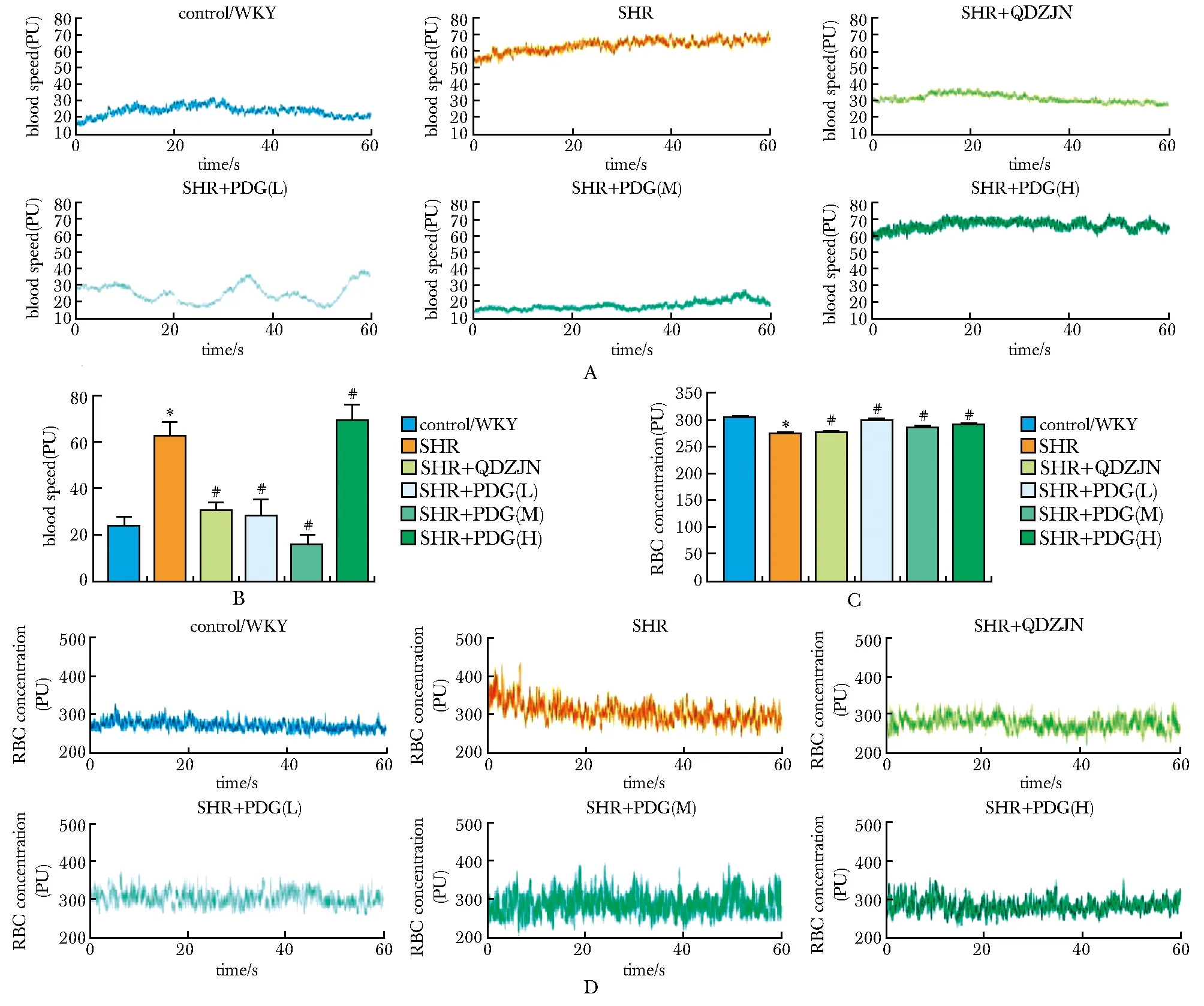
A,B.microcirculatory blood speed; C,D.blood cell concentration of intestinal walls detected by LDF their quantification analysis(B, D); *P<0.001 compared with WKY group; #P<0.001 compared with SHR group
2.4 全杜仲胶囊和PDG对SHRs肠壁微循环血流灌注内皮源频段幅值的影响
图4A和4B分别为各组大鼠肠壁LDF血流灌注信号经过小波变换后的二维频谱图和三维时-频图。SHRs肠壁LDF信号频谱图特征峰分布规律与WKY组明显不同。对内皮细胞源频段进行统计学分析发现,与WKY大鼠相比,SHRs肠壁的NO依赖性和非依赖性内皮细胞源频段幅值均显著降低。QDZJN和各剂量PDG治疗2个月后,SHRs肠壁的NO依赖性内皮细胞源频段幅值均显著升高(图4C)。同样地,QDZJN和各剂量PDG治疗2个月后,SHRs肠壁的NO非依赖性内皮细胞源频段幅值均显著回升(图4D)。同时,三维时-频图显示,SHRs肠壁内皮细胞源频段(箭头示)幅值低于对照组,QDZJN和各剂量PDG治疗2个月可显著改善SHRs肠壁内皮细胞源频段幅值(图4B)。

A.mean amplitude-frequency spectrum; B.3-D time-frequency spectrum; comparisons of NO-dependent (C) and NO-independent (D) endothelial components among 6 groups; *P<0.01 compared with control group; #P<0.05, ##P<0.01, ###P<0.001, ####P<0.0001 compared with SHR group
3 讨论
杜仲抗高血压的相关药理学机制包括抑制cAMP活性和Ca2+内流,调节NO和肾素-血管紧张素系统,舒张血管和增加冠状动脉血流[9]。本研究发现,全杜仲胶囊和35 mg/kg PDG治疗一个月可显著降低SHRs的血压,此结果与其他研究结果一致[10]。然而, 治疗两个月后, 二者的降压效果不显著。其原因可能与给药方式、全杜仲胶囊和PDG的使用剂量有关[11-12]。
高血压可使肠道屏障功能受损,继而导致慢性低水平炎性进展。慢性炎可导致肠道微循环系统结构和功能障碍。本研究结果表明,与血压正常的WKY大鼠相比,SHRs肠壁微血流灌注水平显著降低。QDZJN和各剂量PDG治疗2个月后,SHRs肠壁血流灌注水平显著升高。此外,SHRs肠壁微血流速度明显高于WKY大鼠,QDZJN和中、低剂量PDG治疗2个月后,微血流速度显著降低。局部组织血流量的调控是通过调节毛细血管管径(微血管容积)或阻力血管舒缩(血流速度)来实现[13]。高血压时,外周器官血流灌注降低,而真毛细血管血流代偿性增加,以改善外周器官的供血和供氧,因此,血流速度加快。同时,微血管收缩,微血管容积降低。微血管血流速度的加快和血管容积的降低共同导致SHRs肠壁血流灌注水平降低。高血压时,红细胞聚集和血浆黏度的改变是外周血管阻力增加的主要血液流变学因素。同样地,本研究发现,SHRs肠壁微血管红细胞浓度显著升高。QDZJN和各剂量PDG可显著降低肠壁的微血管红细胞浓度。内皮功能障碍是原发性高血压的主要特征之一[14]。本研究发现, SHRs肠壁内皮源性频段幅值显著低于WKY大鼠,QDZJN和PDG治疗可显著改善该频段幅值。
综上所述,SHRs肠壁存在微血流灌注异常和微血管内皮功能障碍,QDZJN和PDG治疗可显著改善SHRs肠壁的微血流灌注和微血管内皮功能。

