Nrf2敲除小鼠模型的构建与基因型鉴定
王闽蓉,张 峰,鲁利群
成都医学院第一附属医院 儿科, 四川 成都 610500
核因子红细胞2相关因子2(nuclear factor erythroid-2 related factor 2,NRF2)是参与细胞氧化还原稳态的主要转录因子,由基因核因子红细胞2样2(nuclear factor erythroid 2 like 2,Nfe2l2,Nrf2)编码[ 1]。其在调节细胞氧化损伤、炎性反应、免疫、细胞凋亡和致癌的作用机制中发挥重要作用[ 2]。NRF2缺失将增加各种呼吸系统疾病的易感性和损伤性,包括支气管肺发育不良、呼吸道感染、急性呼吸窘迫综合征、慢性阻塞性肺病、哮喘、特发性肺纤维化和肺癌等[3]。相反,NRF2的激活在保护细胞免受氧化损伤中起重要作用。因此,NRF2被认为是维持氧化还原平衡的关键调节因子,并参与下游抗氧化酶转录的启动[4]。本研究拟建立并鉴定Nrf2敲除小鼠模型,以期为进一步探讨NRF2在肺脏中的具体作用及机制提供新的实验工具。
1 材料与方法
1.1 材料
1.1.1 试剂:血液/细胞/组织基因组DNA提取试剂盒(TIANGEN公司);质扩试剂盒(TaKaRa公司);50 bp DNA Ladder Marker、TS-GelRed核酸染液、琼脂糖粉(北京擎科生物科技有限公司);BCA蛋白浓度测定试剂盒、50×TAE缓冲液(Solarbio公司);PVDF膜(Merck Millipore公司);山羊一抗NRF2 IgG、山羊二抗IgG(Proteintech公司)。
1.1.2 动物:一对雌雄基因型为Nrf2+/-杂合子C57BL/Nrf2基因敲除小鼠[赛业模式生物研究中心(太仓)有限公司,实验动物质量合格证SYXK(川)2020-196]。于成都医学院第一附属医院动物中心进行繁殖。饲养环境:温度20~26 ℃,湿度50%~70%,氨浓度不超过14 mg/m3,噪音小于60 dB,12 h/d光照明暗交替,饲料、饮水均符合卫生标准,垫料、鼠笼、水瓶均定期高压灭菌。最终获得4周龄F1代杂合子和纯合子各约4只,F2代5日龄纯合子和杂合子各约10只。
1.2 方法
1.2.1Nrf2敲除小鼠的繁殖流程:将引进的一对雌雄基因型为Nrf2+/-敲除小鼠进行交配,分别筛选出4周龄F1子代基因型为Nrf2-/-纯合子小鼠相互交配、基因型为Nrf2+/-杂合子小鼠相互交配、基因型为Nrf2+/-杂合子与Nrf2+/+野生型相互交配,最终得F2子代5日龄野生型(Nrf2+/+)、杂合子(Nrf2+/-)及纯合子(Nrf2-/-) 3种基因型小鼠。
1.2.2 小鼠尾数基因组DNA的提取:小鼠编码,剪取小鼠鼠尾1.0 cm,置于离心管中,存在-80 ℃超低温冰箱。分别参照TIANGEN公司组织DNA提取试剂/TaKaRa公司质扩试剂说明提取DNA,-20 ℃保存。
1.2.3 PCR及琼脂糖凝胶电泳进行基因型鉴定:1)实时定量PCR体系,反应体系总共10 μL:Mouse genomic DNA 0.5 μL、Forward primer(10 μmol/L) 0.3 μL、Reverse primer(10 μmol/L) 0.3 μL、Premix Taq Polymerase 5 μL、ddH2O 3.9 μL。PCR扩增仪循环设置:预变性,94 ℃ 3 min;变性,94 ℃ 3 s;退火,62 ℃ 35 s;循环35次;延伸,72 ℃ 35 s,最后再延伸5 min。2)引物设计:引物F1:5′-GAAGCATT ATCATTTGGTGGGAAC-3′,引物R1:5′-TGCACCA GAGTTCAAAGGTAGC-3′;引物R2: 5′-TGTCTGCC ATGAACCCTGTCTC-3′。小鼠尾部组织琼脂糖凝胶电泳基因片段分子质量:纯合子 451 bp、野生型513 bp,分析数据。
1.2.4 Western blot鉴定肺组织NRF2:各3只小鼠,取100 mg肺组织,放入匀浆器内,加入1 mL RIPA裂解液,置于冰上充分裂解2~3 h,4 ℃ 12 000×g离心15 min,留取蛋白上清液,按BCA蛋白定量试剂盒测定样本蛋白浓度。制备6%的SDS-PAGE凝胶,电泳2 h,250 mA电流转膜2.5 h,5%脱脂奶粉封闭45 min,4 ℃过夜孵育NRF2一抗,次日TBST洗膜3次/10 min,室温孵育二抗2 h,TBST洗3次/5 min。配制ECL发光工作液,在室温下避光均匀孵育膜2~3 min,凝胶成像系统采集图像,分析数据。
1.3 统计学分析
2 结果
2.1 Nrf2敲除小鼠繁殖情况
雌雄纯合子Nrf2-/-敲除小鼠能成功繁殖子代小鼠,但存在繁殖周期长,子代出生率和存活率相对较低等问题。雌雄杂合子Nrf2+/-可繁育出野生型(Nrf2+/+)、杂合子(Nrf2+/-)及纯合子(Nrf2-/-) 3种基因型小鼠。
2.2 小鼠基因型鉴定结果
2.2.1 饲养F1子代至4周龄,基因型鉴定结果(图1)。其中1、2、5、6、9、11、14号小鼠同时有451 bp和513 bp条带,即为杂合子(Nrf2+/-);3、8、10、12号出现一条451 bp左右条带,即为纯合子(Nrf2-/-);4、7、13号出现一条513 bp左右条带,即为野生型(Nrf2+/+)(图1)。

图1 F1子代4周龄Nrf2敲除小鼠鉴定
2.2.2 饲养F2子代至5日龄,基因型鉴定结果(图2)。其中1、4、5、8、10、20号小鼠同时有451 bp和513 bp条带,即为杂合子(Nrf2+/-);3、6、7、15、16、17、18、19、21号出现一条451 bp左右条带,即为纯合子(Nrf2-/-);2、9、11、12、13、14号出现一条513 bp左右条带,即为野生型(Nrf2+/+)(图2)。

图2 F2子代5日龄Nrf2敲除小鼠鉴定
2.3 基因敲除小鼠肺NRF2的蛋白水平
Nrf2基因敲除小鼠肺组织的NRF2蛋白表达显著低于野生型(P<0.05)(图3)。
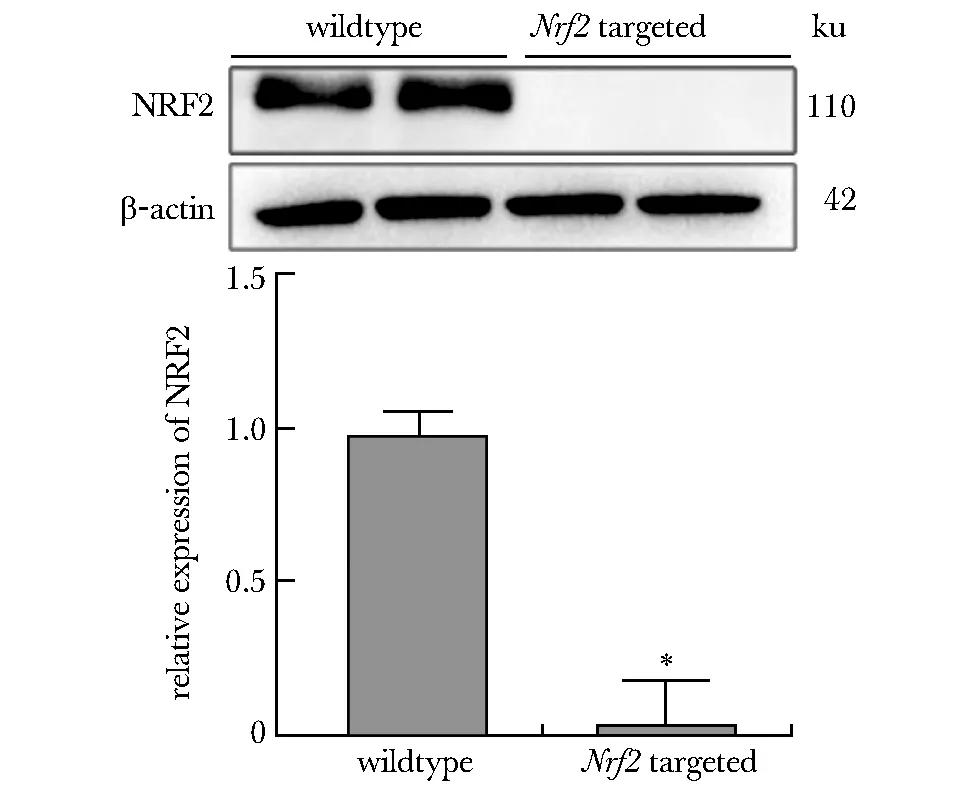
*P<0.05 compared with wildtype
3 讨论
NRF2属于碱性亮氨酸拉链转录因子CNC亚家族,是抗氧化反应元件(ARE-)驱动的细胞保护蛋白表达的主要调节因子[5], 在调节细胞氧化还原稳态的防御机制中发挥关键作用[6]。近年来越来越多研究报道,高氧刺激下体内活性氧(reactive oxygen species,ROS)生成增加后,NRF2被激活并驱动抗氧化基因表达,防止氧化损伤和抑制细胞焦亡[7-9]。在小鼠炎性肠病的模型研究中,发现刺激NRF2信号通路,能抑制ROS过量产生和NLRP3炎性体的激活,从而减轻肠上皮细胞发生焦亡,最终缓解肠道屏障功能障碍[8]。急性肺损伤模型小鼠中, 发现可通过调节ROS/NRF2/NLRP3通路,抑制巨噬细胞中炎性小体的激活及细胞焦亡,减轻肺损伤。另外,在已有的研究中,NRF2作为抗氧化因子在高氧肺损伤动物模型中减轻细胞焦亡发挥重要作用,但具体机制尚未完全阐明。因此,建立Nrf2敲除小鼠模型对于深入明确NRF2在肺部疾病中的作用并阐明相关机制具有重要意义。
本研究采用Western blot检测小鼠肺脏NRF2的表达,结果显示,与野生型新生小鼠相比,敲除Nrf2新生小鼠肺NRF2表达水平显著降低,说明特异性敲除肺Nrf2小鼠表型符合预期设想,使用PCR鉴定基因敲除小鼠成功。但鉴定过程中,由于鉴定两批次不同时间段的小鼠,实验发现F2(出生后第5天,由F1杂合子/野生型与F1杂合子所生)鉴定后常会出现若隐若现的干扰条带并对鉴定结果产生影响。排除技术原因造成的部分结果,分别使用过3种不同公司试剂盒,包括TaKaRa公司的质扩试剂盒、TIANGEN、擎科试剂盒等,但鉴定结果依然如此。目前考虑为5日龄幼鼠(高氧肺损伤模型建立所需)并非是最佳鉴定时间,体内尚残留母体的杂合子细胞,干扰了结果所致,但具体原因还有待进一步证实。
综上所述,本研究成功建立并鉴定Nrf2敲除模型小鼠,为深入阐明NRF2在肺部疾病中的作用及其机制提供了新的实验工具。

