老化石油污染土壤微生物群落多样性特征
管圣迪,苏颖轩,李梦莉,罗海梅,于 妍
(中国矿业大学(北京)化学与环境工程学院,北京 100083)
我国经济高速发展,能源需求迅速增长,能源供需矛盾日益突出,非常规能源越来越受到人们的重视[1]。但是页岩气开采造成土壤中石油含量增加,显著影响微生物群落,导致土壤微生物数量减少及生物多样性降低[2]。土壤微生物是土壤的重要组成部分,其种类较多,在土壤的形成发育、物质循环和肥力演变等过程中发挥关键作用。页岩气开采造成的土壤污染具有隐蔽性、滞后性、累积性、不可逆转性等特点[3]。因此,切实有效地解决石油污染土壤的修复问题,成为国内外研究的热点[4]。石油污染土壤的修复技术主要有物理修复、化学修复和生物修复[5]。其中,生物修复技术因具有成本低、几乎不产生二次污染和可进行原位修复等优点而受到广泛关注[6-8]。
延长油气田位于鄂尔多斯盆地,鄂尔多斯盆地延长组长 7 段烃源岩分布广泛,处于生油窗后期——生湿气窗的高峰期[9],油气共生,部分成熟度较高的区域产气强度较大,具备页岩气成藏的物质基础,因此,页岩气开采发展迅速。但在页岩气开采过程中产生的油基岩屑会污染土壤[10]。2015年,我国出台了禁止油基岩屑落地的政策,因此后期没有新增石油污染土壤,但是了解石油污染土壤的污染现状对于指导土壤生物修复具有重要意义。 基于此,作者采集延长某页岩气井田场地老化石油污染土壤,以周围未受石油污染土壤作为对照,利用 MiSeq 高通量测序技术分析土壤微生物群落多样性,采用冗余分析(RDA)探究微生物群落结构与土壤环境因子的关系,为探究土壤微生物对石油的耐性机制、开发土壤修复技术提供理论支撑。
1 实验
1.1 土壤样品采集
2020年10月在陕西省延长某页岩气井田场地按照棋盘布点法设置6个点位,每个点位采集50 cm×50 cm小样方的四角及中心0~20 cm深的土壤样品,混合得到该点位的土壤样品,依次编号为YC1~YC6;同时在井田场地外采集未污染土壤样品作为对照,编号为YC。所有土壤样品剔除草根和石块后储存于采样袋内,置于装有冰袋的恒温箱中,立即带回实验室4 ℃保存,用于微生物高通量测序的土壤样品于-80 ℃下保存。
1.2 土壤样品的理化性质分析
将采集的土壤样品自然风干,研磨过筛,采用火焰原子吸收分光光度法测定总铬,采用石墨炉原子吸收分光光度法测定铅,采用碳酸氢钠浸提-钼锑抗分光光度法测定有效磷,采用重铬酸钾氧化-分光光度法测定有机碳,采用凯氏定氮法测定总氮,采用电位法测定pH值,采用重量法测定含水率和含盐量,采用气相色谱法测定石油烃。采用SPSS 22软件对土壤样品的各项理化指标的变化量进行相关性分析。
1.3 微生物DNA的提取及高通量测序
对土壤样品进行预处理,用DNA提取试剂盒(E.Z.N.ATMMag-Bind Soil DNA Kit,Omega)提取DNA。对样本进行质检,样本浓度在6.04~24.60 ng·μL-1之间。采用16S rRNA通用引物341F(5′-CCTACGGGNGGCWGCAG-3′)、805R(5′-GACTACHVGGGTATCTAATCC-3′)对V3-V4区目的基因进行PCR扩增,在第二轮扩增中引入Illumina桥式PCR兼容引物。最后,在MiSeq平台对16S rRNA的V3-V4高变区进行高通量测序。
1.4 测序数据分析
对MiSeq测序所得原始数据进行拼接,区分样本后对序列质量进行质控和过滤,然后对所得操作单元(operational taxonomic unit,OTU)进行聚类分析和物种分类学分析。基于OTU聚类分析结果,对OTU进行多种多样性指数分析,计算alpha多样性指数(Chao1指数、Shannon指数、Simpson指数等),以表征微生物群落多样性,鉴别采样点的石油降解优势菌属。利用R语言绘制OTU聚类韦恩图、聚类堆积柱状图,并对优势菌门、菌属的丰度与理化性质进行冗余分析。
2 结果与讨论
2.1 土壤样品的理化性质(表1)
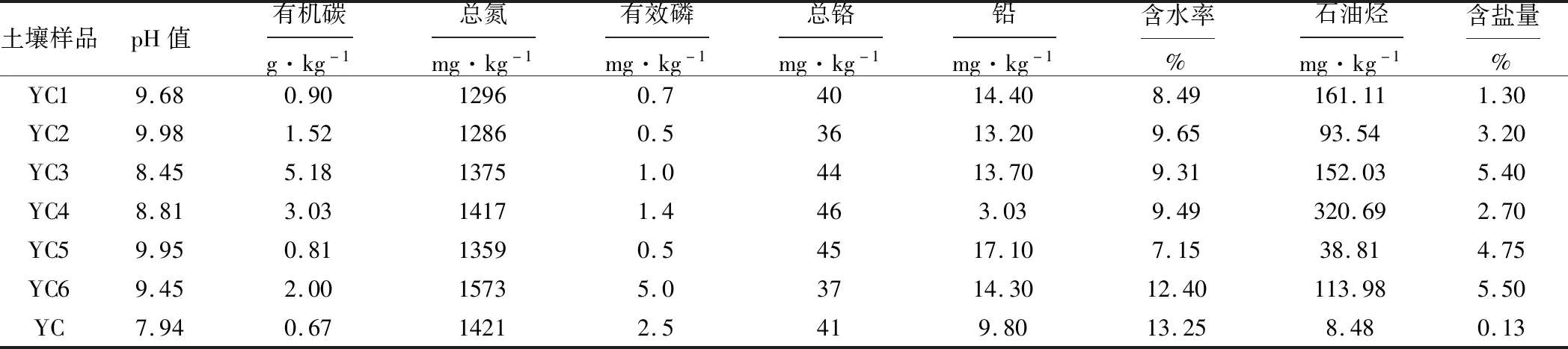
表1 土壤样品的理化性质Tab.1 Physicochemical properties of soil samples
采样点地处西北,干旱少雨,盐碱积累,土壤的pH值和含盐量高。由表1可知,污染土壤样品的pH值范围在8.45~9.98之间,均高于未污染土壤样品;污染土壤样品的有机碳含量在0.81~5.18 g·kg-1之间,均高于未污染土壤样品;未污染土壤样品的含盐量较低,远远低于污染土壤样品,但含水率远远高于污染土壤样品,主要是因为石油具有疏水性,石油污染土壤的疏水性也随之升高,导致土壤储水能力下降,含水率除低[11];污染土壤样品的铅含量在3.03~17.10 mg·kg-1之间;污染土壤样品的石油烃含量在38.81~320.69 mg·kg-1之间,均高于未污染土壤样品,其中YC4样品的石油烃含量最高,是未污染土壤样品的40倍左右。石油烃含量较高的土壤样品(YC1、YC3、YC4、YC6)的碳氮比失衡,均高于100/10,主要是由于陕北地区黄绵土氮含量低,碳含量高,导致碳氮比较高[12]。
将污染土壤样品与未污染土壤样品的理化性质进行Person相关性分析,结果见表2。
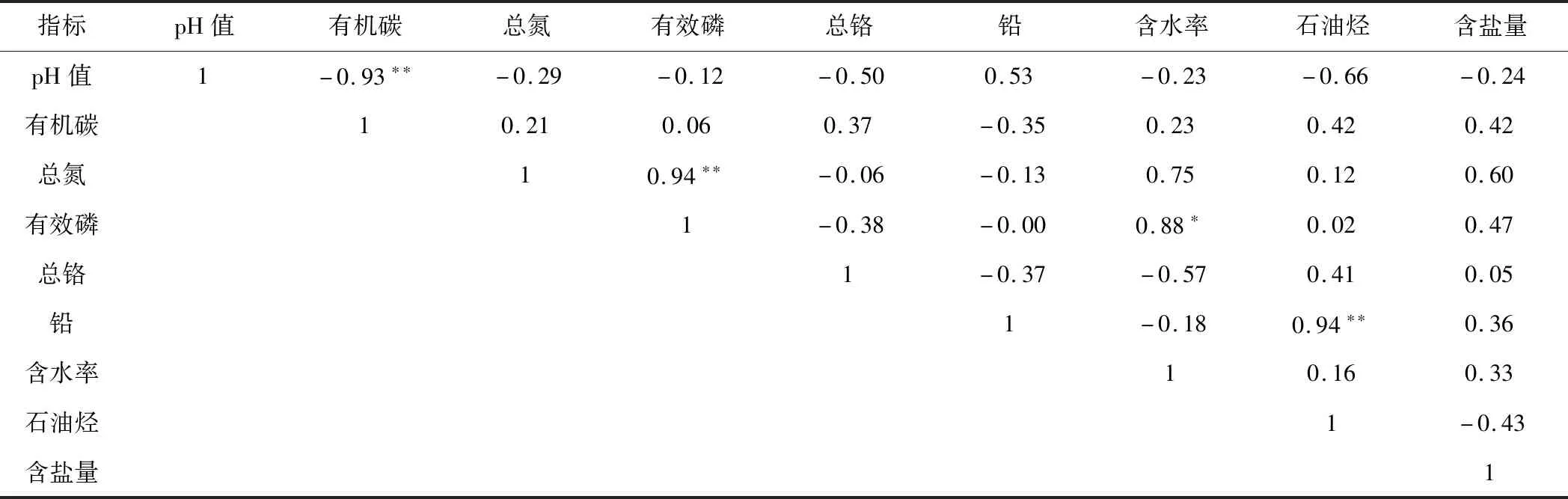
表2 土壤理化性质的Person相关性分析Tab.2 Person correlation analysis of physiochemical properties of soil
由表2可知,pH值与有机碳含量呈极显著负相关性,总氮含量与有效磷含量、铅含量与石油烃含量均呈极显著正相关性,有效磷含量与含水率呈显著正相关性,其它指标间的相关性不显著。
2.2 微生物群落多样性分析
2.2.1 OTU聚类分析(图1)
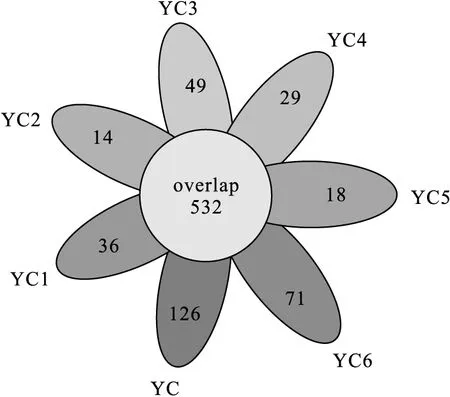
图1 OTU聚类韦恩图Fig.1 Clustering Venn diagram of OTU
由图1可知,7个土壤样品共同含有532个 OTU。OTU数量顺序为:YC>YC6>YC3>YC1>YC4>YC5≈YC2,其中YC样品含有的OTU数量最多,YC5和YC2样品含有的OTU数量最少,说明石油污染土壤中微生物数量减少,主要是受石油污染物的胁迫和环境因素的影响[13]。
2.2.2 多样性指数分析
在97%相似度水平下,计算alpha多样性指数,结果见表3。
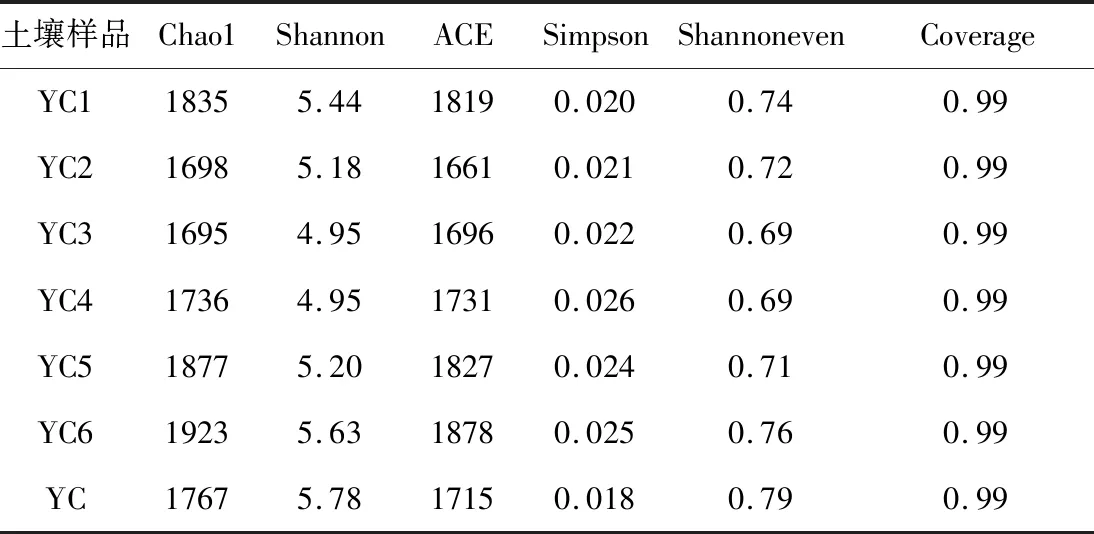
表3 alpha多样性指数Tab.3 alpha Diversity index
Chao1指数和 Shannon指数反映了微生物群落的丰富度和多样性,数值越大说明群落丰富度和多样性越高; Simpson 指数反映了微生物群落的均匀性,数值越小,说明群落分布越均匀。由表3可知,YC和YC6样品的Chao1指数和Shannon指数较大,说明微生物群落丰富度和多样性较高;YC样品的Simpson 指数最小,说明未污染土壤样品的微生物群落均匀性高于污染土壤样品。对比发现,石油烃的摄入降低了土壤微生物丰富度,石油烃含量越高,多样性越低,群落分布越不均匀。
2.2.3 石油降解微生物优势菌落分析
门水平物种相对丰度如图 2 所示。
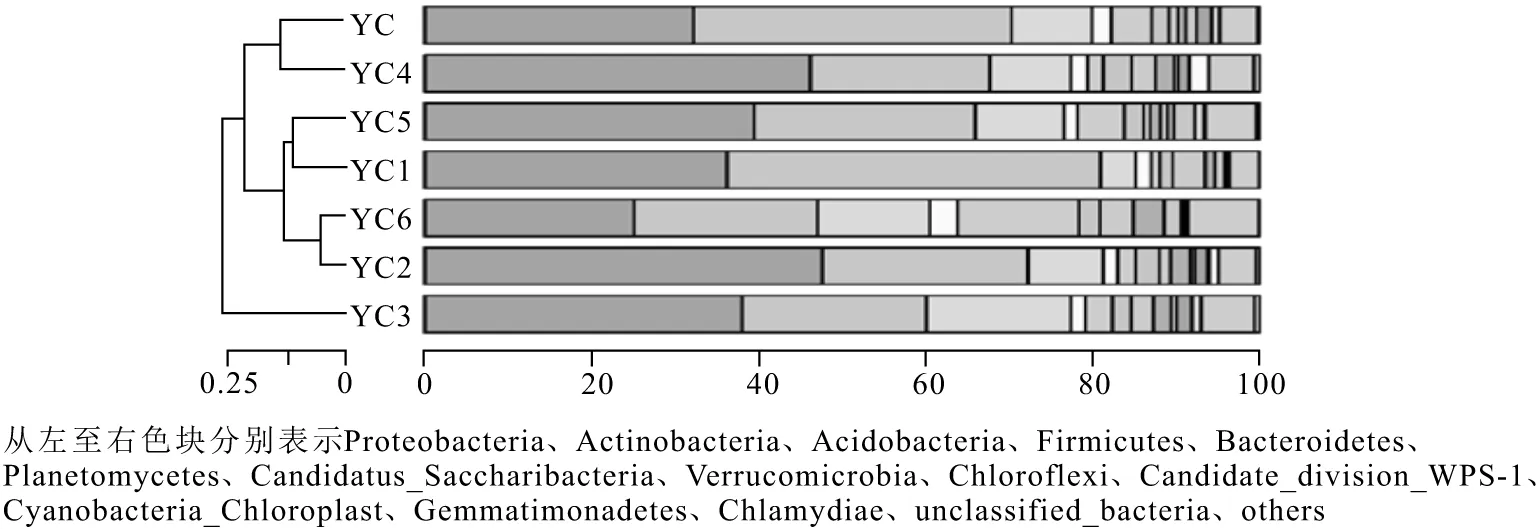
图2 门水平物种相对丰度聚类堆积柱状图Fig.2 Clustering accumulation histogram of relative abundance of major microbial species at phylum level
由图2可知,变形菌门(Proteobacteria)的相对丰度最高,为优势菌门,广泛存在于石油污染土壤中,说明其对老化石油污染土壤环境具有较强的适应性;放线菌门(Actinobacteria)在7个样品中同样表现出了丰度优势;此外,酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)在7个样品中均有一定丰度。污染土壤样品中, YC3样品与其它样品在门水平上有较大的差异,其余样品微生物组成略有差异,YC2与YC6样品在门水平上一致。相较于YC样品,由于石油烃类污染物的摄入,变形菌门、绿弯菌门(Chloroflexi)的相对丰度明显上升,其中石油烃含量较高的YC4样品中变形菌门微生物的增加尤为明显,而放线菌门的相对丰度有所降低。表明在石油污染土壤的老化过程中,变形菌门微生物增多,而放线菌门微生物减少。
当土壤被石油烃污染时,相对丰度显著升高或新出现的细菌可以被视为石油烃降解菌(嗜油性细菌),而相对丰度显著降低的细菌可以被视为疏油性细菌[14]。因此推断延长地区嗜油性菌门为变形菌门和绿弯菌门,这与辽河石油污染土壤微生物群落结构多样性的研究[15]及陕北石油污染土壤微生物多样性的研究[16]结果一致。
将相对丰度前15的物种进行属水平分析,结果如图 3 所示。

图3 属水平物种相对丰度聚类堆积柱状图Fig.3 Clustering accumulation histogram of relative abundance of major microbial species at genus level
由图3可知,未污染土壤样品与污染土壤样品中优势菌群组间差异较大。不同采样点属水平上群落结构有差异,其中YC2与YC6样品在属水平上相似性最高。根据各样品理化性质,可以看出属水平相似性较高的样品,其pH值、有机碳含量相似性最高。污染土壤样品中主要菌属有鞘氨醇单胞菌属(Sphingomonas)、分枝杆菌属(Mycobacterium)、Saccharibacteria_genera_incertae_sedis、芽孢杆菌属(Bacillus)、节杆菌属(Arthrobacter)、交替红色杆菌属(Altererythrobacter)、诺卡氏菌属(Nocardioides)。
对属水平占比较高的优势菌群进行功能性分析,结果见表4。
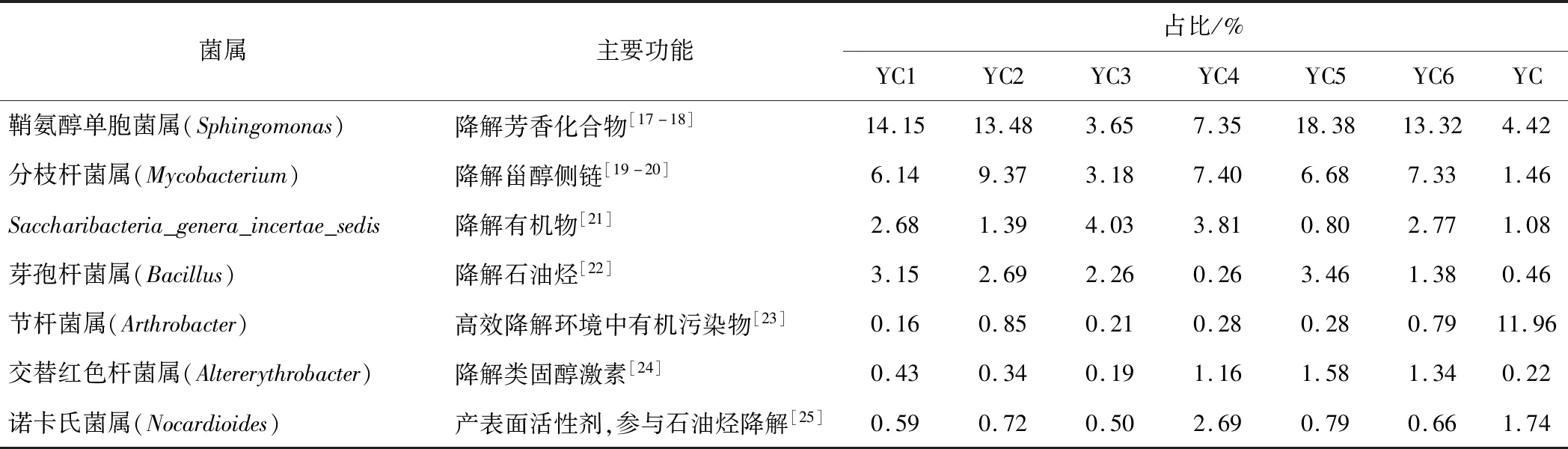
表4 占比较高的优势菌群的功能性分析Tab.4 Functional analysis of dominant bacteria with relatively high proportion
石油烃降解菌能将碳氢化合物转化为能源、生物质及生物废料副产品[26]。石油污染土壤样品中,共有7个属具有石油烃类污染物降解功能,其中诺卡氏菌属和芽孢杆菌属可产表面活性剂,降低石油烃类污染物表面张力,实现其乳化和增溶;鞘氨醇单胞菌属含有一组独特的芳香化合物降解基因,可通过调节细胞表面疏水性来适应石油污染环境。
假单胞菌属(Pseudomonas)、红球菌属(Rhodococcus)、微杆菌属(Microbacterium)、芽孢杆菌属、产碱杆菌属等是常见的石油烃降解菌[22]。王耀民[27]从大港油田长期被原油污染的土壤中分离、筛选出4 株能以原油为唯一碳源的菌株,其中2株原油降解率高的菌株分别为不动杆菌属和芽孢杆菌属。
2.2.4 微生物群落结构与土壤环境因子的关系
微生物群落结构是土壤微生态环境的响应,要结合理化指标进行分析。对7个土壤样品微生物门和属水平与理化性质进行冗余分析,结果如图4所示。
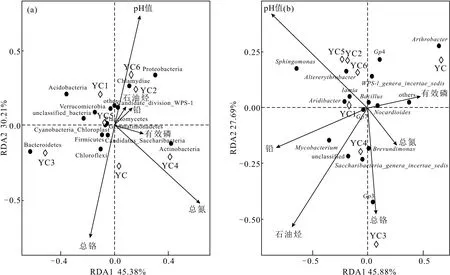
图4 微生物门水平(a)、属水平(b)冗余分析Fig.4 Redundancy analysis of microorganism at phylum level(a) and genus level(b)
由图4a可知,第一主轴和第二主轴分别解释了总方差变量的45.38%和30.21%,第一主轴上总氮含量是主要的影响因子,第二主轴上pH值和总铬含量是主要的影响因子。其中pH值、总氮含量、总铬含量是微生物门水平的主要影响因子,石油烃含量也对微生物门水平有影响,尤其是与变形菌门具有显著的正相关性。土壤中微生物数量最多的变形菌门受pH值的影响较大。铅含量与石油烃含量存在显著的相关性,说明石油污染会导致土壤中重金属含量升高,进而加重土壤污染,与Person相关性分析(表2)结果一致。受石油烃的影响,微生物菌门在结构上会发生变化, 其中YC2与YC6样品的菌门结构相似性高,其微生物菌门主要受石油烃含量、铅含量、pH值的影响;YC4样品主要受总氮含量的影响;YC1与YC5样品的菌门结构相似性较高,与门水平聚类堆积柱状图(图2)结果一致。
由图4b可知,第一主轴和第二主轴分别解释了总方差变量的45.88%和27.69%。第一主轴上pH值、铅含量、石油烃含量是主要的影响因子,第二主轴上石油烃含量和总铬含量是主要的影响因子,因此,与微生物群落结构相关性较高的土壤理化指标是石油烃含量、pH值和重金属含量。Saccharibacteria_genera_incertae_sedis、分枝杆菌属与石油烃含量存在显著正相关性,推测其对石油烃具有良好的降解潜能;分枝杆菌属与铅含量具有显著正相关性,其对铅具有良好的降解性能;鞘氨醇单胞菌属与pH值具有显著正相关性,与石油烃含量具有正相关性,与荆佳维等[13]的研究结果一致。Gp3、短波单胞杆菌属(Brevundimonas)与总铬含量存在显著正相关性,推测其对总铬有降解能力。YC1、YC2、YC5、YC6样品的菌属相似性较高,YC3、YC4样品与其它样品不同,未污染土壤与污染土壤样品的菌属差异性大。
3 结论
利用 MiSeq 高通量测序技术分析了延长某页岩气井田场地老化石油污染土壤的微生物群落多样性,采用冗余分析探究了微生物群落结构与土壤环境因子的关系,结论如下:
(1)石油污染土壤偏碱性,土壤污染不均匀,石油烃含量差异较大,由于石油烃污染造成碳氮比失衡,氮含量不足。
(2)石油污染土壤微生物的优势菌门为变形菌门和放线菌门;鞘氨醇单胞菌属、分枝杆菌属、Saccharibacteria_genera_incertae_sedis、芽孢杆菌属、节杆菌属、交替红色杆菌属和诺卡氏菌属等 7 种菌属具有石油烃类污染物降解功能,分枝杆菌属和短波单胞杆菌属具有重金属降解功能。
(3)石油污染土壤微生物的多样性和均匀度均有所下降,石油污染会导致鞘氨醇单胞菌属、分枝杆菌属、芽孢杆菌属等菌属的相对丰度有所上升。
(4)石油污染土壤微生物群落多样性主要受pH值、石油烃含量和重金属含量的影响,铅含量与石油烃含量存在显著正相关性,说明石油烃的摄入会导致土壤中重金属含量上升、营养失衡,进而加重土壤污染。

