姜黄素通过p38 MAPK/NLRP3抑制肠道病毒71型诱导的细胞焦亡
张晓延, 张鑫艳, 杜建平
(1)山西医科大学汾阳学院医学检验系, 山西 汾阳 032200;2)大同同煤集团总医院检验科, 山西 大同 037003)
肠道病毒71型(EnterovirusA71,EV-A71)属于小RNA病毒科肠道病毒属,是一种无包膜的单股正链RNA病毒,其基因组共编码4种结构蛋白质(VP1、VP2、VP3和VP4)和7种非结构蛋白质(2A、2B、2C、3A、3B、3C和3D)[1]。EV-A71感染是造成小儿重症手足口病(hand-foot-mouth disease,HFMD)的主要原因。而且,严重的EV-A71感染可能造成包括脑炎、无菌性脑膜炎和神经源性肺水肿等神经系统炎性并发症[2]。
细胞焦亡(pyroptosis)是一种新的不同于细胞凋亡的细胞程序性死亡方式(programmed cell death,PCD),主要形态学特征是细胞不断胀大使膜失去完整性,释放细胞内容物及乳酸脱氢酶(lactate dehydrogenase,LDH)等[3]。细胞焦亡是一种炎性的细胞程序性死亡,分为胱天蛋白酶1(caspase-1)依赖和非胱天蛋白酶1依赖,由属于NLR或HIN-200受体家族的一群胞质感应器所启动,gasdermin蛋白家族参与执行效应。病毒或者细菌感染等刺激可激活由胞内固有免疫受体(NLRP3)、接头蛋白ASC和胱天蛋白酶1组成的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎症小体,诱导焦亡发生,伴随gasdermin蛋白家族(gasdermin E,GSDME)或(gasdermin D,GSDMD)等的切割、白细胞介素IL-1β及IL-18的成熟释放,引发炎症反应[3]。我们认为,病毒诱导的细胞焦亡是EV-A71感染患儿的机体产生过激的炎症反应和严重并发症的主要原因之一。目前,尚无特异性的抗EV-A71药物用于临床治疗,故而本文拟从抑制病毒诱导的细胞焦亡的角度,寻找一种抗病毒感染的活性物质。
p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase ,p38MAPK)是MAPK家族的成员,各种环境应激和LPS等炎症刺激均可将其激活,是介导炎症反应的重要信号通路。我们之前的研究[4]发现,EV-A71诱导的细胞自噬能上调p38MAPK/ERK信号通路,从而促进炎症细胞因子IL-6的产生,自噬抑制剂3-MA和氯喹能抑制病毒引起的这一变化。可见,p38MAPK参与了EV-A71感染所致的炎症反应。近来的研究发现,p38MAPK可调控NLRP3/caspase 1介导的细胞焦亡[5],提示p38MAPK可参与焦亡的调控。
姜黄素(curcumin)是从姜黄等姜科姜黄属中药根茎中提取的一种黄色酚类色素[6],其具有抗炎[7]、抗氧化[8]和免疫调节[9, 10]等作用,且不良反应小,在传统的亚洲医学中被广泛用于多种疾病的预防和治疗。有研究发现,姜黄素可抑制阿霉素诱导的心肌细胞焦亡[11],但未见姜黄素对EV-A71诱导的细胞焦亡的作用研究。本文推测,姜黄素的广泛保护作用与其对细胞焦亡的调控有关。课题组前期已证实,EV-A71可以诱导细胞焦亡[12]的实验基础上,本课题旨在明确姜黄素对EV-A71诱导的细胞病变及细胞焦亡的调控作用,从而为临床抗EV-A71感染的治疗提供参考。
1 材料与方法
1.1 细胞
人正常胃上皮GES-1细胞和人横纹肌肉瘤细胞RD细胞,由课题组冻存。培养条件:含5%双抗及10%胎牛血清的DMEM培养基和MEM培养基,37℃,5% CO2培养箱。RD细胞用于CCID50的检测,GES-1细胞用于病毒感染实验。
1.2 病毒

1.3 试剂
DMEM培养基、MEM培养基、BCA蛋白定量试剂盒、超敏ECL化学发光试剂盒、HRP标记的山羊抗兔IgG、β-肌动蛋白(β-actin):博士德生物科技有限公司;PI染色试剂盒:江苏南京凯基生物公司;膜再生液:北京索莱宝科技有限公司;胎牛血清(fetal bovine serum, FBS)、LDH检测试剂盒、DAPI试剂:上海碧云天生物公司;GSDMD抗体(G7422)、SQSTM/p62抗体(P0067):Sigma-Aldrich公司;Cleaved Gasdermin D 抗体(#36425)、胱天蛋白酶1抗体(#3866)、p38MAPK抗体(#8690)、P-p38MAPK抗体(#4511)、LC3抗体(#12741):CST公司;NLRP3抗体(WL02635)、Pro-IL-1β抗体(WL02257):万类生物科技有限公司;VP1抗体(GTX132339):Gene Tex公司。
1.4 仪器
生物安全柜(力康公司),低温超速离心机(德国Eppendorf公司),二氧化碳恒温培养箱(Thermo Fisher公司),倒置荧光显微镜(日本Nikon公司),微型离心机(Microone公司),倒置光学显微镜(Olympus),SDS-PAGE电泳仪(Bio-Rad公司),半干式转膜仪(Bio-Rad公司),酶标仪(Biotek公司),电泳仪(Bio-Rad公司),电泳槽(Bio-Rad公司),蛋白质转膜仪(Bio-Rad公司),化学发光成像系统(Bio-Rad公司),普通PCR仪(Bio-Rad公司)。
1.5 病毒扩增与感染
EV-A71感染RD细胞48h,收集细胞离心,4℃,4 000 r/min,10min,收取上清液,分装,测定EV-A71的MOI值,将病毒冻存于-80℃保存。病毒感染通过用已知MOI值的EV-A71感染GES-1细胞一定时间后收取细胞上清和细胞,以不含病毒的培养液为对照mock组。
1.6 Western印迹分析
收集EV-A71干预的细胞,离心后弃去上清液,收集细胞沉淀。加入60 μL通用蛋白质裂解液冰浴30 min,BCA法测定蛋白质浓度;样品通过12%SDS-PAGE分离,并转移到硝酸纤维素膜(NC)膜;用5%脱脂奶粉TBS溶液室温封闭1 h,再分别孵育目的蛋白质的抗体4℃过夜;次日洗膜3次,用辣根过氧化物酶(HRP)标记的二抗在室温下孵育1 h,洗膜3次;最后使用化学发光法显影,蛋白质条带用ImageJ来进行灰度分析和相对定量。
1.7 Dil染色检测
将处于对数生长期的细胞接种至24孔板,每孔细胞12×104个,于37℃,5% CO2培养。待细胞生长密度达80%左右,更换新的培养基,使用MOI为5的EV-A71病毒染毒细胞24 h,再用PBS洗3次,每次5 min;用4%多聚甲醛4℃预冷固定细胞20min;吸出甲醛,用PBS洗3次,每次10 min;加入5 μmol/L Dil,室温孵育5 min;用PBS洗3次,每次10 min,在荧光显微镜下观察并拍照。
1.8 DAPI核染色
细胞处理同1.7,固定后用已稀释好的DAPI染液染色10 min,PBS洗3次。
1.9 ELISA检测
收集EV-A71干预的细胞培养液,离心后收取细胞上清。按照IL-1β细胞因子检测试剂盒说明书进行操作。
1.10 Real-time PCR (qPCR)
用Triol试剂提取细胞RNA,反转录为cDNA,程序为42℃ 60 min,80℃ 10 min。在IL-1β、GAPDH引物、cDNA模板和SYBR荧光染料等条件下进行扩增和定量。程序为95℃ 2 min,95℃ 15 s,60℃30 s,共30个循环。溶解曲线温度设置为95℃ 15 s,60℃ 15 s,95℃ 15 s。IL-1β引物序列上游序列为5′-ACAGATGAAGTGCTCCTTCCA-3′,下游序列为5′-GTCGGAGATTCGTAGCTGGAT-3′;GAPDH引物序列上游引物5′-ACAACTTTGGCATTGTGGAA-3′,下游引物5′-GATGCAGGGATGATGTTCTG-3′。
1.11 乳酸脱氢酶的测定
选取处于对数生长期的细胞接种于96孔板,每孔细胞1×104个,在37℃,5% CO2培养18h。将细胞分为:无细胞的培养液组(背景空白对照孔),不染毒的对照细胞组(对照孔),不染毒的用于后续裂解的细胞组(最大酶活性对照孔),以及染毒组(实验孔),每组做3个复孔。在EV-A71干预前1 h用PBS液洗涤1次,换低血清新鲜培养液。在病毒干预24h后,离心收取上清于另一新的1.5 mL的EP管中。每孔取120 μL上清加入新的96孔板,再加入提前配制60 μL的LDH检测工作液,室温摇30min,用酶标仪在490 nm处测A值。LDH的释放=(实验组A值-对照组A值)/(细胞最大酶活性的A值-对照组样品A值)×100%。
1.12 细胞培养半数感染量的测定
参照卫生部《手足口病预防控制指南(2009版)》[13]附件1《手足口病标本采集及检测技术方案》测定病毒的细胞培养半数感染量(cell culture infective dose 50%,CCID50)。10倍系列稀释病毒液,以96孔板每列8孔为一组,每组加入不同稀释度的病毒原液每孔50 μL,每个稀释度加8孔,其中一列加不含病毒的培养液为对照,每孔加50 μL细胞浓度为2×105/mL对数生长期的RD细胞悬液。36℃培养7 d,观察细胞病变;按Behrens-Kärber公式计算出分离病毒株的CCID50;log CCID50= L-d×(S-0.5),其中:L = 实验中使用的最低稀释度的log值;d = 稀释梯度的log值;S = 终判时阳性部分的总和(即出现细胞病变效应的细胞孔所占的比例之和)。CCID50与PFU换算: PFUs=0.7×CCID50。
1.13 感染复数的计算
感染复数(multiplicity of infection,MOI)是指感染时病毒数量与细胞数量的比值。空斑形成单位(plaque forming unit,PFU)是病毒能引起细胞空斑的单位,一般表示为pfu/mL。计算公式为:MOI=病毒PFU(pfu/mL)×病毒液体积(mL)/细胞数。
1.14 统计学方法
2 结果
2.1 肠道病毒-A71感染引起细胞毒性
为了观察EV-A71对细胞的毒性,用MOI为0.5、1、2、4、5的EV-A71处理GES-1细胞24h,以及用MOI等于5的病毒处理细胞不同时间来观察细胞增殖活力、细胞形态及细胞LDH的释放情况。CCK8检测结果显示:随着MOI和感染时间的增加,病毒对细胞增殖活力的抑制作用越来越明显(Fig.1A、1B)。以MOI为5的EV-A71感染细胞24 h,用Dil进行细胞膜染色和DAPI进行核染色,荧光显微镜下观察发现,细胞数量明显减少,且细胞形态明显改变(Fig.1C)。LDH检测结果显示:随着MOI和感染时间的增加,LDH释放增加,提示病毒对细胞的损伤作用越来越明显(Fig.1D,E)。

Fig.1 Cytotoxic effects of EV-A71 Cells were infected with EV-A71 at MOI ratios of 0.5, 1, 2, 4, 5 for 24 hours, or at MOI ratios of 5 for 3, 6, 9, 12, 24 hours, respectively. (A, B) Inhibitory rate of cell viability was detected using a CCK-8 method. (C) The membrane was visualized with Dil staining and the cell nucleus was visualized with DAPI staining. Scale bar is 25 μm. (D, E) EV-A71 induced LDH release was detected using LDH Release Assay Kit. Data represent means ± SD (n=3)
2.2 肠道病毒-A71感染增加了炎性细胞因子IL-1β的产生
用MOI分别为0、1、3、5的EV-A71感染细胞24h。随着病毒感染量的增加,Western 印迹检测发现,细胞内IL-1β的前体pro-IL-1β逐渐减少(Fig.2A,2B),ELISA检测发现,细胞培养上清中的IL-1β释放增加(Fig.2C),RT-qPCR检测发现,细胞内的IL-1β的mRNA上调(Fig.2D),均具有剂量依赖性。因此,EV-A71感染后,不仅引起细胞IL-1β的表达上调,且增加了IL-1β的活化释放。

Fig.2 EV-A71 infection increased the production and secretion of IL-1β Cells were infected with EV-A71 at MOI of 1, 3, 5 for 24 hours.(A) Western blot analysis was performed to detect pro-IL-1β in the cell. (B) Quantitative analysis of IL-1β protein expression. The protein amount of each band was quantified by the integrated density (Image J). (C) IL-1β secretion was assessed by ELISA. (D) The mRNA level of IL-1β was measured using RT-qPCR. Data represent means ± SD (n=3).*P<0.05,**P<0.01 vs the mock group
2.3 姜黄素可以抑制肠道病毒-A71感染引起的细胞毒性
用浓度分别为10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L、60 μmol/L姜黄素干预细胞24 h,用CCK-8检测细胞增殖活力发现,浓度低于及等于40μmol/L的姜黄素对细胞活力未见影响(Fig.3A)。用浓度分别为10 μmol/L、20 μmol/L、30 μmol/L、40μmol/L的姜黄素干预细胞24 h,检测细胞上清LDH的释放,显示40 μmol/L及以下浓度的姜黄素对细胞均无明显毒性(Fig.3B)。用MOI为5的病毒感染细胞24 h为染毒组,用40μmol/L姜黄素干预染毒细胞为干预组,以mock组为对照,通过CCK-8检测发现,病毒感染可降低细胞的增殖活力(P<0.01),而姜黄素可以减少病毒对细胞增殖活力的抑制作用(P<0.01)(Fig.3C),同样的分组处理,发现病毒可以引起细胞培养液中LDH释放增加(P<0.01),而姜黄素可以抑制这一毒性作用(P<0.01)(Fig.3D)。Dil染色发现,姜黄素可以抑制EV-A71引起的细胞数量的减少,以及细胞膜和细胞核形态改变(Fig.3E)。

Fig.3 Curcumin inhibited the EV-A71-induced cytotoxicity Cells were treated with different concentration of curcumin for 24 hours (A, B), or treated with a virus-free supernatant, EV-A71, curcumin, and a combination of EV-A71 and curcumin for 24 hours (C, D), respectively. (A, C) Cell viability was detected using a CCK-8 method. (B, D) EV-A71 induced LDH release was detected using LDH Cytotoxicity Assay Kit. (E) The membrane was visualized with Dil staining, scale bar is 25 μm. Data represent means ± SD (n=3).*P<0.05,**P<0.01 vs the mock group,#P<0.05,##P<0.01 vs the EV-A71 infected group
2.4 姜黄素可以抑制肠道病毒-A71感染诱导的IL-1β产生
用MOI为5的EV-A71感染细胞24h,同时用浓度分别为10 μmol/L、20 μmol/L、40 μmol/L的姜黄素干预细胞。随着姜黄素浓度的增加,Western印迹检测发现,EV-A71引起细胞内IL-1β的前体pro-IL-1β的减少逐渐被姜黄素逆转(P<0.05),(Fig.4A,4B),ELISA检测发现,细胞培养上清中的IL-1β释放逐渐减少(P<0.05)(Fig.4C),RT-qPCR检测发现,细胞内的IL-1β的mRNA水平逐渐下调(P<0.05)(Fig.4D),均具有剂量依赖性。由此可见,姜黄素可以抑制EV-A71感染引起的细胞内IL-1β的表达上调及活化释放。

Fig.4 Curcumin suppressed EV-A71-induced IL-1β production Cells were treated with EV-A71 (MOI=5), and a combination of EV-A71 and curcumin (10, 20, 40 μmol/L) for 24 hours, respectively. (A) Western blot analysis was performed to detect the expression of pro-IL-1β in the cell. (B) The protein amount of each band was quantified by the integrated density (Image J). (C) IL-1β secretion was assessed by ELISA. (D) The mRNA level of IL-1β was measured using RT-qPCR. Data represent means ± SD (n=3).#P<0.05,##P<0.01 vs the EV-A71 infected group
2.5 姜黄素降低染毒细胞中NLRP3的水平并抑制肠道病毒-A71感染诱导的细胞焦亡
用MOI分别为0、1、3、5的EV-A71感染细胞24h,随着病毒感染量的增加,Western 印迹检测发现,细胞内NLRP3的水平,胱天蛋白酶1、焦亡相关蛋白GSDMD的活化逐渐增加,呈剂量依赖(P<0.01)(Fig.5A,B),提示EV-A71感染诱导细胞焦亡的发生,且EV-A71诱导的细胞焦亡是由NLRP3参与,胱天蛋白酶1依赖的,且焦亡特异性蛋白质GSDMD介导的。结合结果2.3和2.4,均证明焦亡在EV-A71感染后发生。用MOI为5的EV-A71感染细胞24h,同时用浓度分别为10μmol/L、20μmol/L、40μmol/L的姜黄素干预细胞,随着姜黄素浓度的增加,Western 印迹检测发现,姜黄素可以抑制EV-A71引起细胞内焦亡相关蛋白质NLRP3(P<0.01)、胱天蛋白酶1(P<0.01)、GSDMD(P<0.01)、Cleaved-GSDMD(P<0.01)的变化,呈剂量依赖性(Fig.5C,D)。结合结果2.3中姜黄素可以抑制EV-A71感染引起的细胞膜的损伤与LDH的释放,结果2.4中姜黄素可以抑制IL-1β前体的减少,及成熟体的产生,均证明姜黄素可以通过抑制NLRP3而有效地抑制EV-A71诱导的细胞焦亡。
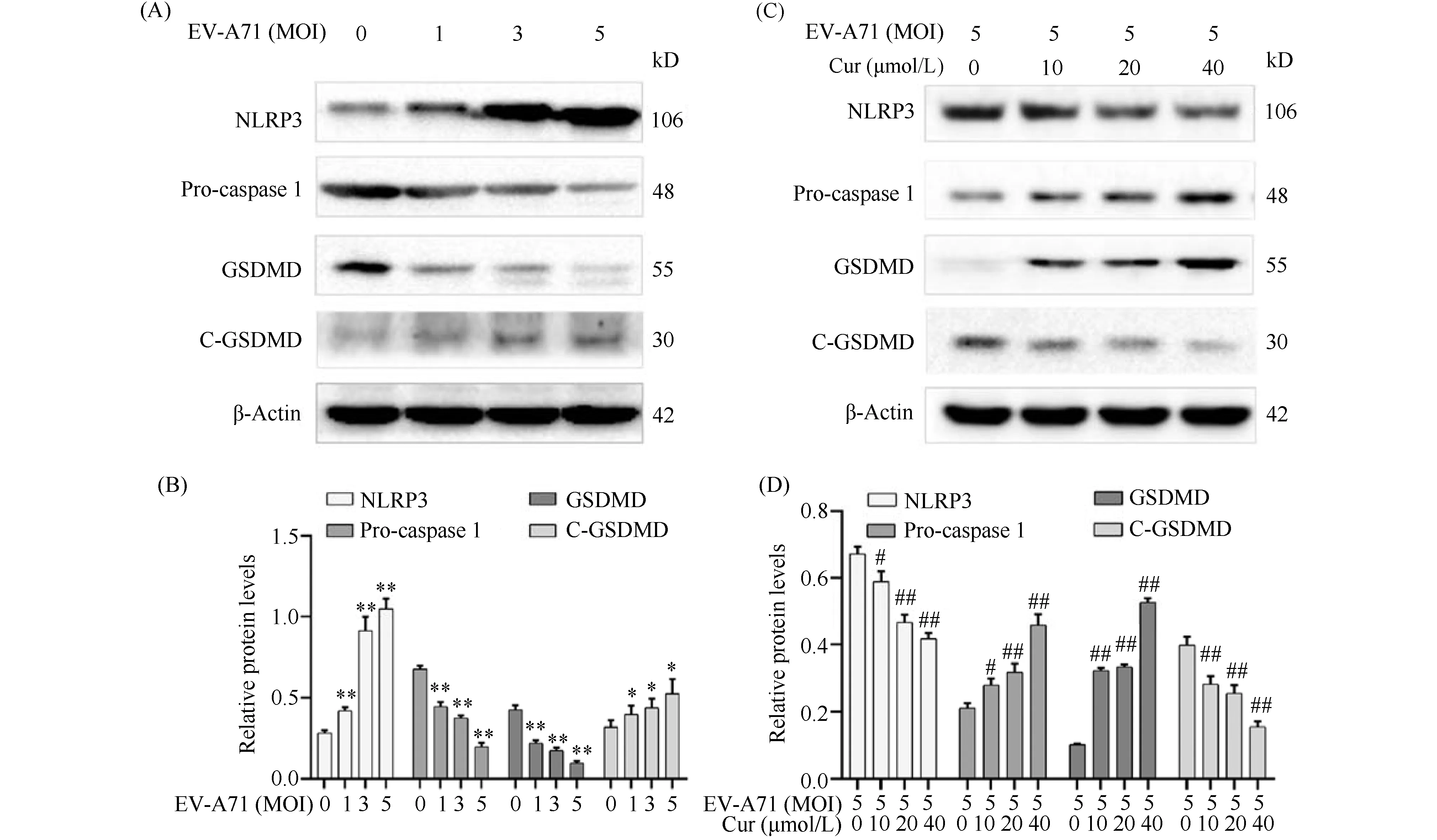
Fig.5 Curcumin inhibited EV-A71-induced pyroptosis (A) The effect of EV-A71 at different ratios of MOI on the expression levels of pyroptosis-related proteins, NLRP3, caspase 1 and GSDMD, were determined by Western blot. (B, D) Quantitative analysis of pyroptosis-associated protein expression. (C) The effect of curcumin on the expression levels of pyroptosis-related proteins, NLRP3, caspase 1 and GSDMD, was determined by Western blot. Data represent means ± SD (n=3).*P<0.05,**P<0.01 vs the mock group,#P<0.05,##P<0.01 vs the EV-A71 infected group.
2.6 姜黄素可以抑制肠道病毒-A71的产生
用MOI为5的EV-A71感染细胞24h,同时用浓度为40 μmol/L姜黄素干预细胞,Western 印迹检测发现,姜黄素可以减少细胞内EV-A71结构蛋白质VP1的水平(P<0.05)(Fig.6A,B),用CCID50测定细胞培养上清中EV-A71病毒的滴度,发现姜黄素可以减少细胞上清中EV-A71的产生量(Fig.6C)(P<0.01)。
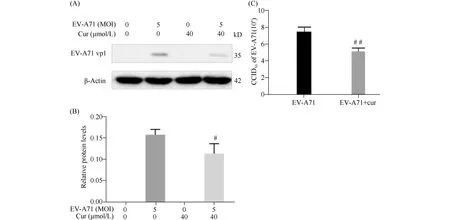
Fig.6 Curcumin restricted EV-A71 replication (A) Western blot analysis of EV-A71 replication affected by curcumin in cells. (B) Quantitative analysis of EV-A71 VP1 protein expression. (C) The virus titer in the supernatant was determined by a CCID50 assay. Data represent means ± SD (n=3).#P<0.05,##P<0.01 vs the EV-A71 infected group
2.7 姜黄素及自噬抑制剂可抑制肠道病毒-A71诱导的细胞内p38/NLRP3通路的激活
用MOI为5的EV-A71感染细胞24h,同时用浓度为40μmol/L姜黄素干预细胞,Western 印迹检测发现,EV-A71能增加细胞内P-p38、NLRP3的水平(P<0.01),姜黄素能抑制EV-A71引起的炎症信号通路蛋白质P-p38(P<0.01)、NLRP3(P<0.05)增加(Fig.7A,B)。用MOI为5的EV-A71感染细胞24 h,同时分别用浓度为10μmol/L自噬起始阶段抑制剂3-MA及自噬溶酶体抑制剂氯喹干预细胞,Western 印迹检测发现,EV-A71可以引起自噬底物p62的降解(P<0.05),3-MA和氯喹可以逆转EV-A71引起的细胞内p62(P<0.05)、P-p38MAPK(P<0.05)及NLRP3(P<0.01)的变化(Fig.7C,D)。

Fig.7 Curcumin and autophagy inhibitor suppressed EV-A71-induced p38/NLRP3 activation (A) Western blot was performed to analyze the effect of EV-A71 and curcumin on the expression of p38MAPK and NLRP3. (B, D) Quantitative analysis of the protein expression p38MAPK and NLRP3. (C) The effect of autophagy inhibitor on expression of p38MAPK, NLRP3 was determined by Western blot. Data represent means ± SD (n=3).*P<0.05,**P<0.01 vs the mock group,#P<0.05,##P<0.01 vs the EV-A71 infected group
2.8 姜黄素可抑制细胞自噬流
用MOI为5的EV-A71感染细胞24h,同时用浓度分别为10 μmol/L、20 μmol/L、40 μmol/L姜黄素干预细胞,Western 印迹检测发现,随着姜黄素浓度的增加,EV-A71感染细胞内自噬标志蛋白LC3Ⅱ/LC3Ⅰ的比值逐渐下降(P<0.01),自噬底物p62的水平逐渐升高(P<0.05),40 μmol/L姜黄素对自噬流的抑制最为明显,说明姜黄素可以抑制自噬溶酶体阶段的进程(Fig.8A,B)。用40 μmol/L姜黄素干预细胞,免疫荧光检测发现,与对照组相比,姜黄素可增加细胞内LC3及P62的水平,p62呈点状聚集,提示姜黄素具有对自噬流的抑制作用。

Fig.8 Curcumin inhibited EV-A71-induced autophagy Cells were treated with EV-A71 (MOI=5), and a combination of EV-A71 and curcumin (10, 20, 40μmol/L) for 24 hours, respectively. (A) Western blot analysis was performed to detect the expression of autophagy-related proteins, LC3 and p62. (B) Quantitative analysis of autophagy-associated protein expression. (C) Immunofluorescence staining was used to detect the changes of autophagy-related proteins in cells. Data represent means ± SD (n=3).#P<0.05,##P<0.01 vs the EV-A71 infected group, scale bar is 20 μm
3 讨论
近年来研究发现,细胞焦亡介导了病毒感染的炎症反应,EV-A71感染引起的重症手足口病也是以过激的炎症反应和损伤为主[12]。受到刺激时,胞内受体NLRP3与接头蛋白ASC、及胱天蛋白酶 1共同组成了焦亡上游的炎症小体,并激活胱天蛋白酶1,激活的胱天蛋白酶1切割焦亡蛋白家族gasdermin,切割的gasdermin在细胞膜上打孔,激活焦亡[14, 15]。本研究在细胞水平明确EV-A71感染抑制GES-1细胞的增殖,造成细胞的损伤,诱导NLRP3激活的、胱天蛋白酶1依赖的、GSDMD参与的细胞焦亡。且伴随炎症细胞因子IL-1β的产生,提示病毒诱导的细胞焦亡,在EV-A71致病过程中发挥重要作用。EV-A71从消化道入侵,多引起儿童致病。我们希望,从常见的食物提取物中寻找能够发挥抗焦亡作用的物质,来研究其细胞保护作用,进一步探索其用于治疗EV-A71感染的可能性。幸运的是我们找到了一些物质[12],姜黄素是其中的一种。
姜黄素是从姜黄中提取的黄色多酚化合物。研究发现,姜黄素具有抗菌[16]和抗肿瘤[17]等作用,在一些感染或非感染性疾病模型上,可分别通过调控NLRP3[18, 19]、TLR4/NF-kB[18]、PI3k/Akt[20, 21]等不同通路发挥抗炎作用。也有研究表明,其抗炎作用可能与其抗氧化作用有关[18, 21]。另有研究发现,姜黄素可以增强人牙髓间充质干细胞免疫调节和再生作用[10]。可见姜黄素可以对多靶点进行调控,具有多效性。本研究首先证明了姜黄素可以逆转EV-A71对细胞活力的抑制和对细胞的损伤,提示姜黄素可以作为一种细胞保护剂来预防或减轻病毒引起的细胞毒性。本文在EV-A71感染的细胞模型上证明,姜黄素可以通过降低EV-A71感染细胞内的NLRP3水平来抑制EV-A71感染诱导的细胞焦亡,并且可以抑制IL-1β的产生,进一步证明了姜黄素具有治疗EV-A71感染的潜力。一些研究在其他疾病模型上发现,姜黄素可以发挥抑制NLRP3的作用[22-24],与本文在EV-A71感染细胞模型上的发现一致。
我们之前的研究证明,抑制细胞自噬可以通过下调NLRP3而抑制EV-A71诱导的细胞焦亡,提示本文能围绕此通路进一步研究姜黄素抗焦亡的机制。很多研究显示,p38 MAPK参与了与促炎分子表达相关的炎症反应。有学者[25]在帕金森疾病模型上发现,小胶质细胞中,p38的磷酸化可抑制NLRP3的降解,表明p38在神经炎症中NLRP3的激活中发挥重要作用。另有研究[26]显示,p38/NLRP3信号通路上调的焦亡,参与了睡眠剥夺诱导的大鼠的中枢神经炎症。但也有研究[27]发现,p38 MAPK的药理抑制或遗传缺陷会导致NLRP3炎症小体过度激活、胱天蛋白酶1激活增强、及IL-1β和IL-18产生增强。我们在之前的研究发现,p38 MAPK的激活参与EV-A71诱导的炎性细胞因子IL-6的产生[4],说明p38 MAPK参与EV-A71诱导的炎症反应。在本研究中发现,姜黄素可以逆转EV-A71对p38 MAPK和NLRP3的激活,提示姜黄素的抗炎作用可能通过下调p38/NLRP3信号通路而发挥的。
邵峰院士团队[28]最早研究发现,胱天蛋白酶1对炎症活化巨噬细胞内的GSDMD进行切割,产生N-GSDMD片段定位于细胞膜后增加细胞膜通透性。之后,他们与合作者的研究[29]发现,中性粒细胞中的N-GSDMD主要与嗜天青颗粒和自噬体LC3结合,且中性粒细胞通过自噬依赖机制分泌IL-1β,表明了中性粒细胞炎症体激活过程中,GSDMD引起的IL-1β分泌与自噬有关联,提示自噬对GSDMD介导的焦亡有调控作用。已有研究[30]证明,p38 MAPK通路可以抑制自噬,而我们之前的研究发现,自噬抑制剂也可以抑制p38 MAPK的激活。在本研究中,我们也很感兴趣姜黄素对自噬的调控作用。本文的结果证明,姜黄素可以发挥与自噬抑制剂氯喹相似的作用,显著抑制了自噬溶酶体阶段,说明姜黄素通过对自噬的抑制,下调了p38/NLRP3通路,从而发挥了抗焦亡作用,但其具体调控机制,仍需要进一步研究。
另外,本文验证了姜黄素可以抑制EV-A71在细胞内的病毒蛋白质的生物合成和细胞外病毒的产生,这一发现与Wang等学者[31, 32]的发现一致。其他研究发现,姜黄素通过抑制病毒包涵体人乳头瘤病毒3型的吸附和复制[33],以及通过激活Nrf2来抑制甲型流感病毒[34]的吸附和复制。姜黄素是否有直接吸附病毒作用,还是影响了病毒的复制周期,仍需要进一步研究。另有观点提出了姜黄素应用于新冠肺炎的治疗的可能性[9, 35, 36]。最近的研究发现,EV-A71感染可以诱导活性氧(ROS)产生[37],而一些研究发现,姜黄素可以通过激活Nrf2来减轻ROS的损伤[38, 39],其对氧化应激的调控作用可能也是姜黄素发挥抑制病毒复制和致病作用的原因之一。以上发现均为姜黄素在抗病毒治疗中的应用提供了更多的实验依据。
本研究证明了姜黄素对EV-A71感染细胞的保护作用、抗病毒作用、抗焦亡作用及机制,为姜黄素应用于临床及日常生活中EV-A71感染的防治提供新的参考。接下来,我们将围绕姜黄素的抗EV-A71病毒机制及调控焦亡的机制展开进一步深入研究。

