细胞焦亡在肿瘤发生、发展与治疗中的作用
姜 珊, 关一夫, 李 硕*
(1)中国医科大学智能医学学院生物医学工程教研室, 沈阳 110122;2)中国医科大学生命科学学院生物化学与分子生物学教研室,沈阳 110122)
癌症是一种全球性疾病,严重威胁着世界各地患者的健康和生命。近年来人口老龄化趋于严重,人类生存环境污染加剧,癌症的发病率和死亡率不断增加。细胞死亡是肿瘤化疗或免疫治疗有效后的直接表现,因此,研究肿瘤细胞死亡途径对于肿瘤的早期治疗有十分重要的意义。近年来,作为热点死亡途径之一的细胞焦亡备受关注。
细胞焦亡(pyroptosis)是细胞自身的一种程序性死亡(programmed cell death),又被称为细胞炎性坏死,主要表现形式为细胞在感知病原体侵袭后启动免疫防御反应,并在细胞膜上自动打孔形成孔洞,排出胞浆内容物引起炎症反应。近年来,细胞焦亡在肿瘤发病机制中的作用变得越来越突出,焦亡信号通路分子及细胞焦亡过程中释放的多种炎症介质与肿瘤的发生、发展及对肿瘤化疗和免疫治疗的反应密切相关。本文通过对焦亡的类型、分子机制、对癌症的潜在影响以及在抗癌治疗中的作用等4个方面总结和讨论细胞焦亡的研究进展。
1 细胞焦亡的类型及分子机制
20世纪90年代,科学家利用电镜观察被志贺氏菌或沙门氏菌感染的小鼠巨噬细胞和人类单核细胞时,发现细胞的死亡表现出“染色质固缩、胞膜出泡、胞质空泡化和内质网膨胀,仍保留细胞器结构”等特点,且基因组电泳结果显示DNA片段化[1]。这是首次观察到的细胞焦亡现象。此时人们把这种细胞自身杀伤的现象认为是细胞凋亡。2001年,随着研究的深入,人们意识到这是一种与传统的细胞凋亡完全不同的死亡模式[2],并首次提出了细胞焦亡概念[3],即细胞在受到某些病原体刺激时,激活后的胱天蛋白酶-1(caspase-1),将白细胞介素18/1β(interleukin18/1β,IL-18/1β)活化,细胞膜完整性被破坏,导致促炎性的细胞程序性死亡。2015年,研究发现胱天蛋白酶-10和胱天蛋白酶-4/5/11被激活后,切割Gasdermin D(GSDMD),可以引起细胞焦亡[4]。2017年,邵峰等人发现,Gasdermin家族的另一蛋白质分子Gasdermin E(GSDME)。在化疗药物作用下,肿瘤细胞内的胱天蛋白酶-3水解活化,切割GSDME,并以类似GSDMD的模式执行细胞焦亡。这些结果颠覆了人们对于细胞焦亡是感染性细胞死亡的原有认知[5]。细胞焦亡是由效应蛋白质Gasdermin家族蛋白而不是由上游蛋白质胱天蛋白酶所决定的细胞死亡形式。2018年,细胞死亡命名委员会(NCCD)将细胞焦亡的定义修正为:一种不完全依赖于炎症性胱天蛋白酶活化,由Gasdermin家族蛋白质介导的细胞程序性死亡[6]。2020年,在细胞毒性淋巴细胞杀伤靶细胞的过程中,细胞毒性淋巴细胞来源的丝氨酸蛋白酶(Granzyme A,GZMA)被证实,其可以经穿孔素(perforin)进入靶细胞,通过水解Gasdermin B(GSDMB)分子上的2个赖氨酸位点诱导细胞焦亡。这进一步验证了Gasdermin家族蛋白的生物学功能,首次发现Gasdermin家族蛋白能在非天冬氨酸位点经丝氨酸蛋白酶水解执行打孔功能[7]。
1.1 胱天蛋白酶-1诱导的经典炎症小体的焦亡途径
胱天蛋白酶-1诱导的经典炎症小体的焦亡途径主要分为两个步骤。激活经典焦亡的第一步是形成炎症小体[2,5]。炎症小体是包含模式识别受体(pattern recognition receptor,PRR)、衔接蛋白(apoptosis-associated speck-like protein,ASC)和下游的效应蛋白胱天蛋白酶在内的多分子复合物。在病原微生物入侵或内部损伤因子作用下,机体固有免疫系统以入侵病原体的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)和机体自身细胞死亡所释放的内源性分子的损伤相关分子模式(damaged-associated molecular patterns,DAMPs)启动炎症小体的组装激活[2]。PRR主要包括:toll样受体(toll-like receptors,TLRs),核苷酸结合域(nucleotide-binding domain)、nod样受体(nod-like receptors ,NLRs)以及黑色素瘤缺乏因子(absent in melanoma,AIMs)类受体[8,9]。ASC在整个经典炎症小体焦亡途径发挥连接受体蛋白质和效应蛋白质的作用。ASC是由胱天蛋白酶激活和募集结构域(cystatinase aggregation domain,CARD)以及吡喃结构域(pyrin domain,PYD)组成,它们通过同型相互作用聚集在一起[10]。第二步,聚集后的ASC招募胱天蛋白酶-1的前体(pro caspase-1),激活胱天蛋白酶-1[11,12],裂解IL-18/1β的前体(pro IL-18/1β),介导成熟后的IL-18/1β释放到细胞外并引发炎症反应[13]。激活的胱天蛋白酶-1也可以将GSDMD切割,并释放出具有打孔功能的N端结构域(GSDMD-NT),在细胞质膜上打孔,使细胞肿胀破裂并伴随分泌的促炎症介质(high mobility group box1,HMGB1)和IL-α的释放,引发细胞焦亡[14],见Fig.1。

Fig.1 Caspase-1-mediated classical inflammatory pyroptosis The CARD and PYD domains on PRR are linked to the ASC to form ASC aggregation, which in turn activates Caspase-1 and pro IL-18/1β. The activated Caspase-1 can cleave GSDMD to produce GSDMD-NT and punch holes in the cell membrane
1.2 非经典炎症小体焦亡途径
非经典炎症小体焦亡途径与经典炎症小体途径的最大不同是无需炎症小体参与,直接由鼠源的胱天蛋白酶-11和人源的胱天蛋白酶-4/5诱发(见Fig.2)。这个过程需要炎性刺激因子脂多糖(lipopolysaccharide,LPS)的参与,不通过受体直接进入细胞质与胱天蛋白酶-11结合并激活后续反应[15]。胱天蛋白酶-11可以识别并结合LPS。因此,细胞质LPS被认为是胱天蛋白酶-11激活的细菌信号。活化的胱天蛋白酶-11既能诱导焦亡,又能通过裂解GSDMD激活胱天蛋白酶-1[4]。LPS来自革兰氏阴性菌(G—),主要是由脂质A、核心寡糖链和可变多糖链(O抗原)三部分组成的。胱天蛋白酶-11通过与脂质A的特异性和高亲和力结合,直接识别LPS[16],这种结合造成了胱天蛋白酶-11的寡聚化,从而激活了它的蛋白质分解活性。因此,非经典炎症小体途径不依赖胱天蛋白酶的作用,而是依靠蛋白质的寡聚作用。活化的胱天蛋白酶-4/5/11切割GSDMD,生成GSDMD-NT,在细胞膜上打孔。形成的孔洞导致K+外流、NLRP3(nucleotide-binding oligomerization domain, leucine- rich repeat and pyrin domain-containing 3)炎症小体和胱天蛋白酶-1的激活,在细胞内驱动IL-1β/18的成熟,产生正反馈调节,同时伴随HMGB1和IL-α的释放。

Fig.2 Non-classical inflammatory pyroptosis Caspase-4/5/11 recognizes and binds LPS to activate Caspase-4/5/11. The activated Caspase-4/5/11 cleaves GSDMD and generates GSDMD-NT to punch holes in the cell membrane
1.3 Caspase-3和GSDME介导的焦亡途径
研究发现,除了胱天蛋白酶-1/11/4/5之外,其他胱天蛋白酶也可以激活细胞焦亡。化疗药物激活的胱天蛋白酶-3可以诱导正常细胞和肿瘤细胞发生GSDME依赖的细胞焦亡过程[17,18]。活化的胱天蛋白酶-3裂解GSDME,生成GSDME-NT,随后转移到细胞质膜上,并对细胞膜打孔,产生细胞焦亡现象(见Fig.3)。Rogers等[19]研究发现,GSDME-NT不仅具备质膜打孔功能,也可以通过在线粒体中易位、通透和形成孔洞等方式促进细胞凋亡。GSDME-NT可以诱导线粒体孔释放出细胞色素c,增强了凋亡蛋白酶激活因子1(Apaf-1)凋亡体的激活,并对胱天蛋白酶-3的活化和GSDME的裂解形成正反馈。胱天蛋白酶-3既可以诱导凋亡,也可以诱导细胞焦亡,而GSDME可以将胱天蛋白酶-3介导的细胞死亡从细胞凋亡转换为细胞焦亡,使癌细胞对化疗药物更加敏感[17]。但GSDME在大多数癌细胞中沉默,在许多正常组织中表达。GSDME介导的细胞焦亡可能是癌症化疗过程中毒副作用产生的重要原因。
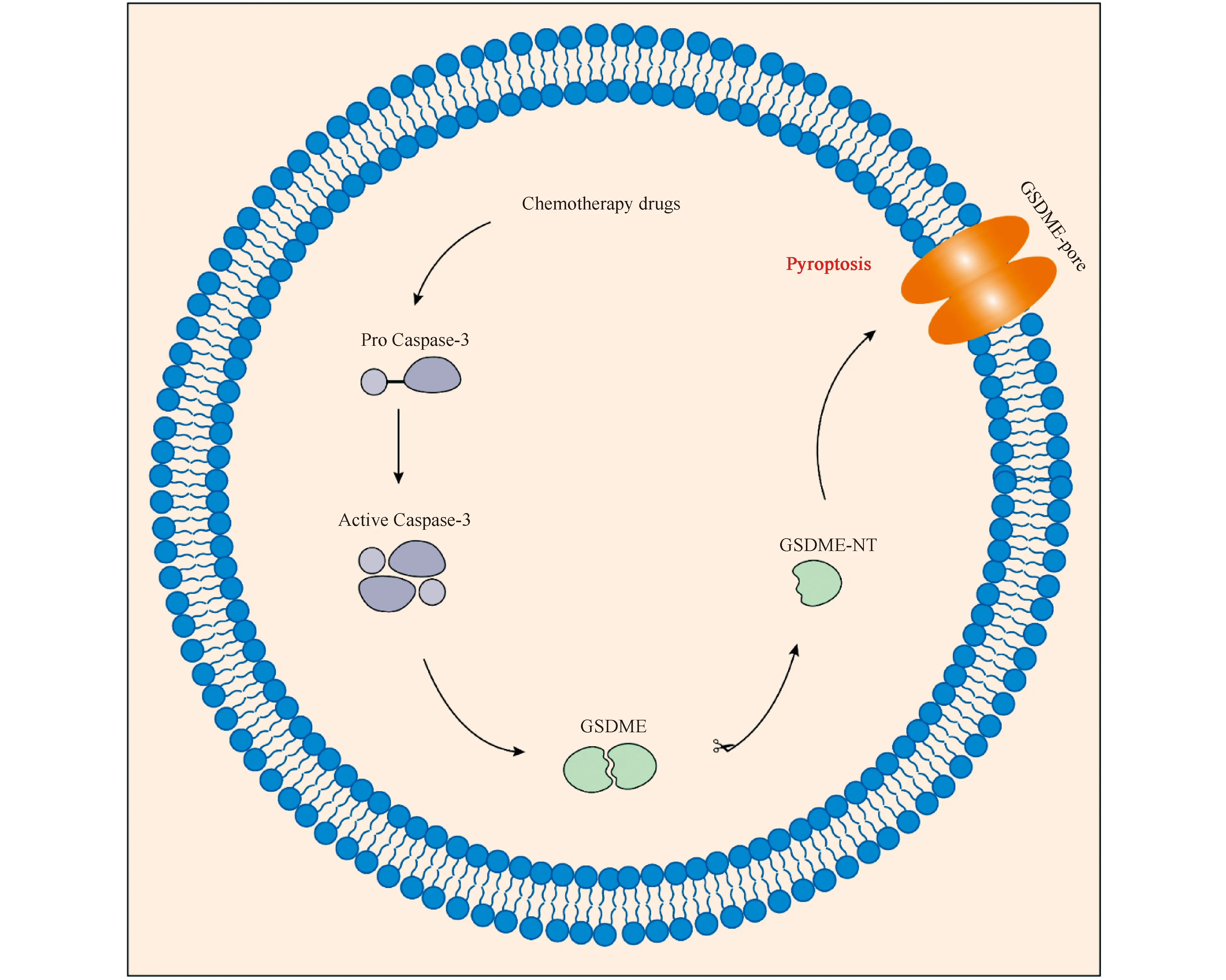
Fig.3 Caspase-3 and GSDME-mediated pyroptosis Chemotherapeutic drugs induce Caspase-3 activation, and the activated Caspase-3 cleaves GSDME to generate GSDME-NT to punch holes in the cell membrane
1.4 肿瘤免疫治疗中颗粒酶介导的细胞焦亡
在肿瘤免疫治疗中细胞毒性淋巴细胞发挥着重要的作用。病毒感染或移植器官的免疫效应主要是靠细胞毒性T淋巴(cytotoxic T lymphocytes,CTL)细胞和自然杀伤(natural killer,NK)细胞完成。这种细胞毒性是Fas死亡受体下游或颗粒胞吐途径的结果,依赖于穿孔素将丝氨酸蛋白酶,即颗粒酶(granzyme)转运到靶细胞内。2020年的一项研究表明,CTL和NK细胞可通过细胞焦亡的方式杀死表达GSDMB的细胞。正如Fig.4所示,在NK细胞和CTL细胞释放的穿孔素协助下,颗粒酶A(granzyme A,GZMA)进入靶细胞,通过在Lys229/Lys244位点水解GSDMB引起焦亡,证明GSDMB介导的细胞焦亡是细胞毒性颗粒穿孔素和颗粒酶共同作用的结果[20]。这项研究揭示了GZMA-GSDMB通路在CTL细胞杀伤靶细胞过程中的重要作用,激活的淋巴细胞能够通过释放IFN-γ增强这一通路,实现正反馈调节。NK细胞中颗粒酶B(granzyme B,GZMB)通过直接裂解GSDME并间接激活胱天蛋白酶-3诱导肿瘤细胞GSDME依赖性细胞焦亡[7]。
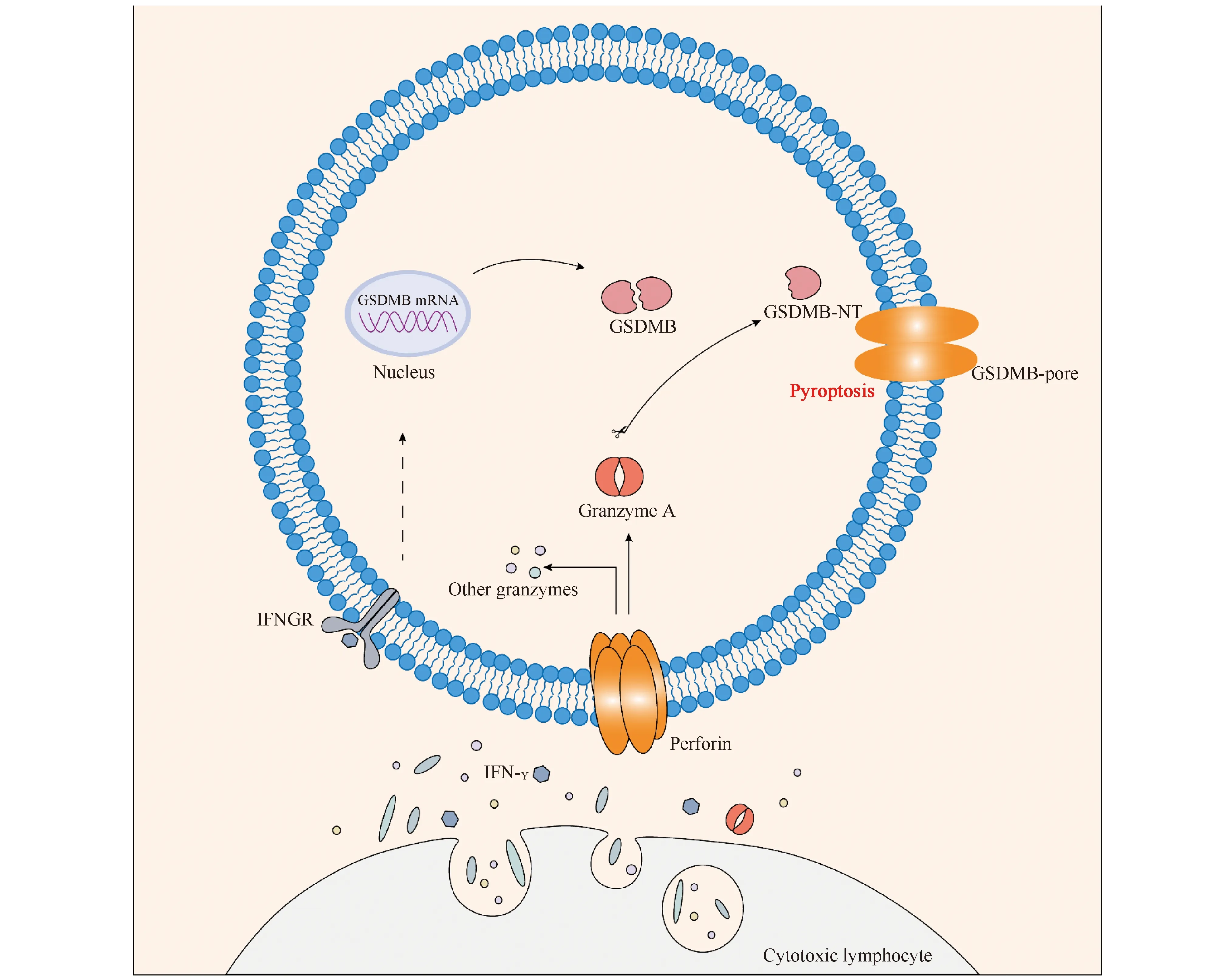
Fig.4 Granzyme A-mediated pyroptosis Granzyme A is released into target cell via CTL cell by perforin to hydrolyze GSDMB causing pyroptosis
嵌合抗原受体T细胞(CAR-T)疗法是通过改造病人自身免疫系统而实现特异性杀死癌症细胞的一种免疫治疗方法,但CAR-T的临床应用中,会伴有明显炎症风暴的副作用。研究表明,CAR-T细胞通过释放颗粒酶B,快速诱导靶细胞胱天蛋白酶-3活化并激活GSDME引起癌细胞焦亡,进而释放HMGB1等因子,激活巨噬细胞中的Caspase-1-GSDMD和MAPK-NF-κB两条炎症通路,进而引起炎症风暴[21]。这就是部分淋巴瘤和白血病患者发生炎症风暴的原因之一。这项研究为CAR-T疗法如何高效特异地杀死肿瘤细胞的进一步改进提供实验依据。同时为解决CAR-T疗法的副作用提供了潜在的方法,并为优化新一代CAR-T治疗癌症提供理论前提。以上研究证实,GZMA-GSDMB和GZMB-GSDME通路在机体的抗肿瘤免疫过程中的重要作用,为肿瘤免疫治疗提供了新思路。
1.5 Gasdermin家族蛋白质
Gasdermin家族蛋白质在细胞焦亡过程中发挥了质膜打孔的功能。目前,该家族在人类中包括6个同源基因GSDMA、GSDMB、GSDMC、GSDMD、GSDME(DFNA5)和PJVK(DFNB59、GSDMF)[11]。人类的Gasdermin蛋白由上述6个基因编码,其序列相似度极高。Gasdermin家族成员都有2个保守的结构域(PJVK除外),分别是1个N-端结构域和1个C-端结构域。N-端结构域具有质膜打孔功能,诱导细胞焦亡;C-端的结构域具有抑制作用,可以和N-端结合抑制细胞焦亡。N-端结构域显示出较高的序列相似性。相比之下,C-端结构域的长度不一,相似度较低[4,22]。
GSDMA(又称GSDM1)主要在人体上皮细胞中表达。早期研究表明,GSDMA在胃肠道上皮细胞中高表达,但在原发性胃癌组织和细胞系中被沉默[23]。而在人类胃癌细胞系中恢复GSDMA可以增加细胞对转化生长因子-β(TGF-β)诱导凋亡作用的敏感性[24]。GSDMB(又称GSDML)在胃癌、宫颈癌和乳腺癌以及肝癌组织中表达增加,参与了肿瘤的发生和进展[25]。研究发现,GSDMB异构体2与乳腺癌细胞的致瘤性和高转移性表型密切相关[26]。GSDMC在转移性黑色素瘤细胞中呈现高表达特性[27]。在结肠肿瘤的研究中发现,GSDMC基因敲除,可以抑制结肠癌细胞的增殖,为GSDMC的促肿瘤作用提供了进一步证据[28]。GSDMD(也称GSDMDC1、DFNA5L或FKSG10)在不同的人体组织以及白细胞的不同亚群中广泛表达[29,30]。GSDMD的同源基因只存在于哺乳动物的基因组中,并且都含有一个较大的中央结构域,该结构域含有胱天蛋白酶的裂解位点。GSDMD是非经典炎症小体焦亡途径的唯一执行者,可被胱天蛋白酶-1、胱天蛋白酶-4、胱天蛋白酶-5和胱天蛋白酶-11在天冬氨酸位点处剪切成GSDMD-NT,引起细胞焦亡。GSDME(又称ICERE-1或DFNA5)为非遗传性常染色体显性听力损失的一个候选基因[31]。此后发现,它与Gasdermin具有序列和结构上的相似性[32]。在不同的人类细胞和组织中都有GSDME的表达,包括大脑、子宫内膜、胎盘和肠道等。该蛋白质在肿瘤化疗药物的作用下,通过胱天蛋白酶-3的切割作用获得活性,诱导肿瘤细胞发生焦亡,并在化疗药物对正常组织的毒副作用中扮演重要角色。PJVK(也称DFNB59或GSDMF)是另一种与耳聋有关的突变基因,PJVK与GSDME有很高的序列相似性,该基因最初是从人类睾丸中克隆而来[33]。PJVK在卵巢癌组织中的表达量明显低于正常卵巢组织中的表达水平。PJVK的低表达水平,预示着卵巢肿瘤的预后更差[34]。
2 细胞焦亡在肿瘤中的作用
越来越多的研究表明,抗肿瘤药物能够通过激活Gasdermin家族蛋白质,诱发细胞焦亡,发挥肿瘤抑制作用。同时,免疫细胞也可以通过诱导肿瘤发生细胞焦亡,实现肿瘤免疫治疗的目的。目前,细胞焦亡通路参与了肿瘤的发病机制,诱导细胞焦亡成为癌症治疗的新策略。
2.1 卵巢癌
卵巢癌是女性多发的癌症之一。由于化疗药物引发的毒副作用和耐药性,严重影响了卵巢癌患者的预后。研究发现了多种能通过诱导细胞焦亡的方式,进而抑制卵巢癌细胞生长的生物活性物质。川陈皮素(nobiletin)作为一种新型抗卵巢癌候选药物,是一种来自柑橘皮的聚甲氧基黄酮[35]。这种物质可使线粒体膜电位降低,诱导人卵巢癌细胞活性氧(ROS)生成和自噬发生,诱导IL-1β表达,促进了GSDMD/GSDME介导的焦亡途径[36]。蛇床子素(osthole)是香豆素的衍生物,Liang等[37]研究发现,蛇床子素通过诱导细胞凋亡、自噬和GSDME依赖的细胞焦亡三种不同的死亡方式,抑制卵巢癌细胞生长。同时,α-NETA作为一种有效的非竞争性的胆碱乙酰转移酶,通过Caspase-4/GSDMD途径诱导上皮性卵巢癌细胞焦亡。此外,敲除胱天蛋白酶-4或GSDMD都会强烈干扰α-NETA的细胞抑制活性,表明α-NETA可通过细胞焦亡途径发挥肿瘤抑制作用[38]。
长非编码RNA(lncRNA)作为基因表达的调控因子,参与了不同层次的表达调控,这些转录物参与了多种人类恶性肿瘤的致癌过程[39]。研究表明,lncRNA GAS5对卵巢癌有抑制作用,可以参与炎症小体的形成,进而参与细胞焦亡的调控。LncRNA GAS5的过表达诱导胱天蛋白酶-1表达,活化的胱天蛋白酶-1以时间依赖的方式诱导IL-18/1β的释放,而lncRNA GAS5的敲除则下调IL-18/1β[40]。卵巢癌细胞中lncRNA HOTTIP上调明显,敲低lncRNA HOTTIP表达后,通过上调IL-18/1β和NLRP1,诱导细胞焦亡,抑制卵巢癌细胞生长[41]。卵巢癌中lncRNA GAS5缺失和lncRNA HOTTIP的上调,均可通过调控细胞焦亡信号通路中的分子,抑制卵巢肿瘤的增殖。利用生物信息学的方法,分析公共数据库中细胞焦亡相关的lncRNA表达谱,鉴定到6个与卵巢癌患者的预后及免疫治疗效果密切相关的lncRNA(AC006001.2、LINC02585、AL136162.1、AC005041.3、AL023583.1和LINC02881)[42]。因此,LncRNA有望用于卵巢癌的临床诊断和治疗。
2.2 乳腺癌
乳腺癌是女性最常发生的癌症,由于疾病的异质性,治疗方案需要根据疾病的特征和阶段对个体病例进行合理的治疗。研究发现,化疗药物对乳腺癌具有促焦亡作用。多柔比星(doxorubicin,DOX)是一种典型的蒽环类抗肿瘤药物,在利用DOX治疗乳腺癌的过程中,DOX诱导了乳腺癌细胞内ROS的积累,刺激JNK的磷酸化,随后通过激活Caspase-3/GSDME通路诱发焦亡,抑制肿瘤生长。然而,GSDME是一把双刃剑,它在心肌组织也有表达,DOX治疗过程中心肌细胞发生的细胞焦亡,是DOX诱导的心血管毒性的主要原因之一,同时也限制了化疗药物的应用。最近的研究表明,达诺比星、多柔比星、表柔比星和放线菌素-D等化疗药物,均能激活乳腺癌细胞中的胱天蛋白酶-8,剪切GSDMC,诱发乳腺癌细胞焦亡,发挥抑制乳腺癌增殖的作用。对于PD-L1和GSDMC均表达的乳腺癌细胞,化疗过程中诱发的癌细胞焦亡作用,可以促进树突状细胞的激活和T细胞的浸润,增强抗肿瘤免疫作用[43]。中药在乳腺癌的治疗中也发挥了重要作用,Li等人[44]研究发现,双氢青蒿素激活了AIM2/Caspase-3/GSDME轴的表达,诱导乳腺癌细胞焦亡,展现了双氢青蒿素的抗乳腺癌的生物学活性。
除这些药物外,ω-3脂肪酸对乳腺癌细胞同样有促焦亡作用。ω-3脂肪酸可以调节炎症小体的生成,促使癌细胞死亡。二十二碳六烯酸(docosahexaenoic acid,DHA)是一种具有抗癌作用的ω-3不饱和脂肪酸。经DHA处理的三阴性乳腺癌细胞MDA-MB-231中胱天蛋白酶-1表达增加,诱导GSDMD的剪切和IL-1β的分泌增强以及HMGB1迁移至细胞质,细胞膜孔形成,发生细胞焦亡[45]。
2.3 宫颈癌
90%以上的宫颈癌患者都与人乳头瘤病毒(HPV)的感染有关[46]。HPV通过病毒基因组整合和逃避宿主的抗病毒免疫力,将HPV感染的宫颈细胞变成癌细胞[47]。Sirtuin 1(SIRT1)是烟酰胺腺嘌呤二核苷酸(NAD)依赖性酶,已被证明通过使NF-κB的RelA/p65亚基去乙酰化来调节细胞死亡[48]。SIRT1在HPV感染的宫颈癌细胞中高表达,并促进了癌细胞的生长和增殖[49]。SIRT1在宫颈癌细胞中的表达抑制了NF-κB诱导的AIM2基因的转录。人为敲除SIRT1会上调AIM2相关基因,导致AIM2炎症小体相关的GSDMD途径的细胞焦亡[50]。
多吡啶钌(II)配合物是一种具有潜在的抗肿瘤功能的金属配合物。多吡啶钌(II)复合物Δ-Ru1和紫杉醇组合使用,可以通过Caspase-1/GSDMD介导的细胞焦亡作用诱导细胞死亡,从而增强对宫颈癌紫杉醇耐药细胞的治疗效果。这项研究为钌复合物和其他药物联合应用提供治疗的新思路,以此克服癌症的耐药性[51]。
2.4 消化道癌
胃食管反流病损伤食管黏膜,使食管上皮细胞长期暴露于酒精等刺激,引发慢性炎症,因此,增加了食道癌的发生率。酒精蓄积促进食管上皮细胞IL-18/1β的释放,诱发细胞焦亡,加剧了食管炎的进展。进一步的研究通过分析有20年饮酒史的食道癌患者的肿瘤与癌旁组织的蛋白质表达量,发现肿瘤部位的胱天蛋白酶-1、IL-1β和IL-18表达增加,细胞焦亡参与了食管癌的发生和发展[52]。除了酒精蓄积外,G—的LPS通过激活NOD样受体促进促炎症细胞因子的分泌,诱导细胞焦亡,参与了食道癌的发生和发展。二甲双胍(metformin)可以诱导食管鳞癌细胞发生细胞焦亡。脯氨酸-谷氨酸-亮氨酸富集蛋白1(PELP1)是一种原癌基因,PELP1的上调与癌症的发展和病人的结局高度相关。二甲双胍可通过靶向miR-497/PELP1轴,诱导食管鳞癌细胞发生GSDMD介导的细胞焦亡[53]。
胃癌是我国最常见的恶性肿瘤之一。GSDME在胃癌中具有预后意义,GSDME在胃癌中高表达,敲除GSDME的表达可以抑制胃癌细胞的生长[54]。细胞焦亡是化疗药物在胃癌治疗中发挥作用的机制之一。5-氟尿嘧啶(5-FU)的处理诱导了裂解的胱天蛋白酶-3的表达,激活GSDME-NT的生成,导致了胃癌细胞焦亡[55]。此外,通过CRISPR-Cas9敲除GSDME,可以将5-FU诱导焦亡转换为凋亡,这表明GSDME可以将5-FU诱导的胱天蛋白酶-3依赖性凋亡转换为胃癌细胞焦亡[55]。5-FU以剂量依赖性方式诱导了癌细胞焦亡。胃癌细胞中的GSDME的表达水平因启动子甲基化而下调,甲基化抑制剂地西他滨治疗可诱导胃癌细胞中GSDME表达上调,可以增加细胞对化疗药物的敏感性[17]。
结肠癌是全球第3大常见的癌症。相关研究发现,Forkhead Box P2(FOXP2)可以通过与胱天蛋白酶-1相互作用,调节GSDMD的活性,调控结肠肿瘤中的细胞焦亡发生,发挥肿瘤抑制因子的作用[56]。亚麻木酚素(secoisolariciresinol diglucoside,SDG)是一种全麦亚麻籽中的木脂素成分,具有抗癌活性。亚麻木酚素通过激活结肠癌细胞HCT116中的ROS/PI3K/AKT/BAX/Caspase-1/GSDMD信号轴,诱导细胞焦亡,发挥抗肿瘤作用。研究不仅提出了亚麻木酚素的抗肿瘤机制,也为其在癌症治疗中的潜在新应用提供启示[57]。
索菲拉尼(sorafenib)是一种多靶点抗肿瘤药物,已经被批准用于无法手术或远处转移的肝癌治疗,可以用于对标准疗法无响应或不能耐受的胃肠道基质肿瘤和转移性肾细胞的治疗。索菲拉尼能够选择性地靶向多种激酶受体,在肿瘤生长过程中发挥分子开关的作用。研究发现,索菲拉尼可通过诱导巨噬细胞发生焦亡,并引发NK细胞介导的细胞毒性反应,发挥免疫调节作用以对抗肝癌[58]。此研究证明,索菲拉尼可以通过诱导焦亡的方式治疗肝癌。
2.5 肺癌
肺癌是全球范围内发病率最高,死亡人数最多的恶性肿瘤。在多种肺癌细胞系中,可以检测到GSDME表达。化疗药物紫杉醇和顺铂通过活化Caspase-3/GSDME诱导肺癌细胞A549发生焦亡[59]。在A549细胞中,顺铂比紫杉醇有更强的诱导焦亡能力,表明顺铂在治疗高表达GSDME蛋白的肺癌中具有优势。也有研究证明,GSDME介导的细胞焦亡通过释放趋化因子在肿瘤组织中募集T细胞,为顺铂治疗提供了一种新的抗肿瘤作用机制。在顺铂治疗前,检测GSDME的表达可以有效区分非小细胞肺癌患者对顺铂的敏感程度。GSDME对肺癌免疫调节作用的发现也为肺癌免疫治疗的发展提供了新的潜在靶点[60]。
海洋冷适应性细菌中含有大量生物活性代谢物,在探索其功能的过程中发现,浮游假单胞菌TAC125的粗提物具备抗肺癌细胞增殖的活性,它产生的4-羟基苯甲酸(4-hydroxybenzoic acid,4-HBA)能诱导肺癌细胞A549发生细胞焦亡[61]。4-HBA可选择性地抑制A549增殖,且并不影响正常肺上皮细胞的活力。相关结果显示,用4-HBA处理A549细胞可诱导胱天蛋白酶-1、IL-18/1β编码基因的转录,导致胱天蛋白酶-1的激活和IL-18/1β的分泌,从而诱导细胞焦亡,随后抑制了肺腺癌细胞的增殖活性。
现有研究表明,天然化合物也可以诱导肺癌细胞发生焦亡。查尔酮(chalcone)是一种天然化合物,主要分布在茶、水果和蔬菜等植物中。含有α,β-不饱和酮单元的查尔酮类似物,经证实,其通过调节ROS诱导胱天蛋白酶-3介导的细胞焦亡,以时间和浓度依赖的方式对肺癌细胞表现出强大的抗增殖能力[62]。姜黄素是另一种具有良好的抗炎和抗癌特性的天然化合物。EF24是一种人工合成的姜黄素类似物,氮取代的EF24可抑制肺癌细胞活力,使细胞周期停滞在G2/M期,促进细胞凋亡并抑制体外成瘤裸鼠的肿瘤生长。此外,EF24被证实可以通过抑制NF-κB信号通路,使肺癌细胞的死亡方式从细胞凋亡转为细胞焦亡[63]。麦冬是一种用于治疗肺部疾病的传统中药。麦冬皂苷B作为其中的一种生物活性成分,在体内和体外均被证实能抑制非小细胞肺癌细胞的增殖。麦冬皂苷B通过诱导A549细胞发生Caspase-1/GSDMD信号通路依赖性细胞焦亡,减轻了A549细胞对顺铂的耐药性[64]。硫代吡喃衍生物在体外和体内研究中也表现出良好的抗肿瘤活性,其途径是将细胞凋亡转换为细胞焦亡[65]。降血脂药物辛伐他汀在非小细胞肺癌细胞系和异种移植的小鼠模型中诱导焦亡,可能作为一种新型的非小细胞肺癌治疗药物。这些发现为开发基于诱导焦亡作用的抗癌药物奠定了良好的基础[66]。
环状RNAs是具有基因表达调控作用的非编码RNA。CircNEIL3通过充当miR-1184海绵,从而消除miR-1184对靶基因PIF1 5′-To-3′ DNA Helicase (PIF1)的内源性抑制作用,并诱导显著的DNA损伤,进而触发AIM2炎性体激活,诱导细胞焦亡,最终影响肺癌放疗的存活率。因此,诱导与circNEIL3相关的细胞焦亡,可能成为增强肺癌放疗效果的潜在治疗靶点[67]。
2.6 其他癌症
细胞焦亡在不同的肿瘤类型或进展阶段中发挥不同的作用。鼻咽癌是较为常见的头颈部恶性肿瘤,起病隐匿,早期诊断困难。紫杉醇已被广泛用于治疗晚期鼻咽癌,获得性耐药给肿瘤的治疗带来巨大挑战。紫杉醇同时诱导胱天蛋白酶-1和IL-1β的成熟,以及裂解GSDMD,诱导鼻咽癌细胞发生细胞焦亡。抑制Caspase-1/GSDMD通路的表达,可以抑制细胞焦亡水平,诱导鼻咽癌细胞5-8F出现了耐药表型。抑制自噬相关蛋白Beclin-1,可以通过激活Caspase-1/GSDMD途径诱导细胞焦亡发生,恢复鼻咽癌耐药细胞对紫杉醇的敏感性。因此,这些研究使我们对紫杉醇诱导的细胞死亡机制有了新的认识,并为改善晚期鼻咽癌患者的治疗效果提供了有望的方法[68]。木薯素(casticin)是从枸杞子中提取的具有抗肿瘤活性的成分,木薯素同样可以通过诱发焦亡,发挥抗鼻咽癌的作用。木薯素通过PKR/JNK/NF-κB信号通路,诱导的胱天蛋白酶-1炎症小体的形成和炎症细胞因子的释放,这是其抗肿瘤的作用机制之一[69]。丹参酮IIA(tanshinone IIA)通过调节miR-125b/foxp3/Caspase-1/GSDMD信号通路,增强了鼻咽癌细胞HK1的焦亡作用并抑制其增殖[70]。
头颈部肿瘤因其特殊的发病部位,对患者的生命质量影响很大。头颈部肿瘤的治疗面临诸多挑战,中药在头颈部肿瘤的治疗中也有着举足轻重的作用。三苯氧胺(triptolide,TPL)是一种从传统中草药中分离出来的天然物质。经TPL处理抑制了头颈癌细胞中c-myc和线粒体己糖酶II的表达,导致BAD/BAX-Caspase-3的级联激活,诱导GSDME介导的细胞焦亡,进而抑制头颈肿瘤细胞增殖[71]。
真核细胞肽链延伸因子-2激酶(eEF-2K)是蛋白质合成的负性调控因子。黑色素瘤细胞中,沉默eEF-2K后,GSDME表达水平增加,可增强DOX诱导的细胞焦亡作用,从而使黑色素瘤细胞对DOX敏感。该研究阐明了靶向敲低eEF-2K可能加强DOX的抗肿瘤疗效,这为肿瘤化疗提供新启示[72]。肿瘤DNA疫苗是将编码肿瘤特异性抗原的基因结合于表达载体上,再将疫苗直接注入机体,表达出期望的抗原,从而诱导特异性的细胞免疫应答。临床前的实验中,活性胱天蛋白酶-1可以作为肿瘤DNA疫苗中的佐剂成分,通过pro IL-1β的成熟和IL-1β释放,诱导GSDMD依赖性细胞焦亡。同时,也放大了抗原特异性CD8 T细胞的免疫反应,DNA疫苗的治疗可以增加黑色素瘤小鼠的生存率[73]。
溴结构域蛋白(bromodomain containing 4,BRD4)通过调控组蛋白的乙酰化水平,调控众多癌基因的转录,促进肿瘤细胞的增殖。在肾肿瘤中,BRD4明显上调,抑制BRD4可通过激活NF-κB/NLRP3/Caspase-1焦亡信号通路,进而在肾癌中发挥抗肿瘤作用[74],该研究证明,溴结构域小分子抑制剂的抗肿瘤前景值得期待。
甲状腺未分化癌是最具侵袭性的肿瘤之一。阿帕替尼(apatinib)是一种血管内皮生长因子受体2(VEGFR2)的特异性抑制剂。美利曲辛(melittin)是一种从蜂毒中分离出来的活性肽。Zhao等人[75]发现,阿帕替尼和美利曲辛具有协同抗肿瘤作用。低剂量的阿帕替尼和美利曲辛能够通过Caspase-1/GSDMD和Caspase-3/GSDME两个信号轴,同步介导细胞焦亡发生,研究创新性地提出了这两个细胞焦亡信号轴之间双向正反馈作用,这为甲状腺肿瘤的靶向治疗提供了新的可能。
3 问题与展望
细胞焦亡在不同癌症中的作用具有肿瘤异质性,在癌症的增殖、侵袭和转移过程中,发挥了对抗和促进肿瘤进程的双重作用。焦亡的执行分子GSDMB、GSDMC、GSDMD和GSDME在多种肿瘤组织中,发挥肿瘤独立预后因子的作用。从药理学角度出发,寻求促进炎症小体的生成或激活焦亡的分子底物,为肿瘤药物的研发和治疗提供更多思路。从临床诊断角度来看,细胞焦亡在一定程度上也解答了肿瘤化疗和免疫治疗副作用产生的原因,细胞焦亡在肿瘤治疗过程中是一把“双刃剑”。针对现在的多药耐药机制人为高表达Gasdermin蛋白家族,诱导癌细胞焦亡也可实现耐药机制的突破。我们课题组将细胞焦亡与肿瘤耐药研究相结合,研究细胞焦亡的通路与肿瘤耐药的关系。通过构建靶向肿瘤细胞的介孔二氧化硅纳米载药体系,实现肿瘤部位的GSDME过表达质粒及化疗药物同时递送,可诱导肿瘤耐药细胞焦亡,不仅增加了化疗药物的肿瘤抑制作用,同时也减轻了对正常细胞的毒副作用。研究人员也在寻找能够促进细胞焦亡发生和炎症小体生成的分子,这些诱导细胞焦亡的分子包括miRNA和lncRNA等非编码RNA。更有很多种功能已知的药物(二甲双胍,青蒿素、辛伐他仃和DHA等)或具备抗肿瘤潜能的小分子化合物,均可能以诱发细胞焦亡的形式作为新型肿瘤治疗药物应用于临床。细胞焦亡有望作为临床肿瘤治疗和预后分析的新靶点和新思路。

