长非编码RNA TNRC6CAS1作为ceRNA在肥厚型心肌病发生发展中调控BPTF表达的研究
匡 野, 董玉琳, 吉 永, 曹向红
(昆明医科大学附属延安医院医学检验科, 昆明 650051)
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种以心肌细胞肥厚为特征的原发性心肌病,主要表现在心室壁肥厚不对称,心室内腔变小,射血分数出现增加或不变,左室流出道梗阻,舒张功能异常和心肌缺血等[1-3]。作为心血管疾病中典型的遗传性疾病,肥厚型心肌病的病因尚不明确,有明确的遗传性特征,为染色体显性遗传[4]。肥厚型心肌病的细胞分子机制涉及到多种基因的转录表达调节,即伴随着肥厚型心肌病的发生发展,特异致病基因选择性地上调或下调表达。目前,越来越多的研究集中在关于肥厚型心肌病基因及微RNA(microRNA, miRNA),长非编码RNA(Long noncoding RNA,lncRNA)差异表达方面[5-7]。发现并用于临床早期筛查诊断和治疗的新兴分子标志物,阐明各个差异表达的分子之间网络调控关系,是现在研究肥厚型心肌病疾病的重点。
竞争性内源 RNA(competing endogenouse RNA,ceRNA)是一种能够竞争结合RNA的作用元件。miRNA可以通过结合mRNA导致基因沉默,而ceRNA可以通过竞争性地结合miRNA来调节靶基因表达。近年,关于ceRNA在心血管疾病的病理机制及诊治方面的作用研究有较多报道[8-10]。ceRNA所揭示的lncRNA、mRNA和miRNA之间的调控可能与心肌肥厚疾病有着密切的关系。染色质重塑因子(bromodomain PHD finger transcription factor,BPTF)是核小体重塑复合体最重要的一个亚基。BPTF 在DNA表观遗传学上的调节尤为明显,可以引起多种基因和信号通路的异常[11-14]。在本研究中,通过生物信息学分析Gene Expression Omnibus(GEO)数据库,发现BPTF和lncRNA TNRC6CAS1在肥厚型心肌病患者心肌组织中异常表达上调,miR-30c-1-3p异常表达下调,并在临床样本和心肌肥大细胞模型中进一步验证三者的表达异常。并以BPTF为核心mRNA,建立了lncRNA TNRC6CAS1- miR-30c-1-3p-BPTF的ceRNA调控网络,并初步验证三者的表达调控关联。最后,初步验证了lncRNA TNRC6CAS1,miR-30c-1-3p和BPTF对心肌肥大细胞模型的影响。研究的结果丰富了肥厚型心肌病分子调控模式。同时,lncRNA TNRC6CAS1,miR-30c-1-3p和BPTF作为潜在的肥厚型心肌病致病分子,有望成为新的检测和治疗靶点。
1 材料与方法
1.1 公共数据库选择
本研究从 GEO数据库中下载研究号为GSE130036和GSE36946的RNA测序数据集。其中,GSE130036数据集包含28位肥厚型心肌病患者和9位健康志愿者心肌组织的mRNA和lncRNA数据表达谱,GSE36946 包含107位肥厚型心肌病患者和20位健康志愿者心肌组织的miRNA数据表达谱。
1.2 肥厚型心肌病患者的纳入和排除标准
(1)超声心动图检测左心室心肌某节段或多个节段室壁厚度≥15 mm。(2)超声心动图检测室壁增厚程度为 13~14 mm,合并家族病史,心肌室壁厚度包括左心室壁厚度或其他节段心室肌厚度≥13 mm,无法用其他疾病或病因解释;(3)排除主动脉狭窄和先天性心血管疾病、代谢性疾病以及运动员的心肌肥厚、代谢性疾病等引起的继发性心肌肥厚。本项目所用临床样本为血液废弃物(健康体检者和患者血常规剩余全血)。整个实验过程和方案已经取得昆明医科大学附属延安医院伦理委员会的审查批准。
1.3 试剂及相关试剂盒
细胞培养基1640(cat. no. 31870082; Thermo Fisher Scientific, Inc.);胎牛血清 (cat.no.10099141; Thermo Fisher Scientific, Inc.);青霉素-链霉素溶液(cat.no.C0222; 碧云天生物有限公司);血管紧张素II(cat.no.A9290;北京索莱宝科技有限公司);转染试剂Lipofectamine(cat.no.18324020; Thermo Fisher Scientific, Inc.);RNA提取试剂盒(cat.no.12183018A;Thermo Fisher Scientific, Inc.);EasyScript First-Strand cDNA Synthesis Super Mix反转录试剂盒(cat.no.AE301-02;北京全式金生物技术公司)和TransStart Tip Greenq PCR SuperMix试剂盒(cat.no.AQ142-11;北京全式金生物技术公司);心钠肽(natriuretic peptide A,ANP), 脑钠肽(natriuretic peptide B,BNP)和 β-肌球蛋白重链(β-Myosin Heavy Chain,β-MHC)ELISA试剂盒(cat.no.EIAANP, EHNPPB; Thermo Fisher Scientific, Inc;cat.no.kt98804, 武汉默沙克生物科技有限公司);一抗BPTF,β-MCH,β-肌动蛋白(β-actin)(cat.no.ab288159,ab170867,ab8226;Abcam Inc.), 心钠肽,脑钠肽(cat.no.702539,PA5-96084;Thermo Fisher Scientific, Inc);miR-30c-1-3p mimics (cat.no.4464066; Thermo Fisher Scientific, Inc.);ECL发光试剂盒(cat.no.P0018S;碧云天生物技术公司);TNRC6C-AS1 siRNA (cat.no.1299001; Thermo Fisher Scientific, Inc.);BPTF siRNA(cat.no.4392420;Thermo Fisher Scientific, Inc)。引物合成见Table 1(上海生工生物工程有限公司)。

Table 1 Quantitative RT-PCR primer sequences
1.4 主要仪器
实时定量PCR仪(AppliedBiosystems,Inc);细胞培养箱(上海一恒科学仪器有限公司);微量紫外分光光度计(Thermo Fisher Scientific, Inc.),凝胶成像分析系统(Bio-Rad Laboratories)等。
1.5 AC16细胞培养和处理
以正常人心肌体外细胞系 AC16 细胞作为模型。AC16细胞在1640培养基下培养,培养基包含10%胎牛血清和双抗(终浓度10 U/mL青霉素和0.1 mg/mL链霉素)。AC16细胞在37 ℃,5% CO2的无菌培养箱内培养。以Lipofectamine作为转染试剂,对AC16细胞转染miR-30c-1-3p mimics ,提高AC16细胞miR-30c-1-3p的表达水平。对AC16细胞转染TNRC6C-AS1 siRNA或BPTF siRNA,用于沉默AC16细胞的TNRC6C-AS1或BPTF表达水平。利用150 nom/L血管紧张素II处理AC16细胞24 h,进行心肌肥大细胞模型造模。检测心肌肥大标志物心钠肽, 脑钠肽和 β-肌球蛋白重链的mRNA和蛋白质表达,对病理模型进行验证。
1.6 生物信息学方法对核心mRNA,lncRNA和miRNA的筛选
首先下载数据库GEO数据库研究号为GSE130036和GSE36946的RNA测序数据集。利用R语言中的limma包进行差异分析(P<0.01,FDR<0.05, log2fold-change>2.0 或 log2fold-change<0.5),筛选出差异表达的mRNA,lncRNA和miRNA,同时利用ggplot和pheatmap包进行可视化。利用R语言中的clusterprofiler包对差异mNRA进行生物功能富集分析,即基因本体(Gene Ontology,GO)及京都基因和基因组百科全书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。根据富集的条目数及P值,进一步筛选核心mRNA。
1.7 ceRNA网络构建
通过TargetScan(http://www.targetscan.org/vert_71/)对能够靶向结合BPTF的miRNA进行预测,通过LncBase v2(http://carolina.imis.athena-innovation.gr/diana_tools/web/index.php?r=lncbasev2/index-predicted)对能够靶向差异表达lncRNA的miRNA进行预测。将上述二者得到miRNA分别与差异表达的miRNA取交集,获得miRNA-mRNA和miRNA-lncRNA调控网络。将miRNA-mRNA和miRNA-lncRNA调控网络进行整合,并通过Cytoscape_v3.7.1进行可视化,从而形成lncRNA-miRNA-mRNA ceRNA调控网络。
1.8 RNA提取及实时定量PCR
利用总RNA提取试剂盒对肥厚型心肌病患者外周血,健康体检者外周血,处理后的AC16细胞进行RNA提取,并测定RNA浓度及纯度。逆转录反应条件为:25 ℃反应10 min(miRNA省略),42 ℃反应30 min,85 ℃反应5 min。反应结束后,取2 μL PCR产物用DEPC水稀释至100 μL,作为qPCR的模板。qPCR反应条件为 95 ℃,10 min,1 循环(cycle);95 ℃ 15 s,60 ℃ 60 s,两者共40循环。反应结束后,导出各孔Ct值。GAPDH和U6作为内参基因。采用 2-ΔΔct法进行组之间mRNA,miRNA和lncRNA的表达差异分析。
1.9 免疫印迹分析
利用蛋白裂解液进行各组分蛋白质提取。利用BCA法对蛋白质浓度进行测定。取等量5 μg蛋白质,利用SDS-PAGE,对不同分子量的蛋白质进行分离。将蛋白质转移至聚偏二氟乙烯(PVDF)膜上,并在室温下,用封闭缓冲液封闭2 h。将PVDF膜与一抗孵育4 ℃过夜。一抗稀释浓度如下:心钠肽(1∶2 500),脑钠肽(1∶1 000),β-MHC(1∶2 000),β-肌动蛋白(1∶1 000)和染色质重塑因子(1∶1 000)。用Tris缓冲液和吐温20(TBST)洗涤膜3次,每次10 min。在室温下,与二抗孵育2 h。再次用Tris缓冲液和吐温20(TBST)洗涤膜3次,每次10 min。在黑暗中用ECL溶液孵育膜10 min,随后,在凝胶成像系统中成像。
1.10 酶联免疫吸附检测
将50 μL标准品,非特异性结合阴性对照和待测样本加入至酶标板内。向每孔加入75 μL 1×测定缓冲液和25 μL ANP,BNP或β-MHC结合物。向除阴性对照孔外的每个孔中,加入25 μL ANP,BNP或β-MHC抗体。轻微震动平板混匀液体,用密封纸覆盖平板,在室温下孵育1 h。将每孔液体去除,并用300 μL 1×洗涤缓冲液洗涤每孔4次,每次5 min。向每个孔中添加100 μL TMB反应液。在室温下孵育30 min,同时在摇床上进行轻微摇动。添加50 μL反应终止液,室温反应10 min,溶液颜色由蓝色变为黄色。用酶标仪在450 nm波长下进行吸光值的检测。
1.11 统计学分析
Statistical Product and Service Solutions(SPSS)软件用于数据统计学分析。所有实验至少重复3次以上,并以平均数±标准差的形式表现。t检验用于非配对两组之间的统计学差异。其中,P<0.05定义为有统计学意义。
2 结果
2.1 通过对GEO数据库分析发现,染色质重塑因子表达在肥厚型心肌病患者中明显上调
根据方法中限定阈值,筛选出表达差异明显的mRNA,miRNA和lncRNA。一共得到1 462个显著差异表达的mRNA。其中,在肥厚型心肌病组织中,上调的mRNA有428个,下调的mRNA有1 034;84个显著差异表达的 miRNA,其中在肥厚型心肌病组织中,上调的miRNA有46个,下调miRNA有38个;得到34个显著差异表达的lncRNA,其中在肥厚型心肌病组织中,上调的lncRNA有8个,下调的 lncRNA有26个;由于基因较多,本文选取了上调和下调最明显的30个mRNA进行热图绘制。差异mRNA,lncRNA和miRNA的热图、火山图见Fig.1A,B。其中,BPTF的表达在肥厚型心肌病组织中,明显上调(log2fold change=5.13),P值0.0000412。GEO数据中GSE130036子集的肥厚型心肌病患者临床信息汇总结果正如Table 2所示。
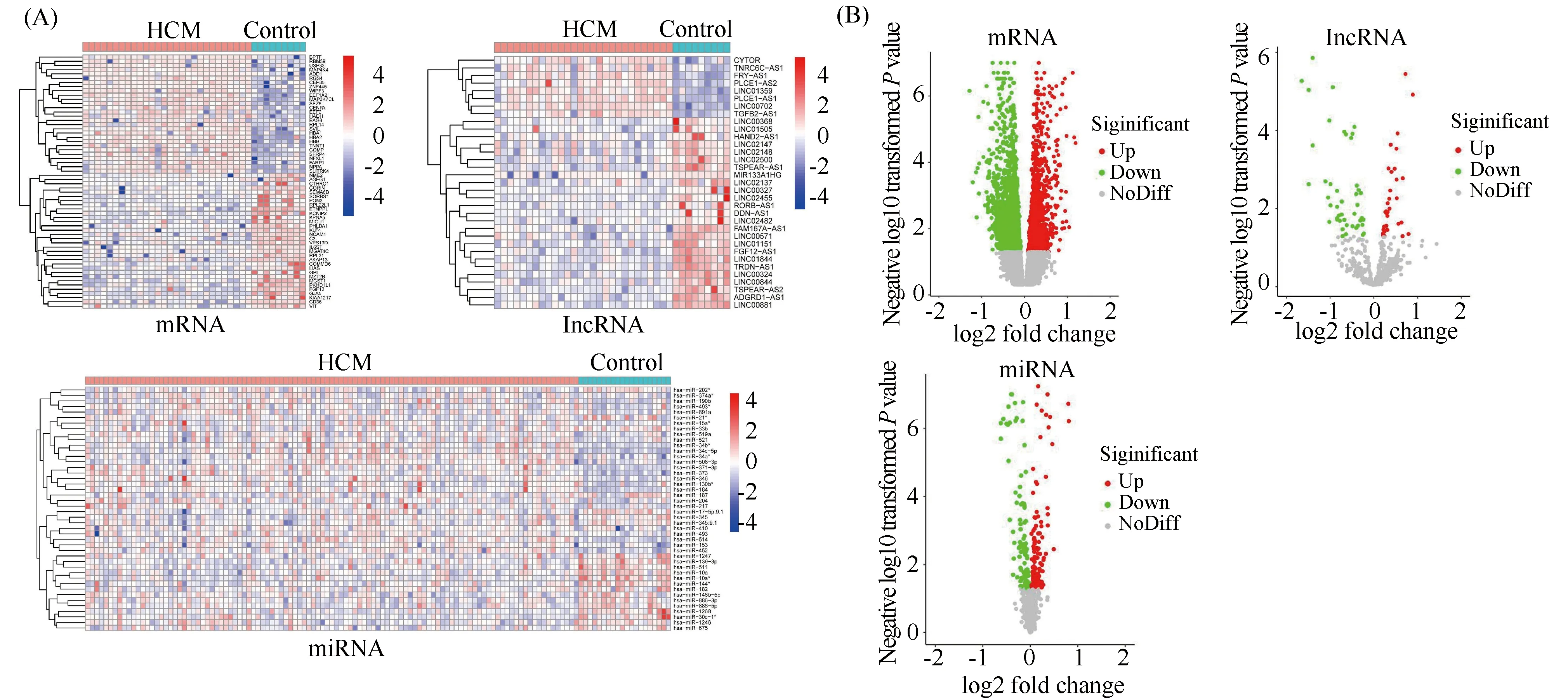
Fig.1 BPTF expression was significantly upregulated in patients with hypertrophic cardiomyopathy through the analysis of GEO database (A) Heatmap of differentially expressed mRNA, miRNA and lncRNA between HCM and normal tissues from GSE130036 or GSE36946 databases. Red represents up-regulated genes and blue represents down-regulated genes in HCM tissues. (B) Volcano plot. Gray represents non-differentially expressed genes, red represents up-regulated genes, and green represents down-regulated genes in HCM tissues. HCM: hypertrophic cardiomyopathy; NoDiff: no different; BPTF: bromodomain PHD finger transcription factor

Table 2 Summary of clinical information of HCM patients in GEO database (GSE130036)
2.2 基因本体(GO)及京都基因和基因组百科全书(KEGG)分析发现染色质重塑因子被多个条目富集
采用基因本体(GO)分析,将所有肥厚型心肌病相关差异mRNA归类到生物学过程(biological processes,BP),细胞组件(cell components,CC),分子功能(molecular function,MF)3种生物学关系中,取P值有显著意义的进行作图(见Fig.2A-C)。对差异基因进行京都基因与基因组百科全书(KEGG)分析结果正如Fig.2D。BPTF在所有差异基因中,被富集的相关条目最多,具体富集条目见Fig.2E。由于BPTF在肥厚型心肌病组织中明显上调,本文选择BPTF作为研究对象。

Fig.2 BPTF was enriched by multiple items through GO analysis and KEGG analysis (A-D) GO and KEGG analysis of differentially expressed mRNAs in HCM, including biological processes, cell components and molecular function. Dot size indicates the number of enriched genes; dot color represents the size of the P value. (E) BPTF enriched terms by GO analysis. BPTF: bromodomain PHD finger transcription factor; HCM: hypertrophic cardiomyopathy; GO: Gene Ontology; KEGG: Kyoto Encyclopedia of Genes and Genomes; BP: biological processes; CC: cell components; MF: molecular function
2.3 lncRNA TNRC6CAS1-miR-30c-1-3p-BPTF ceRNA调控网络的构建
围绕BPTF形成的ceRNA网络结果如Fig.3A所示。其中,lncRNA TNRC6C-AS1与BPTF关联的miRNA最多。本文选择lncRNA TNRC6C-AS1作为研究对象。根据ceRNA的理论,lncRNA通过竞争结合miRNA,减少miRNA对靶基因的抑制,表达趋势的特点显示,miRNA的表达趋势与lncRNA和mRNA相反,从结合位点显示,研究的miRNA应该与BPTF和 TNRC6C-AS1具备特异性结合。所以,本文进一步筛选关联miRNA。最后得到miR-30c-1-3p和miR-182-5p(Fig.3B)。本文选择miR-30c-1-3p作为研究对象,模拟了miR-30c-1-3p与BPTF和TNRC6C-AS1启动子的结合位点(Fig.3C)。
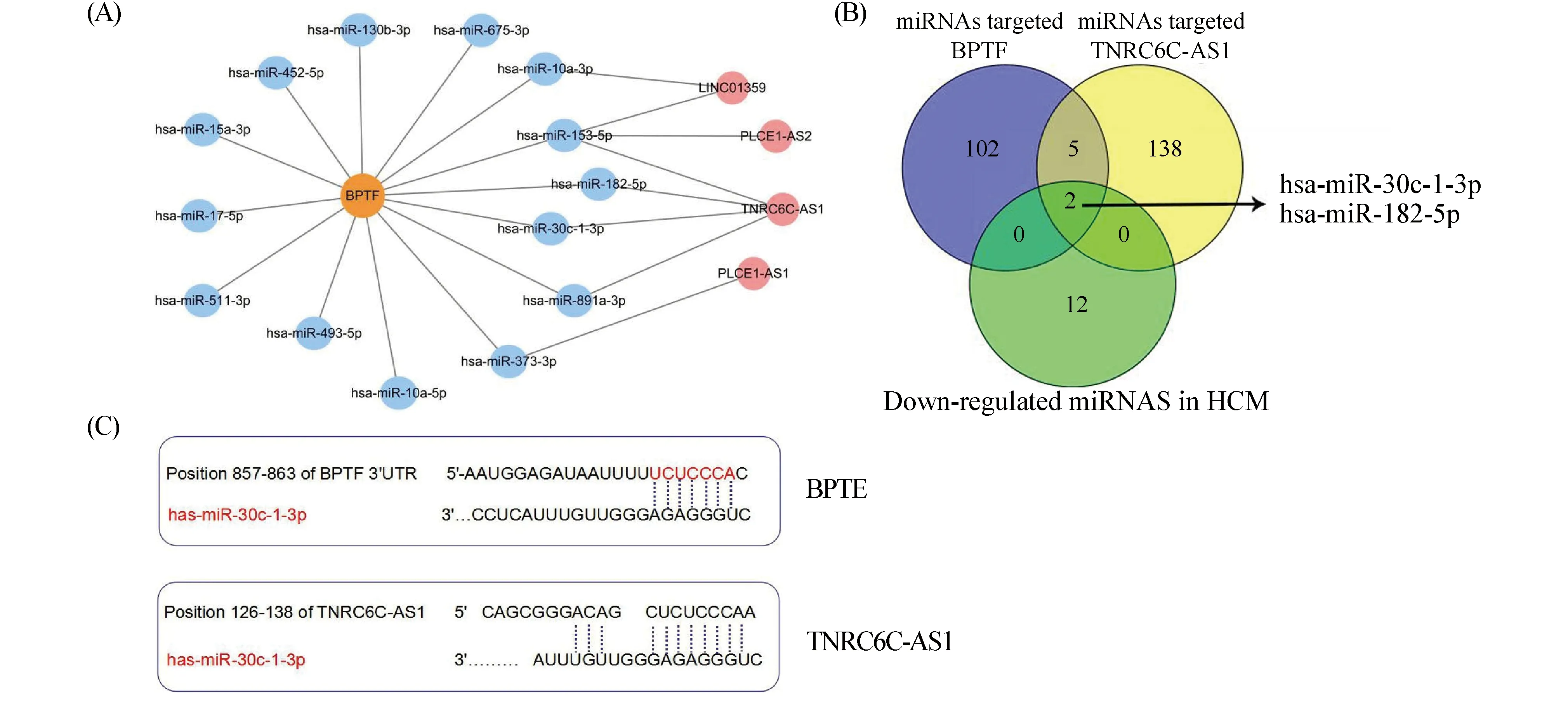
Fig.3 Construction of lncRNA TNRC6C-AS1-miR-30c-1-3p-BPTF ceRNA network (A) Construction of the ceRNA network around BPTF. Blue represents miRNA, orange represents mRNA and pink represents lncRNA. (B) Screening process of miR-30c-1-3p. (C) Binding sites of miR-30c-1-3p to BPTF and TNRC6C-AS1 promoters. BPTF: bromodomain PHD finger transcription factor
2.4 染色质重塑因子和长非编码RNA TNRC6CAS1在肥厚型心肌病患者中表达异常上调,而miR-30c-1-3p异常下调
正如Fig.4A所示,BPTF,miR-30c-1-3p和TNRC6C-AS1分别在GEO数据库中GSE130036或GSE36946 RNA测序数据集中的表达程度。从GEO测序数据中可以得出相较于正常组织,BPTF和TNRC6C-AS1在肥厚型心肌病患者组织中明显上调(P<0.001),miR-30c-1-3p在肥厚型心肌病患者的组织中明显下调(P<0.001)。本文利用RT-qPCR实验,利用收集的肥厚型心肌病患者和健康体检者外周血,进一步比较BPTF,miR-30c-1-3p和TNRC6C-AS1表达差异性。结果如Fig.4B所示,BPTF和TNRC6C-AS1的mRNA水平在肥厚型心肌病患者外周血中升高,分别是健康体检组的6.31±2.24倍(P<0.001)和3.51±1.62倍(P<0.001) 。miR-30c-1-3p在肥厚型心肌病患者外周血中表达下降是健康体检组的38.51%±16.20%(P<0.001)。HMC患者的临床信息汇总结果见Table 3。

Fig.4 Abnormal expression of BPTF, lncRNA TNRC6C-AS1 and miR-30c-1-3p in patients with hypertrophic cardiomyopathy (A) The expression of BPTF, miR-30c-1-3p and TNRC6C-AS1 in GSE130036 or GSE36946 RNA sequencing data sets, respectively. Each point represents an independent sample. Normal groups vs. HCM groups, ***P<0.001. (B) Expression of BPTF, miR-30c-1-3p and TNRC6C-AS1 in the peripheral blood of healthy subjects and patients with HCM using RT-qPCR assays. Normal groups vs. HCM groups, ***P<0.001. BPTF: bromodomain PHD finger transcription factor; HCM: hypertrophic cardiomyopathy

Table 3 Summary of clinical sample information of HCM patients
2.5 染色质重塑因子和长非编码RNA TNRC6CAS1在心肌肥大细胞模型中表达异常上调,而miR-30c-1-3p异常下调
血管紧张素II是诱导心肌细胞肥大模型的经典方法。本文用150 nmol/L血管紧张素II作用于AC16细胞24 h。结果正如Fig.5A所示,AC16细胞经过150 nmol/L血管紧张素II处理24 h,细胞蛋白质/DNA比值出现明显升高,是对照组的4.03±1.50倍(P<0.001)。结果正如Fig5B所示,RT-qPCR结果表明,心肌肥大标志物心钠肽、脑钠肽和β-肌球蛋白重链的mRNA水平明显升高,分别是对照组的4.80±1.68倍(P<0.05),2.68±0.13倍(P<0.001)和4.63±0.45倍(P<0.001)。结果正如Fig.5C,D所示,ELISA结果表明,心钠肽、脑钠肽和 β-肌球蛋白重链的蛋白质水平出现明显升高,分别是对照组的3.88±0.60倍(P<0.01),3.09±0.95倍(P<0.001)和3.49±0.31倍(P<0.001),Western 印迹结果趋势与ELISA结果一致。综上所述,利用血管紧张素II对AC16细胞进行心肌肥大诱导成功。

Fig.5 Abnormal expression of BPTF, lncRNA TNRC6C-AS1 and miR-30c-1-3p in the model of myocardial hypertrophy Myocardial hypertrophy model induced by Ang II in AC16 cells. (A) The cellular protein/DNA ratio in AC16 cells treated or non-treated with 150 nmol/L Ang II for 24 hours. Ang II groups vs Control groups, *P<0.05. (B) The mRNA expression of ANP, BNP and β-MHC was detected in AC16 cells treated or non-treated with 150 nmol/L Ang II for 24 hours using RT-qPCR assays. Ang II groups vs. Control groups, *P<0.05, ***P<0.001. (C-D) The protein expression of ANP, BNP and β-MHC was detected in AC16 cells treated or non-treated with 150 nmol/L Ang II for 24 hours using Western blotting or ELISA. Ang II groups vs. Control groups, **P<0.01, ***P<0.001. (E) RT-qPCR. RNA levels of BPTF, miR-30c-1-3p and TNRC6C-AS1. Ang II groups vs. Control groups, ***P<0.001. (F) RT-qPCR or Western blotting. The mRNA or protein expression of BPTF. Ang II groups vs. Control groups, ***P<0.001. BPTF: bromodomain PHD finger transcription factor; Ang II: Angiotensin II; ANP: natriuretic peptide A; BNP: natriuretic peptide B; β-MHC: β-Myosin Heavy Chain. ELISA: Enzyme-linked immunosorbent assay
本文进一步在建立的心肌肥大细胞模型中检测BPTF,miR-30c-1-3p和TNRC6C-AS1的表达变化。结果正如Fig.5E,F所示,RT-qPCR结果表明,BPTF和TNRC6C-AS1的表达水平在心肌肥大细胞模型中出现上调,分别是对照组的7.45±0.68倍(P<0.001)和6.15±1.14倍(P<0.001),miR-30c-1-3p的表达在心肌肥大细胞模型组中出现下调是对照组的27.02%±2.88%(P<0.001)。Western 印迹结果表明,BPTF蛋白表达在心肌肥大细胞模型中同样出现上调。综上所述,本文在心肌肥大细胞模型中再次验证了BPTF和TNRC6C-AS1表达的上调,miR-30c-1-3p表达的下调。
2.6 染色质重塑因子的表达与长非编码RNA TNRC6CAS1构成正向关系,与miR-30c-1-3p构成负向关系
本文对AC16细胞转染miR-30c-1-3p mimics,转染后miR-30c-1-3p的表达提高是对照组的6.05±0.79倍(P<0.001, Fig.6A)。对AC细胞转染TNRC6C-AS1 siRNA,转染后TNRC6C-AS1的表达下降是对照组的13.59%±4.51%(P<0.001, Fig.6B)。结果发现,AC16细胞过表达miR-30c-1-3p或沉默TNRC6C-AS1后,BPTF的mRNA表达都会出现下调,分别是对照组的41.12%±3.20%(P<0.001)和66.67%±5.41%(P<0.001),蛋白质表达同样出现下降(Fig.6C,D)。这些结果表明,TNRC6C-AS1的表达与BPTF的表达构成正向关系。miR-30c-1-3p的表达和BPTF的表达构成负向关系。

Fig.6 The expression of BPTF has a positive relationship with lncRNA TNRC6C-AS1 and a negative relationship with miR-30c-1-3p The AC16 cells were transfected with miR-30c-1-3p mimics, TNRC6C-AS1 siRNA and the corresponding negative control. (A) The expression of miR-30c-1-3p was detected in AC16 cells transfected with miR-30c-1-3p mimics or the negative control using RT-qPCR. negative control groups vs. miR-30c-1-3p mimics groups, *** P<0.001. (B) The expression of TNRC6C-AS1 was detected in AC16 cells transfected with TNRC6C-AS1 siRNA or the negative control using RT-qPCR; negative control groups vs. TNRC6C-AS1 siRNA groups, *** P<0.001. (C, D) The mRNA expression of BPTF was detected in AC16 cells transfected with TNRC6C-AS1 siRNA, miR-30c-1-3p mimics or the negative control using RT-qPCR; negative control groups vs. miR-30c-1-3p mimics groups, *** P<0.001; negative control groups vs. TNRC6C-AS1 siRNA groups,*** P<0.001. NC: negative control; BPTF: bromodomain PHD finger transcription factor
2.7 沉默染色质重塑因子,长非编码RNATNRC6C-AS1或过表达miR-30c-1-3p可以抑制心肌肥大标志性蛋白质表达
利用150 nmol/L 血管紧张素II处理AC16细胞24 h后诱导心肌肥大,同时转染TNRC6C-AS1siRNA,BPTF siRNA或miR-30c-1-3p mimics. 结果正如Fig.7A和B所示,AC16细胞心肌肥大模型沉默TNRC6C-AS1,BPTF或过表达miR-30c-1-3p后。Protein/DNA比值出现明显下降,分别是对照组的75.86%±4.22%(P<0.001),64.34%±4.84%(P<0.001)和63.19%±10.54%(P<0.001)。心肌肥大标志性蛋白质心钠肽、脑钠肽和β-肌球蛋白重链出现明显下降。以上结果表明,沉默BPTF,TNRC6C-AS1或过表达miR-30c-1-3p可以抑制心肌肥大标志性蛋白质表达。

Fig.7 Silencing BPTF, TNRC6C-AS1 or overexpressing miR-30c-1-3p could inhibit the expression of cardiac hypertrophy marker proteins (A) The protein/RNA radio was detected in Ang II-induced AC16 cells transfected with miR-30c-1-3p mimics, TNRC6C-AS1 siRNA, BPTF siRNA or the negative control. negative control groups vs. miR-30c-1-3p mimics groups, *** P<0.001; negative control groups vs.TNRC6C-AS1 siRNA groups, *** P<0.001; negative control groups vs. BPTF siRNA groups,*** P<0.001. (B) The protein expression of ANP, BNP and β-MHC was detected in Ang II-induced AC16 cells transfected with miR-30c-1-3p mimics, TNRC6C-AS1 siRNA, BPTF siRNA or the negative control. BPTF: bromodomain PHD finger transcription factor; Ang II: Angiotensin II; ANP: natriuretic peptide A; BNP: natriuretic peptide B; β-MHC: β-Myosin Heavy Chain
3 讨论
肥厚型心肌病是一种原发性心肌病,以心肌细胞肥厚作为主要特征,表现出特有的家族遗传性,为染色体显性遗传[15, 16]。绝大多数的肥厚型心肌病患者难以发觉。发病时多为突发性,表现为呼吸困难,胸痛、头晕和心悸等,严重者会导致心力衰竭,甚至猝死[17]。现今,发现与肥厚型心肌病发生发展的致病基因有20个以上,其中有多达1 400个突变位点, 相关的miRNA也有接近20个突变位点[18, 19]。但是,关于ceRNA网络调控在肥厚型心肌病发生发展中作用的报道很少。Yuan等[20]报道,lncRNA CYTOR通过miR-155及其下游IKKi和NF-κB信号通路,在心肌肥厚中发挥保护作用。lncRNA CYTOR在整个调控过程中作为miR-155的ceRNA,以竞争miR-155介导的IKBKE(Inhibitor of nuclear factor kappa B kinase subunit epsilon)表达抑制。Guo等[21]通过生物信息学分析,构建了包含6个CircRNA、29个miRNA和6个mRNA的ceRNA网络。通过功能分析发现,这些ceRNA网络中的环状RNA与钙释放通道活性和肌丝滑动有关。同时,提出了hsa_circ0043762、hsa_circ0036248和hsa_circ0071269可能是参与肥厚型心肌病发病机制的关键调节因子。虽然肥厚型心肌病在分子研究方面取得了一定的成果,但要完全将这些分子作为诊断和治疗肥厚型心肌病的新分子靶标,仍需要进一步明确其作用机制以及分子之间是如何网络调控的。
BPTF(bromodomain PHD finger transcription factor)作为染色质重塑复合体的最大亚基,在DNA表观遗传学上的调节尤为明显,可以引起多种基因和信号通路的异常。关于BPTF与疾病的关联更多的是集中在癌症的发生机制中。Richart等[22]报道,通过生物信息学技术发现,BPTF可以对cMYC的转录有明显的驱动作用。通过沉默BPTF可以使胰腺腺泡细胞癌的增殖受到抑制,延长病人的生存期,BPTF可以作为潜在的癌症治疗靶点。Ding等[23]报道, circ DONSON定位于细胞核,将NURF复合物SNF2L(SNF2L chromatin remodeling protein), BPTF 或RBBP4(Retinoblastoma binding protein 4)招募到SOX4(SRY-box transcription factor 4)启动子,并启动其转录,促进体内胃癌细胞的生长。有其他研究报道,BPTF在肝癌和肺癌等癌症治疗中也有显著的影响[24, 25]。迄今为止,BPTF在肥厚型心肌病的发展中的精确功能和分子机制仍然知之甚少。
本研究通过生物信息学方法发现,BPTF在肥厚型心肌病患者心肌组织中异常高表达,并在临床样本中进一步验证其表达上调。以BPTF为核心的mRNA,以及明显差异表达的miRNA和LcnRNA构建了lncRNA TNRC6CAS1-miR-30c-1-3p-BPTF的ceRNA调控网络,并初步验证了三者的表达相关性。最后,初步验证了lncRNA TNRC6CAS1,miR-30c-1-3p和BPTF对心肌肥大细胞模型的影响。文章不足之处在于,Ang II诱导的心肌肥大无法代表肥厚型心肌病模型,只能模拟肥厚型心肌病引起的心肌肥大病理现象。在后续的研究中,我们也会引入肥厚型心肌病动物模型,更加深入地对发病的调控分子机制进行研究。
综上所述,我们的研究得出结论,lncRNA TNRC6CAS1-miR-30c-1-3p-BPTF作为潜在的致病基因,可能参与调控了肥厚型心肌病心肌肥大病理现象的产生。同时,lncRNA TNRC6CAS1,miR-30c-1-3p和BPTF作为潜在的肥厚型心肌病致病分子,有望成为新的检测和治疗的靶点。

