心肌成纤维细胞来源的外泌体miRNA参与放射性心肌纤维化损伤
段依璠, 顾 静, 舒亚妃, 韩晓斐,5), 梁乾坤
(1)甘肃中医药大学基础医学院, 兰州 730000;2)天津医科大学第二医院血液内科, 天津 300000;3)甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室, 兰州 730000;4)甘肃省中医方药挖掘与创新转化重点实验室, 兰州 730000;5)甘肃省中医药防治慢性疾病重点实验室, 兰州 730000)
放射性心血管损伤(radiation-induced heart damage,RIHD)是胸部肿瘤放疗的常见并发症,其主要病理改变是心肌纤维化[1, 2]。心肌成纤维细胞(cardiac fibroblasts,CFs)是纤维化病变的主要效应细胞,损伤刺激时可增殖活化,并分泌转化生长因子-β(transforming growth factor-β,TGF-β)、胶原纤维(collagen,Col)等促纤维化因子,引起组织器官纤维化[3]。TGF-β与纤维化关系密切。已有研究证实,TGF-β1/smads信号通路在放射性心肌纤维化(radiation-induced cardiac fibrosis,RICF)中发挥重要作用[4, 5]。
放射性心血管损伤中纤维化病变机制尚不完全清楚,近年来有研究表明,它的发生可能与外泌体介导的辐射旁效应有关[6]。外泌体是细胞受刺激或活化时分泌的一种微囊泡,通过自分泌、旁分泌等方式作用于靶细胞[7, 8]。外泌体包含了包括microRNA(miRNA)在内的大量信息分子。miRNA是一类具有重要调控功能的微小RNA,属于非编码RNA(non-coding RNAs),长度约22个核苷酸左右[9],被公认为是多细胞生物基因表达转录后水平调控的一种方式,这种调控主要是通过与特定mRNA的-3′端非翻译区结合,引起mRNA降解或抑制蛋白质的翻译来调控基因表达[10]。miRNA已被证明可能调节30%以上的蛋白质基因表达,参与许多重要的生命过程,并涉及多种疾病。
研究证明,外泌体携带的miRNA在组织器官纤维化发展中发挥重要的作用[11-13]。但相关于RICF和外泌体及其携带的miRNA的研究非常有限,故本研究提取受照射RCF分泌的外泌体,通过RNA-seq技术检测X射线照射对外泌体miRNA表达谱的影响,筛选差异表达的miRNA,并分析差异miRNA靶基因主要富集的信号通路,探讨辐射诱导的外泌体miRNA通过介导辐射旁效应在RICF病变进程中的可能的分子机制。
1 材料与方法
1.1 细胞
大鼠心肌成纤维细胞系(RCF)购自北纳生物公司,货号BNCC341875。
1.2 药物与试剂
无外泌体胎牛血清购自Biological Industries公司;胎牛血清、总RNA提取试剂盒、实时荧光定量PCR试剂盒、反转录试剂盒、CCK8检测试剂盒购自上海翊圣生物科技有限公司;辣根过氧化物酶羊抗兔IgG (HRP-Goat Anti Rabbit IgG)、大鼠GAPDH单克隆抗体、大鼠Ⅰ型胶原(Col-Ⅰ)单克隆抗体、大鼠TGF-β1单克隆抗体购自GeneTex公司;CD9、CD63、CD81抗体购自Abcam公司。
1.3 仪器设备
生物辐照仪(美国PrecisionX-Ray)、二氧化碳恒温培养箱(天津莱玻特瑞仪器设备有限公司)、美谷SpectraMax酶标检测仪(上海美谷分子仪器有限公司)、罗氏LightCycler96 PCR仪(Roche公司)、超速离心机(Hitachi公司)、透射电镜(Hitachi公司)、粒径分析仪(NanoFCM公司)、纳米流式检测仪(NanoFCM公司)。
1.4 细胞培养
RCF置于37℃、5% CO2及饱和湿度的培养箱中,用含10%胎牛血清、1%青链霉素混合液的高糖培养基培养细胞;用0.25%胰蛋白酶+0.02% EDTA 2 mL消化细胞,并加入完全培养基终止消化,轻轻吹打细胞后传代培养。
1.5 细胞照射
细胞照射在甘肃中医药大学生物辐照检测室进行,Precision X-Ray生物辐照仪照射,皮源距48 cm,剂量率2 Gy/min,按照0、1、2、3、4 Gy X射线辐射剂量完成照射,筛选出X射线不抑制细胞增殖活性又能显著促进TGF-β1和Ⅰ型胶原 mRNA表达的最大照射剂量,作为本实验X射线剂量。
1.6 CCK-8检测细胞增殖
用0,1,2,3,4,5 GyX射线照射细胞,然后分别于照射后6、12、24、48、72 h用CCK-8检测细胞活性。CCK-8还用于RCF与外泌体共培养时间和药物浓度筛选。
1.7 纤维化相关分子表达检测
1.7.1 RT-PCR 取0、1、2、3、4 GyX射线照射后48 h的细胞,提取总RNA,测定其浓度和纯度,经反转录得到cDNA,将引物(列于Table 1)加入PCR扩增体系,使用罗氏Light Cycler96实时检测分析PCR产物。此外,RT-PCR还用于验证miRNA的差异表达。

Table 1 Primers used in RT-PCR
1.7.2 Western印迹检测 提取细胞总蛋白质,变性并进行BCA蛋白质定量,SDS-PAGE凝胶电泳分离蛋白质,转膜后抗体孵育,曝光后ImageJ软件检测灰度值并分析。
1.8 外泌体的分离及鉴定
1.8.1 超速离心法分离外泌体 细胞密度生长到70%时,更换血清为无外泌体血清,按照筛选出的照射剂量(2 Gy)进行X射线照射后,继续培养48 h,收上清,细胞培养上清分别以4 ℃ 300×g,10 min、3 000×g,15 min、2 000×g,30 min、10 000×g,45 min离心,收集上清液。经0.45 μm滤膜过滤,收集过滤液,4 ℃ 100 000×g离心70 min并收集沉淀,以10 mL预冷的PBS重悬后,再次相同转速离心收集沉淀(外泌体),100 μL预冷PBS重悬外泌体保存于-80 ℃。
1.8.2 外泌体鉴定 透射电镜观察外泌体形态;NTA纳米粒子跟踪分析检测外泌体的粒径及浓度;纳米流式细胞仪检测CD9、CD63和CD81等外泌体表面标志性蛋白质。
1.8.3 文库构建及测序 提取外泌体总RNA,通过构建去核糖体链特异性文库和small RNA文库进行4种RNA的捕获,并使用Agilent Bioanalyzer2100评估文库质量,合格的文库应该有单一的峰,无接头。最后,用Illumina Novaseq6000测序平台进行测序。
1.8.4 生物信息学分析 fastq格式的原始数据首先通过perl脚本进行处理,去除接头序列,过滤掉低质量reads,获得可用于后续分析的clean reads;将比对到参考基因组上的reads与miRBase数据库中的miRNA前体及成熟体序列进行比对,统计各样本匹配上miRNA的详细情况,并预测其二级结构,将不能比对上Rfam和miRBase的sRNA比对到参考基因组上,截取其周围序列,使用miRDeep2软件进行二级结构预测。根据预测结果,利用Dicer酶切位点信息、能量值等特征进行过滤,鉴定出新的miRNA;对各样本中的miRNA进行表达量统计,并用TPM算法对表达量进行归一化处理,获得miRNA的Read Counts数。
1.8.5 miRNA差异表达分析 根据各样品中miRNA的Read Counts数,采用edgeR程序对miRNA进行差异表达分析。并按照表达量倍数差异(∣log2Fold Change∣>1)和表达差异显著性(P<0.05)筛选出差异表达的miRNA。
1.8.6 靶基因预测 通过3个miRNA靶基因预测软件targetScan、miRWalk、miRNADB对差异表达的miRNA序列进行靶基因预测。
1.8.7 GO及KEGG富集分析 使用DAVID数据库进行基因本体(GeneOntology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析:找出差异表达倍数(∣log2Fold Change∣>2)的miRNA的靶基因显著富集的功能及通路(显著富集的标准为P<0.05)。
1.9 统计学方法
2 结果
2.1 X射线照射大鼠心肌成纤维细胞的剂量筛选
2.1.1 细胞增殖活性 X射线照射RCF后生长曲线正如Fig.1:对照组(0 Gy)显示,随着细胞培养时间延长,细胞增殖速度变慢。与对照组(0 Gy)相比,1、2 GyX射线照射RCF后12 h,细胞增殖率分别增加了6.2%、5.9%(均P<0.01);2Gy照射72 h,RCF增殖率对比0 Gy组降低5.9%(P<0.05)。较大剂量3、4和5 Gy照射后,对细胞增殖有抑制作用。结果说明1、2 GyX射线在6~12 h可促进RCF增殖,照射后48~72 h,随着时间延长,促增殖作用逐渐减弱,对照组和各照射组增殖速度差异变大。在照射后72 h,2 Gy照射组出现增殖抑制作用,48 h可能是细胞增殖能力的转折点,3、4和5 Gy等较大照射剂量对细胞增殖能力影响较大。基于实验结果,本文初步筛选1、2 Gy为X射线照射RCF的剂量,照射后48 h为指标检测时间点。

Fig.1 Effect of different doses of X-ray irradiation on RCF proliferation rate CCK-8 method was used to detect the proliferation of RCF cells at different time points after irradiation with different doses of X-ray. The cell growth curve was drawn with time as the horizontal axis and light absorption value (A) as the vertical axis. Based on the experimental results, 1 Gy and 2 Gy were preliminarily selected as the doses of RCF irradiated by X-ray, and 48 hours after irradiation was the index detection time point. 0 Gy group was used as the control group,*P<0.05,**P<0.01 vs.0 Gy. n=18
2.1.2 纤维化相关分子表达 为了验证X射线照射对RCF的促纤维化效应,用0、1、2、3、4 Gy X射线照射RCF后48 h检测纤维化相关分子(TGF-β1和Col-Ⅰ)的表达,结果显示(Fig.2):2 Gy照射后TGF-β1的mRNA表达增加了40.0%,与对照组相比差异具有显著性(P<0.01),其余各组差异无统计学意义;1 Gy和2 Gy组Ⅰ型胶原的mRNA表达分别增加了8.7% (P<0.05)和33.5%(P<0.01),与对照组相比差异有统计学意义,3 Gy组Ⅰ型胶原的mRNA表达与对照组相比差异无统计学意义;4 Gy照射后,Ⅰ型胶原的mRNA表达与对照组相比降低了11.9%(P<0.01)。以上结果证明,2 Gy X射线照射细胞有促纤维化效应,但随着照射剂量增加达到4 Gy 时,TGF-β1和Ⅰ型胶原表达反而减少,这可能是因为较高剂量X射线对细胞的损伤较严重导致细胞功能下降,纤维化分子表达反而受抑制。

Fig.2 Effects of different doses X-ray irradiation on RCF TGF-1 and Col-I mRNA RT-PCR was used to detect the pro-fibrotic effect of X-ray irradiation on RCF. The expression of fibrosis-related molecules (TGF-β1 and Col-Ⅰ) was detected 48 hours after irradiation with 0, 1, 2, 3, and 4 Gy of X-ray. The results showed that 2 Gy X-ray irradiation had a pro-fibrotic effect, but the expression of TGF-β1 and Col-Ⅰ decreased with the irradiation dose increase to 4 Gy. This may be because the higher dose of X-ray irradiation caused more serious damage to the cells, resulting in the decline of cell function, and the expression of fibrotic molecules was inhibited. *P<0.05,**P<0.01vs.0 Gy. n=3
为了确认筛选条件的促纤维化效果,本文在2 GyX射线照射RCF后48 h检测了TGF-β1和Ⅰ型胶原的蛋白质表达,结果显示(Fig.3):与0 Gy组相比,2 GyX射线照射RCF后48 hTGF-β1、Ⅰ型胶原蛋白质表达分别增加了38.1%、167.7%(P<0.01)。
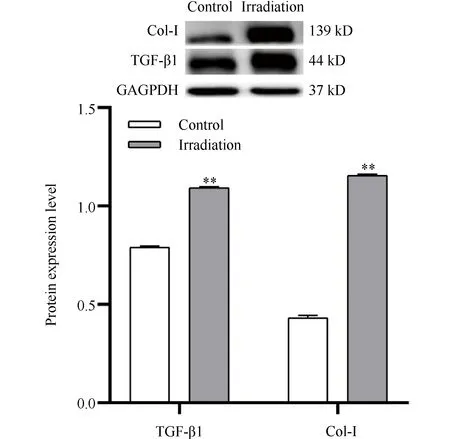
Fig.3 Expression changes of TGF-β1 and Col-Ⅰ proteins at 48 hours after 2 GyX irradiation of RCF Western blot was used to detect the protein expression. The results showed that the protein expression of TGF-β1 and Col-Ⅰ increased at 48 hours after 2 Gy X-ray irradiation. This indicates that 2 Gy X-ray irradiation can induce obvious pro-fibrotic changes in RCF after 48 hours. **P<0.01 vs. Control (0 Gy). n=3
通过细胞增殖活性和纤维化分子Ⅰ型胶原、TGF-β1表达的检测表明:2 GyX射线照射RCF48 h,细胞发生了明显的促纤维化改变,可以作为诱导RCF促纤维化损伤的X射线干预条件,“2 Gy X射线照射RCF后48 h”作为本文提取外泌体的实验条件。
2.2 外泌体的提取及鉴定
倒置显微镜观察到RCF是贴壁细胞,呈不规则梭形,以下是0 Gy对照组(Control组)和2 Gy照射组(Irradiation)RCF的镜下形态(Fig.4)。
用超速离心法提取Control组和Irradiation组外泌体,结果显示:透射电镜下,负染的大多数外泌体显示为50~150 nm杯状膜泡(Fig.5A)。纳米粒子跟踪分析(NTA)外泌体的浓度以及直径分布见Fig.5B,测得对照组的外泌体浓度为1.7×108/mL,平均粒径为75.28 nm;照射组外泌体浓度为4.78×107/mL,平均粒径为65.61 nm。纳米流式细胞术检测显示,外泌体特征性标志蛋白质(CD9、CD63和CD81)阳性。这些特征与外泌体的特点相符,鉴定为外泌体(Fig.5C)。
2.3 外泌体微RNA表达谱检测及差异分析
根据各样本中miRNA的表达量,将对照组、照射组的外泌体miRNA进行差异表达分析,并按照∣log2Fold Change∣(∣log2FC∣)>1和P<0.05筛选出差异表达的外泌体miRNA。采用R语言软件包绘制差异表达的外泌体miRNA火山图(Fig.6 ,Volcanic map)和聚类热图(Fig.7,Cluster analysis)。火山图展示显著性差异表达外泌体miRNA的结果(∣log2FC∣>1,P<0.05),直观了解差异表达miRNA上调和下调情况。2组中差异表达的外泌体miRNAs有28个(∣log2FC∣>1,P<0.05),其中照射组表达上调的外泌体miRNAs 9个,表达下调的19个。上调的外泌体miRNAs中∣log2FC∣>2的共8个,下调的外泌体miRNAs中∣log2FC∣>2的共12个,2组筛选的∣log2FC∣>2的外泌体miRNA见Table 2。
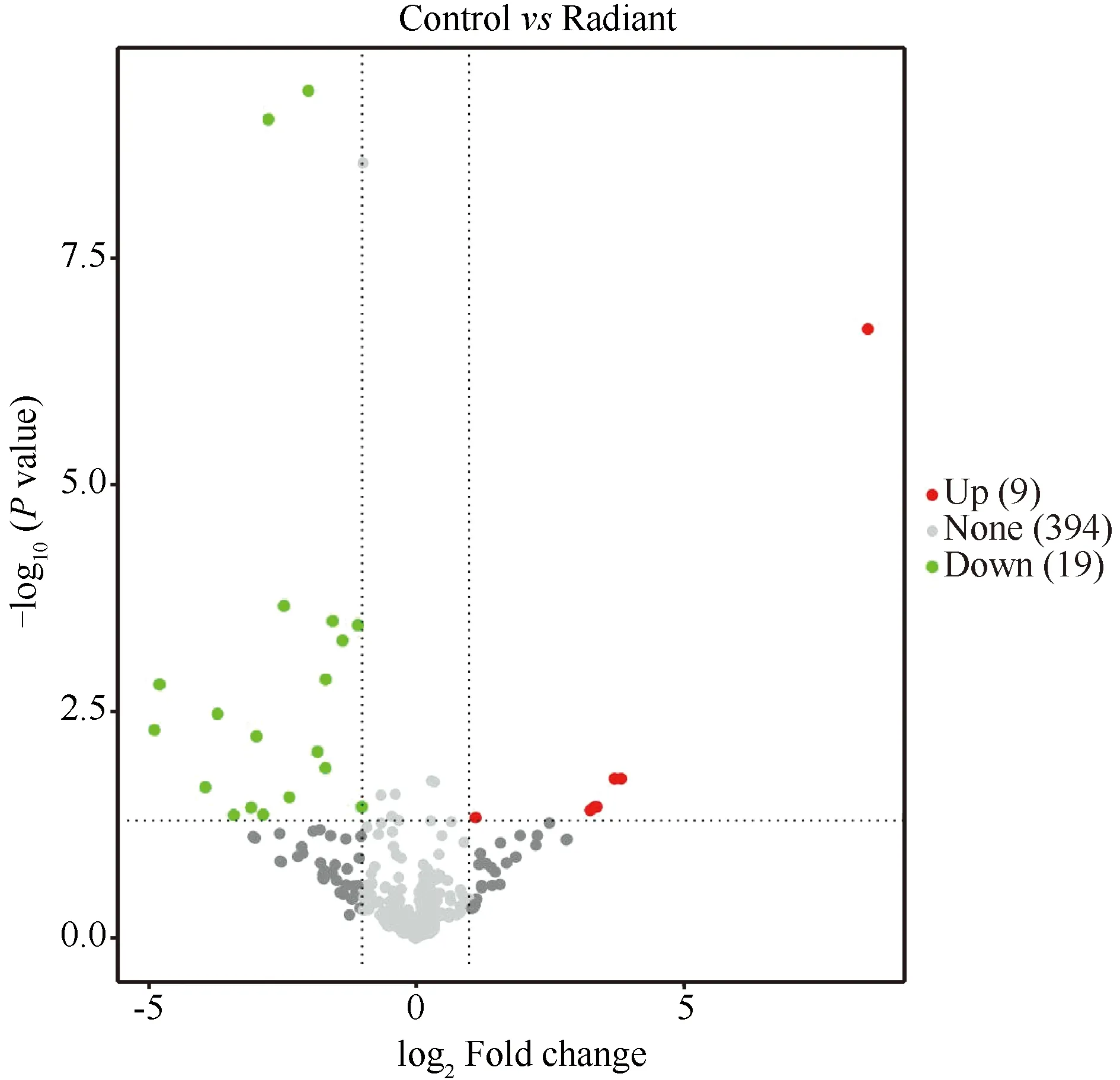
Fig.6 Volcanic map of known exosomal miRNAs differentially expressed between the two groups Volcano diagram using R software shows the significantly differentially expressed microRNAs (∣ log2 FC ∣ > 1, P < 0.05). Abscissa for∣log2 FoId Change∣, ordinate for -log10 (P-value), horizontal dotted line as the P=0.05 threshold. Red dots represent up-regulated miRNAs in this group, green dots represent down-regulated miRNAs in this group, and gray dots represent non-significantly differentially expressed miRNAs

Fig.7 Cluster analysis of miRNA of known exosomes with differential expression between the two groups R software was used to draw the cluster heat map of differentially expressed miRNAs. Each row in the figure represents the expression level of a miRNA in each sample. Each column represents the expression level of each miRNA in a sample, and its chromatic aberration represents the relative expression level of miRNA. From green to red, representing the expression level from low to high. The left is the cluster feature tree of miRNA, and the upper is the cluster feature tree of the sample

Table 2 miRNAs were differentially expressed in the control group and the irradiation group(∣log2 FC∣>2, P<0.05, n=3)
此外,本文选择了受照射细胞外泌体中2个表达上调的miRNA分子(miR-483-5p、miR-212-3p)和2个表达下调的miRNA分子(miR-216a-5p、miR-217-5p)进行qRT-PCR验证。2 Gy X射线照射RCF后48 h,收集细胞分泌到培养液中的外泌体,提取外泌体RNA,qRT-PCR验证。结果显示,这4个miRNA分子的差异表达均得到证实(Table 3)。

Table 3 Differentially expressed miRNA in exosomes were confirmed by qRT-PCR analysis (n=3)
2.4 差异微RNA靶基因预测及富集分析
通过miRNA靶基因预测软件(targetScan、miRWalk、miRNADB)对各差异miRNA进行靶基因预测,发现与对照组相比,照射组表达上调的miRNAs(∣log2FC∣>2,P<0.05)共同作用的靶基因有2 493个,表达下调miRNAs(∣log2FC∣>2,P<0.05)共同作用的靶基因有215个。对这些靶基因进行 GO及KEGG富集分析。
GO富集分析:Fig.8显示,排名前10的“生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)”。差异表达的miRNAs调控的靶基因主要参与蛋白质磷酸化、细胞信号传导等生物学过程,富集于细胞质和细胞膜等细胞成分,发挥蛋白激酶绑定和蛋白结合等分子功能。

Fig.8 GO enrichment analysis Using DAVID database to find out the significant enrichment functions of differentially expressed miRNA (∣log2 FC∣>2) target genes. According to the criterion of significant enrichment, P-value <0.05, the top ten items were selected for mapping and sorted according to the enrichment score. (A) Up-regulated differential miRNA target genes GO analysis of the top 10 Biological process, Cellular component and Molecular function. (B) Down-regulated differential miRNA target genes GO analysis of the top 10 Biological process, Cellular component and Molecular function
KEGG富集分析:Fig.9显示,富集最显著的前20个通路(pathway)。表达上调的miRNA靶基因主要富集的通路有:PI3K-Akt、MAPK、mTOR、ECM、cAMP、Wnt、TGF-β和Notch等信号通路(Fig.9A);表达下调的miRNA靶基因主要富集的通路有:MAPK、ECM、Ras、mTOR、PI3K-Akt、Rap1和AMPK 等信号通路(Fig.9B)。

Fig.9 KEGG enrichment analysis KEGG enrichment analysis was performed on up-regulated and down-regulated differential miRNAs (∣log2 FC∣>2, P<0.05) target genes using DAVID database, and the top 20 pathways with the most significant enrichment were selected according to the KEGG enrichment analysis. In the figure, the bubble size represents the number of enriched genes, and the difference in bubble color represents the enrichment degree of target genes. The criterion for significant enrichment was P <0.05. (A) KEGG enrichment analysis of up-regulated differential miRNA target genes. (B) KEGG enrichment analysis of different miRNA target genes with down-regulated expression
3 讨论
辐射诱发的心血管损伤是放疗的严重临床并发症[15]。其临床特点表现为心室弹性和扩张性降低,导致射血分数下降、心力衰竭甚至心源性猝死,损害癌症患者放疗后的长期健康,并限制有效杀死肿瘤细胞所需的放疗剂量和强度[16]。放射性心血管损伤尚无有效干预措施,因其主要病理基础是心肌的纤维化病理改变,如果能有效阻断其纤维化病变进程,则有可能改善放射性心血管损伤。研究发现,在纤维化发展过程中,细胞因子TGF-β1可以促进成纤维细胞增殖及细胞外基质的产生,进而促进纤维化的发生发展[17]。课题组前期研究发现,小剂量X射线不会引起细胞严重损伤,却有直接的促纤维化效应[18]。本实验旨在探讨“外泌体miRNA通过辐射旁效应在放射性心脏纤维化损伤中的分子基础”,应获得以“促进纤维化为目的”的受照射外泌体,所以实验中“受照射外泌体的X射线剂量筛选依据”是“能促进成纤维细胞增殖和纤维化因子高表达,但又不会明显抑制细胞活性的非致死X射线剂量”。基于以上本文仅设计了“0、1、2、3、4”5个X射线照射剂量,实际上前期预实验筛选中观察到随着X射线剂量增大(6、8、10 Gy)会显著抑制细胞生长和增殖,同时PCR检测相关纤维化因子TGF-β1和Ⅰ型胶原表达也明显降低,这可能与X射线剂量过大引起细胞严重损伤有关,即说明:较大剂量的X射线因严重损伤细胞不仅不会有促增殖纤维化的效应,反而会显著抑制细胞生长,随之相关纤维化因子表达降低,促纤维化效应也受抑。本文结果也表明,2 Gy的小剂量X射线在照射RCF后6~12 h可以促进细胞的增殖,3、4 Gy照射会抑制细胞增殖速率,且随着剂量逐渐增大,纤维化因子的表达出现先增高再降低的变化趋势。综上,本文选择“2 GyX射线照射RCF后48 h”作为提取外泌体的条件。
3.1 外泌体微RNA介导的辐射旁效应与放射性心肌纤维化
目前研究发现,约有150~200种miRNA在心血管细胞中表达,其中许多参与了心血管疾病的动态调节,包括辐射后的心血管损伤调节[19]。例如:miRNA-29家族靶向调节参与纤维化的多种胶原蛋白的mRNA,miR-29过表达可以减少胶原蛋白的合成,被TGF-β刺激后miR-29表达下调进而导致心肌纤维化[20];miR-15b通过抑制TGF-β信号通路调节心肌肥大和纤维化,照射后,miR-15b的表达被抑制进而促进了纤维化的发生发展[21];照射引起的心肌纤维化中上调的miR-21,通过调节生长因子分泌和心肌细胞外信号调节激酶(ERK)-MAPK信号通路,促进心肌肥大和心肌纤维化的发展[22]。
放射性心血管损伤中纤维化病变机制尚不完全清楚,近年来有研究表明,它的发生可能与外泌体介导的辐射旁效应有关[6]。辐射旁效应即肿瘤放疗引起的电离辐射除了直接损伤受照射的细胞,其周围未受照射细胞也发生一系列的损伤性改变,辐射旁效应可扩大辐射暴露对人体危害的时间与空间跨度,这更好的解释了辐射的迟发性损伤效应[23]。研究发现,辐射旁效应可能与电离辐射刺激细胞分泌的外泌体有关,外泌体由细胞通过胞吐作用分泌到细胞外环境中,然后通过与靶细胞膜融合将miRNAs等内容物释放入靶细胞,从而介导细胞间的信息传递[9]。外泌体携带的miRNA在组织器官纤维化发展过程中发挥重要作用,但相关于放射性心肌纤维化损伤的外泌体miRNA报道非常有限。本研究旨在探讨“外泌体通过其信号分子miRNA介导辐射旁效应参与放射性心肌纤维化的发生发展”,实验提取了受照射细胞来源的外泌体,检测其miRNA的差异表达作为介导辐射旁效应的分子基础,后续实验拟通过共培养的方式以“受照射成纤维细胞来源的外泌体干预未照射细胞”,观察外泌体miRNA介导的辐射旁效应对未照射细胞的影响。所以本文检测外泌体中的miRNA,而非直接对心肌成纤维细胞中的miRNA进行检测,目的在于关注外泌体miRNA介导的辐射旁效应在放射性心脏纤维化损伤中的作用。由于,外泌体参与到电离辐射旁效应的关键一步就是进入到旁效应细胞内,从而传递其携带的miRNAs等信号分子,为了进一步验证信号细胞产生的外泌体miRNAs是否会传递至旁效应细胞,谭雯等人的研究采用荧光标记追踪外泌体进入接收细胞的情况,并选取特定时间点检测旁效应细胞中目标miRNA的水平[24],课题组也将会在后续的研究中对关注的目标miRNAs进行类似方法的验证检测。
3.2 X射线对成纤维细胞外泌体微RNA表达谱的影响
基于以上结果,本研究运用RNA-seq技术全面系统测序分析了X射线辐射诱导的外泌体中miRNA表达谱的变化,结果显示,差异表达的miRNAs中上调表达的miRNAs∣log2FC∣>2共8个,下调表达的miRNA∣log2FC∣>2的共12个。国内外文献梳理发现,目前这些差异表达的miRNAs在放射性心肌纤维化损伤研究中的报道较少,但在其他心血管疾病及器官纤维化研究中有报道,课题组重点关注了这些研究:(1)在差异表达上调的miRNAs的相关研究中①miR-212的心血管过表达可能导致心肌肥大,miR-212可能通过叉头框蛋白O3(Forkhead box protein O3,FOXO3)非依赖性机制在心肌肥大的发展中发挥作用[25]; ②miR-483-5p过表达显著增加了缺氧诱导的心肌细胞凋亡和氧化应激[26]; ③敲低miR-134-5p可限制心肌梗塞大鼠模型中的不良心肌重塑,表现为减轻心肌细胞肥大和纤维化[27];此外,miR-134在特发性肺纤维化中表达上调[28]。 ④miR-193不仅在肥厚型心肌病弥漫性心肌纤维化患者血清中上调[29],还是肝纤维化中细胞外基质基因TGF-β依赖性调节网络的一部分[30],miR-193在活化的肝星状细胞中的表达发生显著变化,调节肝纤维化的发生发展[31];(2)差异表达下调的miRNAs在纤维化的相关研究中主要表现为负向调控作用: ①miR-195通过负向调节TGF-β1/Smad3信号通路抑制大鼠心肌纤维化,当miR-195表达下调时,这种作用可能被抑制[32]; ②miR-122负调控骨骼肌纤维化中的TGF-β/Smad信号通路,miR-122的过表达可以延缓纤维化进程[33]。由于这些差异表达的外泌体miRNAs与放射性心肌纤维化关系的研究鲜有报导,课题组后期将进行深入研究探索。
3.3 差异微RNA靶基因富集通路与心血管纤维化
miRNA靶基因数据库显示,一种miRNA可能调节多个靶基因,而一种基因还可能被多个miRNAs靶向调节,即miRNA与其靶点之间的关系比较复杂,可能并不是一对一的[34]。本研究使用DAVID数据库对差异表达miRNA的靶基因进行通路富集分析,富集到PI3K-Akt、MAPK、mTOR、ECM-receptor interaction、cAMP、Wnt、TGF-β和Notch等信号通路。与本文筛选出的信号通路相关的研究表明:(1)cAMP依赖性信号传导与CFs活化和ECM合成有关[35];β-肾上腺素能通过cAMP/Rap1/Rac/细胞外信号调节激酶通路,直接激活的cAMP/EP发挥心,血管保护作用[36]。(2)有趣的是,MAPK信号通路既是上调表达miRNA也是下调表达miRNA靶基因富集到的信号通路,文献表明,重要信号节点P38-MAPK可调节CFs功能的多个方面,包括炎症反应、肌成纤维细胞分化、细胞外基质转换和心肌细胞肥大的旁分泌诱导[37]。有实研究证明,沉默Ctgf使MAPK信号通路失活,可以减轻扩张型心肌病大鼠的心肌纤维化和左心室肥大[38]。(3)成纤维细胞特异性TGF-β-Smad2/3信号传导更是心血管纤维化的基础,典型的TGF-β信号转导通过促进基因表达来控制纤维化的Smad2、Smad3转录因子[39]。(4)研究证明,PI3K/Akt信号通路通过调节细胞存活,参与调控心血管纤维化的发生、发展和病理形成[40]。(5)AMP活化蛋白激酶(AMP-activated Protein Kina,AMPK)是一种细胞能量传感器,是对缺血期间发生的心肌细胞应激的适应性反应的重要组成部分,研究发现,它在调节心肌纤维化方面具有重要作用[41]。此外,miRNAs也可通过靶向调节Wnt[42]、Notch[43]、Ras[44],和Rap1[45]等信号分子也参与心血管损伤及纤维化病变。以上这些研究结合本课题筛选的信号通路表明,差异表达的外泌体miRNA可能会通过调节靶基因及相关信号通路引起放射性心肌纤维化的发生发展,但其作用机制及各差异表达miRNA与各通路之间正、负调控的关系仍有待课题组后期验证。
生信分析富集到的信号通路仅作为预测,本研究中差异表达的miRNA靶基因富集到的MAPK、PI3/AKT和mTOR等信号通路,主要是通过通路中关键分子磷酸化的级联反应而发挥细胞生理功能调节的,并非主要依靠转录水平的调控。而microRNA对基因的调控主要集中在转录水平[46],对蛋白质的磷酸化无太大意义。因此,在深入探讨“外泌体miRNA通过辐射旁效应参与放射性心血管纤维化损伤的机制”研究中,应该着重关注本研究生信分析富集到的ECM、cAMP、TGF-β、Wnt、Notch、Ras和Rap1等信号通路。
3.4 小结与展望
X射线照射可以诱使RCF外泌体miRNA表达谱发生变化。富集分析表明,差异表达的miRNA可能通过调控ECM、cAMP、TGF-β、Wnt、Notch、Ras和Rap1等信号通路中的某些通路,在放射性心血管纤维化损伤的发展过程中发挥作用,但其具体机制仍有待验证。此外,成纤维细胞向肌成纤维细胞转分化是组织器官纤维化的关键环节[47]。课题组后期将结合成纤维细胞转分化,通过基因转染等技术,深入分析本文差异表达的miRNA与相关信号通路在放射性心血管纤维化损伤过程中的具体机制,进一步探讨RIHD的可能干预思路。

