MnOx/Al2O3催化臭氧氧化处理含氰废水
王洪凯,董嘉宁,孙宏志,陈俊强,陈建设,韩 庆,李斌川
(1.辽宁新都黄金有限责任公司,辽宁 朝阳 122000;2.东北大学多金属共生矿生态化冶金教育部重点实验室;3.东北大学冶金学院,沈阳 110819)
含氰废水的处理一直是黄金企业关注的重点。根据国标规定[1],一般性企业排放的废水中氰化物的总量不能超过0.5 mg/L,而辽宁省地方标准中氰化物浓度要求低于0.2 mg/L。根据不完全统计,国内外的含氰废水处理技术已有20多种。早期的含氰废水处理方法主要有氯氧化法[2-4]、二氧化硫-空气法[5]、酸化回收法[6]、芬顿氧化法[7]、金属离子络合法[8]等。近年来相继开发了辐射法、超声波氧化法、超临界水氧化法、生物氧化法、光催化氧化法等新技术[9]。这些处理方法各有其特点。均相处理法适用于大规模的含氰废水处理,试剂与废水体系混合比较均匀,可加快反应速度,提高废水处理效率,但试剂与体系形成均相而不易分离,会造成二次污染;非均相处理法适用于处理低浓度的含氰废水,加入的试剂易于分离而不会造成二次污染。
非均相催化臭氧氧化技术通常是指催化剂与反应体系处于不同相,反应一般发生在气-液、气-固、液-固或气-液-固的相界面上。其使用的催化剂多为固态,主要分为负载型催化剂和非负载型催化剂。常用的催化剂主要有分子筛[10]、活性炭[11]、硅藻土[12]、活性氧化铝[13]以及负载在载体上的金属及其氧化物。非均相催化臭氧氧化技术能够很好地将催化剂的吸附性、催化作用和臭氧的强氧化性结合起来,从而使废水处理效率大幅提高并降低处理成本[14]。本文以氰化浸金废水为目标污染物,研究了负载锰氧化物的活性氧化铝对含氰废水的处理效果。其间以废水中氰化物的去除率为依据,探索非均相催化臭氧氧化反应的最佳条件,并不断优化催化剂的性能和制备工艺参数,筛选出高效的氰化物处理催化剂。
1 试验
1.1 试验原料
硝酸锰溶液(浓度50%)、叔丁醇等试剂购自国药集团化学试剂有限公司,活性氧化铝(粒径3~5 mm)购自阿拉丁试剂(上海)有限公司。试验所用的含氰废水取自辽宁省某黄金冶炼企业。经过一系列常规处理后,废水的污染物浓度如表1所示。

表1 污染物浓度
1.2 试验装置与流程
气液固三相反应的试验装置如图1所示,主要包括臭氧发生部分、催化臭氧氧化反应部分和尾气吸收处理部分。臭氧发生部分由臭氧发生器、缓冲罐和气体流量计组成。臭氧发生器以空气作为气源来产生臭氧,缓冲罐有稳定气体流量和防止液体倒吸回流的作用,流量计的作用是通过改变进入反应器的气体流量从而控制臭氧浓度。催化臭氧氧化反应部分主要是自制的三相反应器,该反应器为内径45 mm、高300 mm的石英玻璃,内部可以装填反应所需的固态催化剂,底部装有曝气盘,可使臭氧在反应器内均匀分布。尾气吸收处理部分是采用浓度3%的KI溶液吸收反应器中未反应完全的臭氧,防止尾气中的臭氧对环境和实验室人员造成危害。

图1 非均相催化臭氧氧化试验装置
1.3 分析方法
采用德国布鲁克AXS有限公司生产的D8 ADVANCE型X射线衍射仪(XRD)对催化剂的物相进行表征,采用pH值移位法测定催化剂的电荷零点(pHzpc)。溶液中总氰化物的浓度以异烟酸-吡唑啉酮光度法测定,气相中的臭氧浓度以碘量法测定,液相中的臭氧浓度以靛蓝法测定。
2 结果与讨论
下面结合MnOx/Al2O3催化剂的表征,分析不同因素对废水中氰根去除率的影响,研究MnOx/Al2O3催化臭氧氧化的机理和反应动力学。
2.1 MnOx/Al2O3催化剂的表征
2.1.1 X射线衍射
将MnOx/Al2O3催化剂在不同温度下焙烧4 h,其XRD谱图如图2所示。与标准衍射(PDF)卡对比可知,该催化剂的活性组分主要为Mn2O3和MnO2。随着焙烧温度升高,Mn2O3的峰强度逐渐增强,MnO2的峰强度减弱。研究表明,在MnOx/Al2O3催化剂中,氧化还原电对Mn3+、Mn4+之间容易发生电子转移,从而使氧物种在晶格中的迁移率升高,MnOx晶格中出现很多氧空位,臭氧容易吸附在氧空位上并分解产生氧化性自由基[15]。由此可知,MnOx/Al2O3催化剂应该有一个最佳焙烧温度,在这个温度下,Mn2O3和MnO2的含量适宜,其催化活性得到增强。

图2 MnOx/Al2O3在不同焙烧温度下的XRD谱图
2.1.2 pHzpc的测定
pHzpc是表征催化剂表面酸碱性的重要参数,对催化臭氧氧化反应有非常大的影响。本试验采用pH值移位法测定MnOx/Al2O3催化剂的pHzpc,测定结果如图3所示。MnOx/Al2O3催化剂的pHzpc为8.63,研究表明,溶液pH维持在催化剂的pHzpc附近,有利于催化臭氧氧化反应的进行,故在MnOx/Al2O3催化臭氧氧化处理含氰废水的试验中,溶液pH维持在8.63左右。

图3 MnOx/Al2O3表面pHzpc的测定
2.2 不同因素对废水中氰根去除率的影响
2.2.1 焙烧温度的影响
如图4所示,在催化剂投加量为20 g/L、臭氧投加量为75 mg/min、溶液pH为8.6的条件下,将Mn目标负载量为8%的MnOx/Al2O3催化剂在不同温度(300 ℃、400 ℃、500 ℃、600 ℃、700 ℃)下焙烧4 h,然后用于催化臭氧氧化处理含氰废水。由图4可知,焙烧温度对MnOx/Al2O3催化臭氧氧化降解氰化物的影响显著,当焙烧温度从300 ℃升高到700 ℃时,MnOx/Al2O3催化剂的催化活性先提高后下降。焙烧温度为500 ℃时,MnOx/Al2O3的催化活性最高,氰化物的降解速率最快。这可能是由于当焙烧温度较低时,MnOx的前驱体Mn(NO3)2未完全分解,而随着温度的逐渐升高,Mn(NO3)2分解产生更多的活性组分,从而使催化剂表面的活性位点增加。当MnOx/Al2O3的焙烧温度升至600 ℃时,氰化物的去除率与500 ℃相比下降9%,进一步升高温度到700 ℃,相比500 ℃,氰化物去除率的下降幅度达到20.1%,这可能是因为焙烧温度过高,破坏了MnOx的晶体结构,并使催化剂的孔道塌陷,从而使催化剂比表面积下降,并且温度越高,这种影响越显著,催化剂的催化活性下降越多。经综合分析,MnOx/Al2O3的最佳焙烧温度取500 ℃。

图4 焙烧温度对氰化物降解效果的影响
2.2.2 焙烧时间的影响
为了探究MnOx/Al2O3的最佳焙烧时间,本节试验在500 ℃温度下分别将其焙烧2 h、3 h、4 h、5 h、6 h,利用Mn目标负载量为8%的MnOx/Al2O3催化臭氧氧化处理含氰废水,其他条件与小节2.2.1试验条件相同,具体试验结果如图5所示。由图5可知,适当延长MnOx/Al2O3的焙烧时间可以提高废水中氰化物的去除率,当焙烧时间进一步延长后,氰化物的去除率反而下降。焙烧时间为4 h时,MnOx/Al2O3的催化活性最强,氰化物去除率为95.21%。试验结果与前面的分析一致,即焙烧时间过短,催化剂前驱体分解不完全,活性组分的生长受到影响,而焙烧时间过长,对催化剂的微观结构造成影响,这些都影响催化剂的活性。因此,为了保证催化剂的良好活性,MnOx/Al2O3的最佳焙烧时间取4 h。

图5 焙烧时间对氰化物降解效果的影响
2.2.3 Mn目标负载量的影响
在最佳焙烧温度和最佳焙烧时间下,采用超声辅助浸渍法制备了Mn目标负载量分别为2%、4%、6%、8%、10%、12%的MnOx/Al2O3,研究负载不同含量活性组分的MnOx/Al2O3催化臭氧氧化处理含氰废水的效果,试验结果如图6所示。从图6可以看出,氰化物去除率均随着Mn负载量的增加先升高后下降。当Mn负载量为2%时,氰化物的最终去除率最低为76.19%;当负载量增加到8%时,催化剂的催化活性最强,氰化物去除率最高,反应时间为80 min,氰化物去除率为89.24%,已经超过其他负载量的最终去除率,反应结束时,氰化物去除率为95.21%;当Mn负载量增加到10%和12%时,与8%的负载量相比,氰化物去除率分别下降5.83%和9.59%。主要原因是Mn负载量较低时,催化剂表面的活性组分含量和活性位点的数量少,导致催化剂催化活性较低;当Mn负载量超过最佳负载时,过多的锰氧化物会堆积在活性氧化铝的表面和孔道中,覆盖催化剂表面的活性位点,并降低催化剂的比表面积和孔容积,从而使催化剂的催化性能下降。经综合分析,MnOx/Al2O3的最佳Mn目标负载量取8%。

图6 Mn目标负载量对氰化物降解效果的影响
2.2.4 催化剂投加量的影响
MnOx/Al2O3焙烧温度为500 ℃,焙烧时间为4 h,Mn目标负载量为8%,臭氧投加量为75 mg/min时,试验考察了催化剂投加量对催化臭氧氧化降解含氰废水的影响,试验结果如图7所示。

图7 催化剂投加量对氰化物降解效果的影响
由图7可知,当MnOx/Al2O3的投加量低于20 g/L时,随着催化剂投加量增加,废水中氰化物含量显著提高,当催化剂投加量为10 g/L时,氰化物去除率为79.62%;当催化剂投加量增加到15 g/L时,氰化物去除率提高7.42%;进一步增加催化剂投加量到20 g/L时,氰化物去除率较15 g/L的投加量提高8.17%。这可能是因为催化剂投加量增加后,催化剂表面的羟基基团和路易斯酸位等活性位点增多,催化剂与臭氧接触的面积增大,进而促进臭氧分解产生强氧化性自由基,提高了氰化物去除率。继续增加催化剂的投加量至25 g/L和30 g/L时,氰化物去除率相比20 g/L的投加量分别提高0.27%和0.99%,两者的去除率增加比较缓慢。这可能是因为过多的催化剂造成颗粒间的团聚,反而降低催化剂的比表面积,再者,催化剂用量达到饱和后,臭氧用量和污染物浓度已经成为反应的限制因素,进一步增加催化剂的用量,废水中氰化物的去除效果提升不明显。综合考虑废水处理效果和处理成本,MnOx/Al2O3的最佳投加量取20 g/L。
2.2.5 臭氧投加量的影响
MnOx/Al2O3焙烧温度为500 ℃,焙烧时间为4 h,Mn目标负载量为8%,投加量为20 g/L时,调节臭氧发生器出口臭氧投加量(50 mg/min、75 mg/min、100 mg/min、125 mg/min),探索MnOx/Al2O3催化臭氧氧化处理含氰废水的最佳臭氧投加量,试验结果如图8所示。

图8 臭氧投加量对氰化物降解效果的影响
从图8可知,随着臭氧投加量的增加,废水中氰化物的去除率逐渐提高,臭氧投加量增加到一定程度后,氰化物去除率增加非常缓慢。臭氧投加量从50 mg/min依次增加到125 mg/min时,氰化物的最终去除率依次为87.93%、95.21%、99.21%、99.46%。这是因为臭氧投加量较低时,液相中的臭氧与催化剂作用产生的自由基较少,随着气相中臭氧投加量不断增加,气液两相间的浓度梯度越来越大,传质效果越来越好,液相传质速率加快,使得液相中臭氧浓度增加,活性自由基的产生量相应增加,故而反应体系中氰化物的去除效果显著。当臭氧投加量超过最佳投加量后,液相中溶解的臭氧量已经达到饱和,多余的臭氧直接随尾气进入吸收液,造成资源浪费;催化剂提供的活性位点有限,即使臭氧投加量增加,自由基产生量不会继续增加,再者,废水中氰化物含量已经接近最低限,臭氧投加量继续增加,其去除率基本保持不变。经综合分析,最佳臭氧投加量取100 mg/min。
2.3 MnOx/Al2O3催化臭氧氧化机理研究
为了探究MnOx/Al2O3催化臭氧氧化的机理,在反应过程中加入羟基自由基(·OH)抑制剂来终止自由基链式反应。叔丁醇(TBA)是最常用的·OH抑制剂,它与臭氧的反应速率常数KO3仅为3×10-3(mol·L)-1·s-1,与·OH的反应速率常数K·OH为6×108(mol·L)-1·s-1,后者是前者的2×1011倍[16]。本节试验中的催化剂是在最佳工艺条件下制备的,催化剂投加量为20 g/L,臭氧投加量为100 mg/min,反应溶液pH为8.6,试验结果如图9所示。
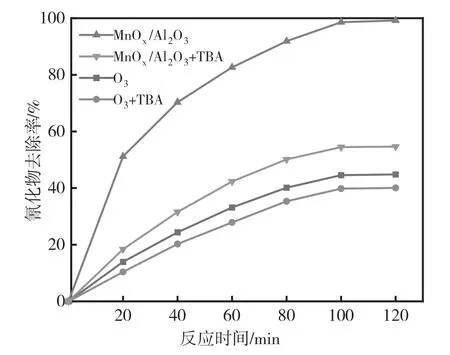
图9 自由基抑制剂对氰化物降解效果的影响
由图9可知,加入叔丁醇后,氰化物去除率明显下降,直接臭氧氧化反应120 min后,氰化物去除率为44.82%,加入叔丁醇后,氰化物去除率下降4.61%。当使用MnOx/Al2O3催化臭氧氧化处理含氰废水时,反应120 min后氰化物去除率为99.21%,与单独使用臭氧氧化处理废水中氰化物的去除率相比,加入催化剂后,其去除率提高54.39%,催化剂效果显著。研究发现,MnOx/Al2O3催化臭氧氧化处理含氰废水的过程遵循羟基自由基反应机理,氰化物的降解主要归于臭氧分解产生的·OH,MnOx/Al2O3催化臭氧氧化反应如式(1)至式(5)所示。

在MnOx/Al2O3催化臭氧氧化过程中加入叔丁醇后,氰化物去除率下降44.57%,催化臭氧氧化降解氰化物的效果下降显著,这是因为叔丁醇与氰化物发生竞争消耗了大量·OH,阻碍了氰化物与·OH反应,这进一步证明了上述反应机理。在直接的臭氧氧化过程中加入叔丁醇后,氰化物去除率仅下降4.61%,叔丁醇与臭氧的反应速率常数较小,对臭氧直接氧化氰化物的影响较小,故催化臭氧氧化反应加入叔丁醇后氰化物仍有去除。综上所述,在MnOx/Al2O3催化臭氧氧化处理含氰废水的过程中,不仅有·OH参与反应,还有臭氧直接参与反应,但是·OH在反应过程中起主导作用。
2.4 MnOx/Al2O3催化臭氧氧化反应动力学分析
反应机理研究表明,MnOx/Al2O3催化臭氧氧化处理含氰废水的过程不仅有·OH参与反应,还有臭氧直接参与反应。因此,该反应的速率方程可以表示为

式中:[CN-]为氰化物浓度;t为反应时间;[O3]为臭氧浓度;[·OH]为·OH浓度;a、b、c分别为臭氧、·OH、氰化物的活度系数;k1为O3与氰化物直接反应的速率常数;k2为·OH与氰化物间接反应的速率常数。
设k为MnOx/Al2O3催化臭氧氧化的表观反应速率常数,k的表达式为

式(6)可以转化为

在上述的MnOx/Al2O3催化臭氧氧化处理含氰废水的最佳工艺条件下,对氰化物反应动力学参数-ln([CN-]t/[CN-]0)与时间t的关系进行考察,结果如图10所示。令y=-ln([CN-]t/[CN-]0),x=t,二者的关系用公式可以表示为y=0.031 6x+0.027 6,相关系数R2为0.992 6。由此可以看出,MnOx/Al2O3催化臭氧氧化降解含氰废水的过程中,氰化物参与反应的-ln([CN-]t/[CN-]0)与时间t呈线性关系,即该反应为一级反应,反应速率与反应物的浓度有关,表观反应速率常数k为0.031 6 min-1。

图10 MnOx/Al2O3催化臭氧氧化反应动力学
3 结论
从MnOx/Al2O3催化臭氧氧化处理含氰废水的最佳工艺参数来看,MnOx/Al2O3焙烧温度为500 ℃,焙烧时间为4 h,Mn目标负载量为8%,溶液pH为8.6,催化剂投加量为20 g/L,臭氧投加量为100 mg/min。在最佳条件下,氰化物去除率可达99.21%,达到氰离子的排放标准。MnOx/Al2O3催化臭氧氧化处理含氰废水的反应涉及臭氧的直接氧化作用和羟基自由基的间接氧化作用,其中羟基自由基反应起主导作用。氰离子的降解过程为一级反应,表观反应速率常数为0.031 6 min-1。

