血清dp-ucMGP、BGP水平与2型糖尿病肾脏病变的相关性及预测价值*
彭兆康 高宇 刘晓燕
(承德医学院附属医院内分泌科,河北 承德 067000)
糖尿病肾脏病变(Diabetic kidney disease,DKD)是糖尿病慢性非传染病之一,影响约40%的糖尿病患者,其病因复杂,如果此病风险可以预测,致残致死率会明显降低[1]。近年来有学者发现维生素K在一定程度上参与DKD的发生发展,但其在体内极不稳定,故目前多采用去磷酸-未羧化MGP(Dephosphorylated uncarboxylated Matrix Gla Protein,dp-ucMGP)间接评估[2],有研究表明dp-ucMGP在慢性肾脏病(Chronickidneydisease,CKD)尤其是中晚期肾脏病中显著升高[3]。骨钙素(Bone Gla Protein,BGP)为一种维生素K依赖蛋白,被发现与肾损伤有关[4]。目前尚少有对dp-ucMGP、BGP两者联合起来研究与DKD的相关性,本研究通过测定DKD患者血清中dp-ucMGP、BGP的浓度,探讨其与DKD的相关性,同时评估两者联合对DKD的诊断价值,为DKD的早期诊断提供新思路。
1 资料与方法
1.1 一般资料 纳入2020年9月~2021年11月在我院内分泌科住院的138例2型糖尿病患者。诊断标准:①T2DM诊断符合《中国2型糖尿病防治指南(2020年版)》诊断标准[5]。②DKD的临床诊断标准[6-7]:在大部分糖尿病患者中,出现以下任何一条者考虑其肾脏损伤是由糖尿病引起的:大量白蛋白尿(ACR>30 mg/mmol,1 mg/mmol=10 mg/g);糖尿病视网膜病变伴微量白蛋白尿。排除标准:①24 h内存在剧烈运动;1个月内应用糖皮质激素类药物者;急性感染、应激者。②GDM、T1DM及其他特殊类型糖尿病者。③合并恶性肿瘤者、严重脏器功能衰竭。④应用维生素K拮抗剂治疗的患者。⑤患有甲状腺、甲状旁腺疾病。⑥其他原因引起的肾脏病变[6]。根据尿白蛋白/肌酐(Creatinine protein ratio,ACR)水平分组 (入院后测量两次ACR,取平均值)[7]:ACR<3 mg/mmol为单纯糖尿病组(DM,n=56);ACR在 3~30 mg/mmol之间为早期糖尿病肾病组(eDKD,n=38);ACR>30 mg/mmol为临床糖尿病肾病组(cDKD,n=44)。本研究均获得患者知情同意,并经我院伦理委员会批准。
1.2 方法 用ELISA法测定血清dp-ucMGP、BGP的水平。禁食12 h后由我院检验科Beckman AU5800全自动生化分析仪检测尿素(UREA)、肌酐(CRE)、尿酸(UA)、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)等。糖化血红蛋白(HbA1c)水平由离子交换高压液相法Bio-Rad D10进行检测;空腹C肽(C-P)及餐后2 h(2H C-P)水平由ROCHE(罗氏)cobase 411全自动电化学发光免疫分析仪进行检测。用血清肌酐水平,使用CKD-EPI法估算肾小球滤过率(eGFR)。
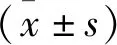
2 结果
2.1 3组基线资料比较 3组间年龄、性别差异无统计学意义(P>0.05),具有可比性。与DM组相比,eDKD组和cDKD组SBP水平升高,差异有统计学意义(P<0.05),且eDKD组患者糖尿病视网膜病变(DR)的比例更高(P<0.05)。见表1。
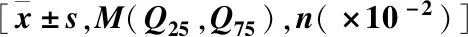
表1 3组间基线资料比较Table 1 Comparison of baseline data among the three groups
2.2 3组dp-ucMGP、BGP含量及生化指标比较 3组血糖、血脂水平及C肽水平差异无统计学意义(P>0.05)。与DM组相比,eDKD组和cDKD组的dp-ucMGP、UA升高,BGP降低(P<0.05);与eDKD组相比,cDKD组UREA、CRE水平升高,eGFR、ALB水平降低,差异有统计学意义(P<0.05)。见表2。
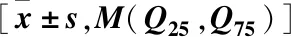
表2 3组dp-ucMGP、BGP及生化指标的比较Table 2 Comparison of dp-ucMGP,BGP and biochemical indices among the three groups
2.3Spearman相关性分析 Dp-ucMGP与ACR、CRE、UREA、DR呈正相关,与eGFR、ALB、BGP呈负相关(均P<0.05);BGP与ACR、BMI、FBG、ALB、DR呈负相关(均P<0.05或P<0.01);与UREA、CRE、eGFR无相关性(P>0.05)。见表3。
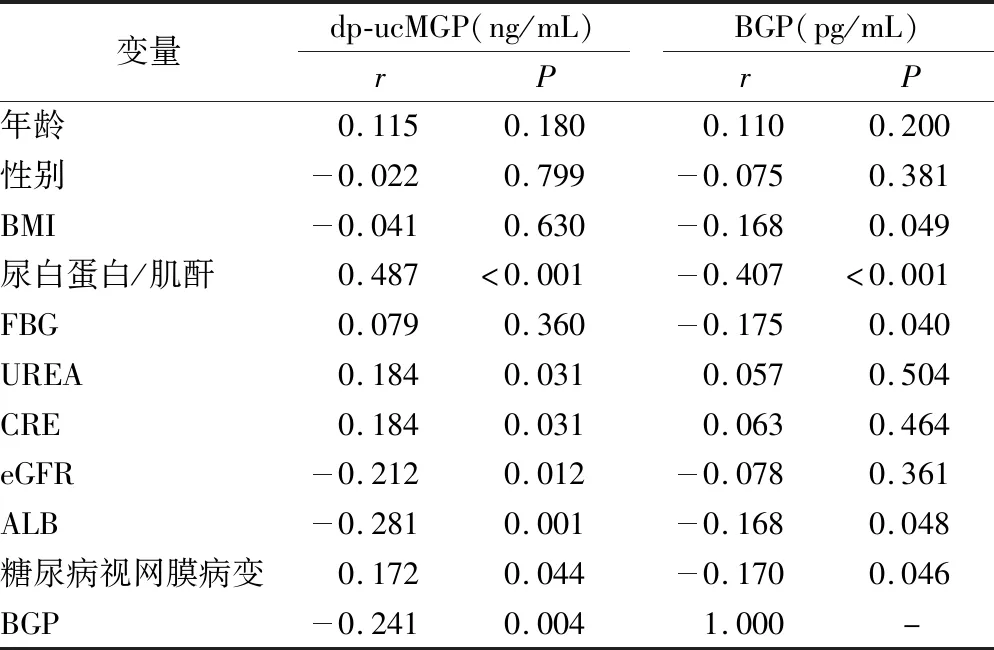
表3 dp-ucMGP、BGP与临床指标的相关性Table 3 Correlation between dp-ucMGP,BGP level and clinical indicators
2.4 DM患者肾脏病变危险因素的二元Logistic回归分析 以是否合并DKD为因变量,分别以年龄、性别、糖尿病病程、SBP、FBG、UREA、CRE、UA、eGFR、dp-ucMGP、BGP为自变量进行Logistic回归分析,原始模型结果显示,dp-ucMGP、SBP、FBG、UREA、CRE、UA是DKD的危险因素,BGP、eGFR是DKD的保护性因素(均P<0.05)(见表4)。在校正年龄、性别、糖尿病病程、SBP、FBG、UREA、CRE、UA、eGFR等混杂因素后,dp-ucMGP仍为DKD的独立危险因素[OR:1.784(95%CI:1.381~2.303)],BGP是DKD的独立保护性因素[OR:0.986(95%CI:0.980~0.993)](均P<0.001),见表5。
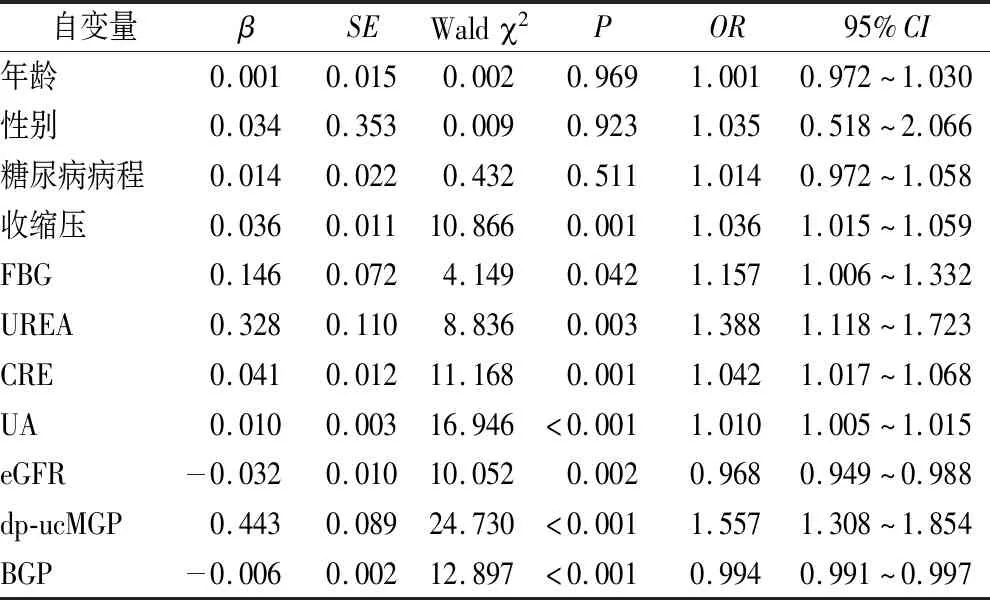
表4 DKD的影响因素的logistic回归分析Table 4 Logistic regression analysis of the influencing factors of DKD
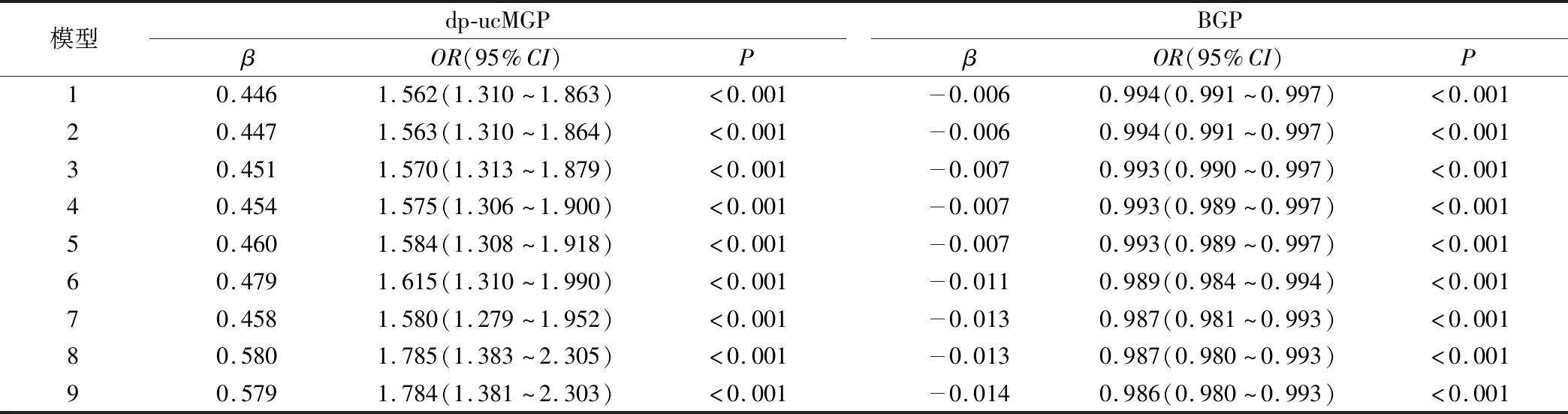
表5 校正混杂因素后dp-ucMGP、BGP对DKD的logistic回归分析Table 5 Logistic regression analysis of DKD by dp-ucMGP and BGP after correction for confounders
2.5 ROC曲线分析 通过ROC曲线分析dp-ucMGP、BGP单独及联合预测DKD,联合检测结果优于单独检测(P<0.05),见图1、表6。
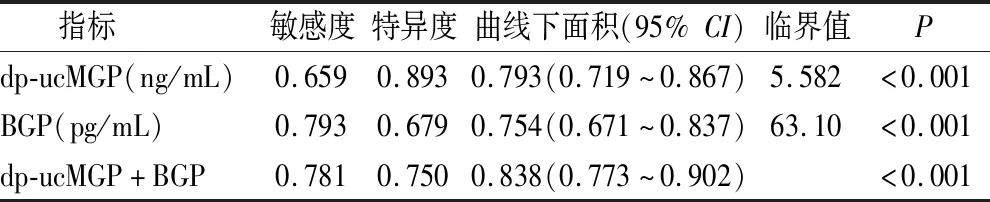
表6 dp-ucMGP、BGP及联合检测ROC曲线下面积Table 6 The ROC curve analysis of dp-ucMGP、BGP alone and jointly for predicting DKD
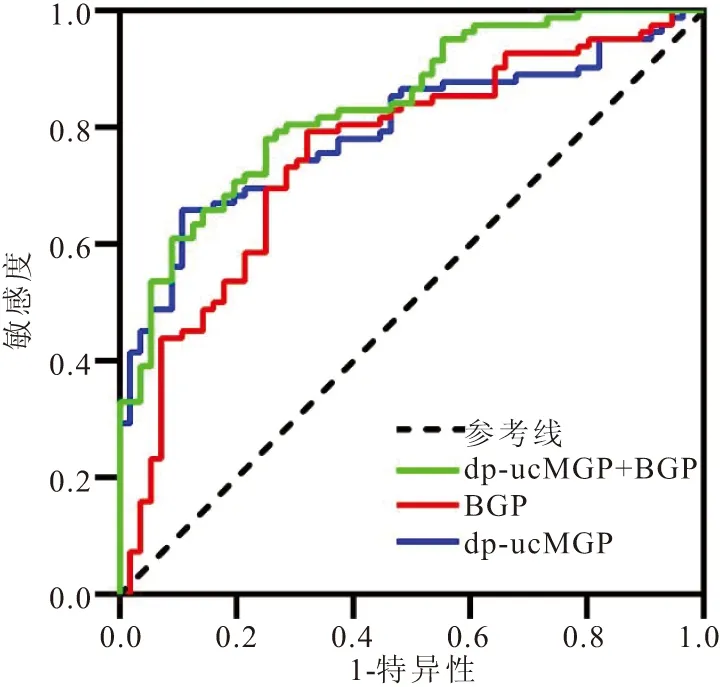
图1 dp-ucMGP、BGP单独及联合诊断DKD的ROC曲线Figure 1 ROC curves of dp-ucMGP ,BGP alone and combined diagnosis of DKD
3 讨论
DKD是最重要的糖尿病微血管并发症之一,其起病隐匿,早期无特异性临床表现,蛋白尿是肾脏损伤的一个明确的标志,也是疾病进展的主要原因,ACR水平可较好反应肾损伤情况[8-9]。但尿白蛋白易受剧烈运动、感染等多种因素影响,故需更稳定的方法来筛查DKD。
对纳入对象进行基线资料评估,发现和DM组患者相比,eDKD组UA升高,而UREA、CRE、ALB差异无统计学意义,提示UA代谢可能在肾脏病变中最早受影响,随病情进展至cDKD,UREA、CRE水平与对照组和eDKD组相比升高,且eGFR及ALB水平下降,差异有统计学意义,符合DKD的临床进展过程。本研究发现,eDKD组与cDKD组患者的SBP水平更高,且与ACR成正相关,在He等[10]的研究中也被观察到,提示SBP在肾脏病进展中起到一定的作用,临床工作中应对DM患者的血压控制情况更加关注。
dp-ucMGP是基质-γ-羧基谷氨酸蛋白(Matrix Gla Protein,MGP)的非活性形式,反应血管钙化,Roumeliotis等[2,11]研究表明高dp-ucMGP水平与慢性肾脏病的死亡率和肾功能下降明显相关,并提示MGP转化受损,但这些研究多集中于终末期肾脏病患者,对于较早期尤其是2型糖尿病肾脏病变的患者研究较少。本研究发现eDKD组及cDKD组血清dp-ucMGP含量较DM组患者升高,存在统计学差异,国外一项研究对4名CKD患者及2名健康人的肾脏进行了活检染色,结果显示健康者肾组织未见钙化,而有3名CKD患者存在肾动脉钙化以及非活性MGP的表达增加,提示dp-ucMGP的升高可能与DKD肾动脉钙化有关[12]。本研究中dp-ucMGP与ACR成正相关,覃春美等[13]发现DKD大鼠在第8周即有肾动脉的钙盐沉积,且肾动脉钙化程度与大鼠的尿蛋白水平成正相关,这提示除肾动脉钙化外,可能还存在肾微小动脉的钙化,动脉弹性降低致漏出的蛋白增多,同时本研究中还观察到dp-ucMGP与同为微血管病变的DR成正相关,推测微血管钙化可能是微血管病变的机制之一。既往研究表明,dp-ucMGP与微血管钙化的联系可能与体内维生素K相对不足有关,维生素K作为钙化抑制剂MGP的辅酶,被发现在CKD患者中广泛缺乏[14]。在本研究中dp-ucMGP在eDKD组即有升高,cDKD组升高更明显,提示血管钙化有可能发生在病程早期,且与DKD的进展有关,但关于该领域的基础研究较少,有待进一步的探索。Goothof 等[15]研究表明,dp-ucMGP与eGFR呈负相关,与本研究结果一致。二元logistic回归结果表明在剔除可能影响DKD的因素后,dp-ucMGP仍是T2DM患者合并DKD的危险因素。在ROC分析中,dp-ucMGP诊断DKD曲线下面积大于0.7,提示它对2型糖尿病肾脏病变具有一定的临床诊断意义。
BGP是成骨细胞在骨形成过程中分泌的一种小的非胶原蛋白,是骨与糖代谢之间连接的桥梁,被发现在糖尿病的进程中起保护作用,但BGP与肾脏病变的研究较少[16-17]。在本研究发现BGP在eDKD组及cDKD组降低,与ACR成负相关,与Xu等[18]在CKD患者中的研究趋势一致。逐步Logistic回归分析提示BGP是DKD的保护性因素,BGP在成骨细胞经内质网蛋白质翻译后发生羧化(Carboxylated bone glaprotein,cBGP),羧化后的骨钙素构象发生改变,对羟基磷灰石晶体表面的钙离子的亲和力增加从而减少微血管钙化,这可能是其保护机制所在[19-20]。与DM组相比,BGP水平在eDKD组中显著下降,但在eDKD组与cDKD组间无统计学差异,提示保护作用可能在病变形成之前较为显著,形成之后这种保护作用因为某种机制减弱或消失,这也为BGP诊断早期DKD提供了可能。BGP与DR呈负相关,与An等[21]研究一致,DR与DKD同为微血管病变,推测BGP在其中可能起到相似作用。本研究还发现BGP与FBG、BMI呈负相关,与ZENG等[22]研究一致,可能与BGP通过羧化后的cBGP作用于脂联素改善脂肪组织胰岛素敏感性,增强β-细胞的功能,改善糖脂代谢有关[23-24]。在ROC分析中,dp-ucMGP、BGP单独诊断DKD的曲线下面积均大于0.7,具有一定的诊断效能,但两者联合检测时AUC>0.8,优于任一单一因子检测。
本研究的局限性在于:仅从临床糖尿病肾脏病变的标准进行诊断,未能对患者进行肾脏活检;另外本研究未能对患者进行随访来明确血清dp-ucMGP及BGP的变化,且样本量较少,未来仍需扩大研究范围,动态评估dp-ucMGP、BGP与DKD的关系。
4 结论
T2DM合并DKD患者存在更高的dp-ucMGP以及更低的BGP水平,两者可能参与DKD的进展,对DKD的诊断具有一定价值,未来需更深入研究dp-ucMGP、BGP参与DKD的发病机制。

