猫棒束孢对IR-Hep G2细胞氧化应激的改善作用及机制*
陈静静 陈丽霞 赵莉莉 杨永明 杨喜花,
(1.山西医科大学公共卫生学院,山西 太原 030001;2.山西医科大学附属肿瘤医院实验动物中心,山西 太原 030013)
糖尿病是由胰岛素分泌受损和对胰岛素敏感的靶器官反应能力下降所引起的一种以高血糖为特征的代谢性疾病,2型糖尿病(Type 2 diabetes mellitus,T2DM)占所有糖尿病的患者的95%以上[1],胰岛素抵抗(Insulin resistance,IR)是其发病机制之一,当机体出现IR时,胰岛素作用的靶器官(主要是肝脏、脂肪、骨骼肌)对葡萄糖的利用率下降[2],引起血糖升高,而细胞间与细胞内的血糖浓度升高将导致氧化应激,氧化应激改变分子和细胞成分,影响细胞机制,进一步加重IR[3]。
冬虫夏草是我国传统名贵中药,与人参、鹿茸并列为三大补品,有着极高的药用价值,其活性组分及中成药制品(如百令胶囊、金水宝胶囊)在防治糖尿病及其并发症上发挥着重要作用[4-5]。猫棒束孢(Isaria felina,IF)是从天然冬虫夏草虫草体中分离得到的一株真菌,由中国科学院微生物研究所郭英兰教授鉴定为猫棒束孢Isaria felina(DC.:Fr.)Fr,被中国微生物菌种保藏管理委员会普通微生物中心保藏 (保藏号:CGMCC NO.0706)。前期我们已完成对猫棒束孢成分的分析测定,其药效成分主要有虫草素、虫草酸、虫草多糖、麦角甾醇等[6],具有免疫调节[7]、抗肿瘤[8]、肾脏保护[9]等药理作用。前期动物实验已证实IF能够降低T2DM血糖,改善氧化应激状态,本试验探讨IF对胰岛素抵抗Hep G2细胞模型的改善作用及可能机制,为其治疗2型糖尿病提供新的理论依据。
1 材料与方法
1.1 材料与试剂 人肝癌Hep G2细胞由山西医科大学公共卫生学院王东新教授惠赠,由山西医科大学附属肿瘤医院传代保种。IF由山西医科大学附属肿瘤医院自制。胰岛素注射液(江苏万邦生物医药有限公司,批号:H10890001);胎牛血清(浙江天杭生物科技股份有限公司,批号20070501)、DMEM培养基(Biological Industries,批号:2045184)、胰蛋白酶、四甲基偶氮唑蓝(北京索莱宝科技有限公司,批号分别为:20211126、522P054)。葡萄糖(GLU)、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒(南京建成生物科技公司,批号分别为:20210629、20220312、20220310);IRS-1、PI3K、Akt试剂盒(凡科维商城,批号分别为:202205、202202、202202)。
1.2 仪器与设备 311型CO2培养箱(美国Thermo公司);Sun Rise酶标仪(奥地利Tecan公司);Leica 090-135.001倒置显微镜(德国Leica公司);Olympus CX21FS1型光学显微镜(日本奥林巴斯有限公司);HR-40 II A2型生物安全柜(青岛海尔医用低温科技有限公司);KDC-2044型低速冷冻离心机(科大创新股份有限公司)。
1.3 方法
1.3.1 Hep G2细胞的复苏与传代培养 利用含10%胎牛血清、1%青、链霉素的DMEM高糖培养基,37 ℃、5% CO2饱和湿度下对细胞进行培养,0.25%胰蛋白酶进行消化、传代,取对数生长期的细胞进行实验。
1.3.2 MTT法确定细胞给药安全范围 将高糖DMEM培养的Hep G2细胞按1×105个/mL接种于96孔板,每孔100 μL,培养24 h后弃去原培养基,设立正常组和干预组,干预组加入含有猫棒束孢(终浓度为5、10、20、40、80、160、320、640 μg·mL-1)的细胞培养基200 μL继续培养24 h,用MTT法检测细胞存活率。
1.3.3 MTT法确定胰岛素诱导安全范围 将高糖DMEM培养的Hep G2细胞按1×105个/mL接种于96孔板,每孔100 μL,培养24 h后弃去原培养基,设立正常组和干预组,干预组加入含有胰岛素(终浓度为10-4、10-5、10-6、10-7、10-8mol·L-1)的细胞培养基200 μL继续培养24 h和48 h,用MTT法检测细胞存活率。
1.3.4 细胞分组及上清中葡萄糖含量测定 将高糖DMEM培养的Hep G2细胞按1×105个/mL接种于96孔板,每孔100 μL,培养24 h后弃去原培养基,除正常组外其余孔加入含胰岛素10-8mol·L的高糖DMEM培养基200 μL,诱导48 h后,吸弃原培养基,分别设立正常组(NC)、模型组(MC)、IF低剂量(IF-L)组、IF高剂量(IF-H)组,正常组和模型组加入200 μL DMEM培养基,各给药组加入含猫棒束孢水提取液(5、10 μg·mL-1)的DMEM培养基200 μL,于37℃、5% CO2的培养箱内孵育24 h后,用葡萄糖试剂盒检测上清液中的葡萄糖含量,以正常孔葡萄糖含量减去各孔葡萄糖含量计算出每孔细胞的葡萄糖消耗量。
1.3.5 氧化应激水平测定 根据MDA、SOD试剂盒说明书测定各分组IR-Hep G2细胞中MDA、SOD的水平。
1.3.6 ELISA检测IRS-1/PI3K/Akt通路相关蛋白含量 根据IRS-1、PI3K、Akt试剂盒说明书测定各分组IR-Hep G2细胞中IRS-1、PI3K、Akt的含量。
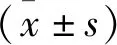
2 结果
2.1 药物对细胞存活率的影响 各剂量组的猫棒束孢处理后的Hep G2细胞存活率均高于对照组(P<0.05)。IF浓度在5 μg·mL-1和10 μg·mL-1对细胞生长无显著促进作用,因此浓度选用5 μg·mL-1和10 μg·mL-1。见表1。

表1 不同浓度猫棒束孢处理后对Hep G2细胞存活率的影响Table 1 Effects of different concentrations of IF on survival rate in Hep G2 cells
2.2 胰岛素对细胞存活率的影响 除10-5mol·L-1组外,其余剂量组经胰岛素处理后的Hep G2细胞24 h细胞存活率均无统计学意义(P>0.05)。在处理48 h后,只有10-8mol·L-1剂量组对细胞生长无显著抑制作用,综合选用10-8mol·L-1的胰岛素诱导48 h建立IR-Hep G2模型。见表2。
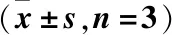
表2 不同浓度胰岛素处理后对Hep G2细胞存活率的影响Table 2 Effects of different concentrations of insulin on survival rate in Hep G2 cells
2.3 猫棒束孢对IR-Hep G2细胞模型的影响 与正常组比较,模型组IR-Hep G2细胞的葡萄糖消耗量显著下降(P<0.01),说明IR-Hep G2模型建造成功。与模型组比较,各浓度猫棒束孢干预后的IR-Hep G2细胞的葡萄糖消耗量显著上升(P<0.01),说明猫棒束孢能够恢复IR-Hep G2细胞对葡萄糖的摄取能力。见图1。

图1 猫棒束孢对IR-Hep G2细胞葡萄糖消耗量的影响Figure 1 Effects of IF on glucose consumption in IR-Hep G2 cells注:与正常组比较,①P<0.01;与模型组比较,②P<0.01
2.4 氧化应激水平测定 与正常组相比,模型组IR-Hep G2细胞的SOD含量显著下降(P<0.01),MDA含量显著上升(P<0.01);与模型组相比,猫棒束孢(5 μg·mL-1)干预后的IR-Hep G2细胞的SOD含量显著上升(P<0.01),MDA含量显著下降(P<0.01),猫棒束孢(10 μg·mL-1)干预后只显著升高MDA含量(P<0.01)。见图2。
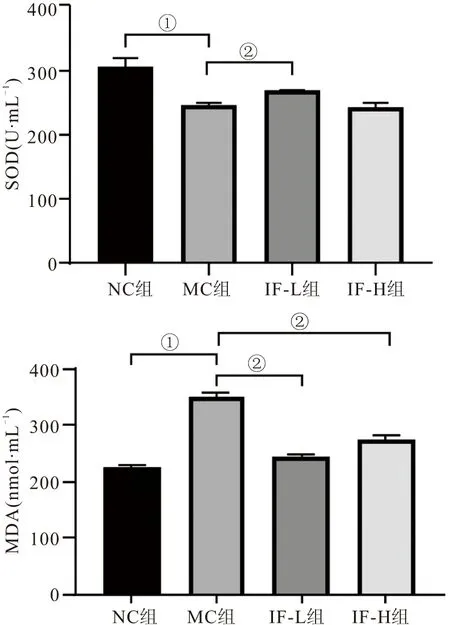
图2 猫棒束孢对IR-Hep G2细胞氧化应激水平的影响Figure 2 Effects of IF on oxidative stress of IR-Hep G2 cells注:与正常组比较,①P<0.01;与模型组比较,②P<0.01
2.5 对IRS-1/PI3K/Akt信号通路的影响 与正常组相比,模型组IR-Hep G2细胞的IRS-1、PI3K、Akt的含量显著降低(分别为P<0.01、P<0.01、P<0.05),与模型组相比,猫棒束孢(5 μg·mL-1)干预后,IRS-1、PI3K、Akt的含量显著上升(分别P<0.01、P<0.01、P<0.01),猫棒束孢(10 μg·mL-1)干预后,只有PI3K的含量显著上升(P<0.05),见表3。
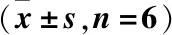
表3 猫棒束孢对Hep G2细胞IRS-1、PI3K、Akt含量的影响Table 3 Effects of IF on contents of IRS-1、PI3K、Akt in Hep G2 cells
3 讨论
肝脏是人体最大的糖代谢器官,通过糖酵解、肝糖原的合成与分解、糖异生等途径参与机体对葡萄糖的代谢,是胰岛素作用的靶器官之一。Hep G2细胞是一种与肝细胞极为相似的肝胚胎瘤细胞株,具有肝细胞的许多生物学特性,由Hep G2细胞建立的IR模型是公认的用于研究IR发生机制的理想模型[10],常用于研究降糖药物的作用机制。IR是机体对生理浓度的胰岛素的敏感反应性低于正常生物学效应的一种病理状态,主要表现为胰岛素抑制肝脏葡萄糖释放以及外周组织 (脂肪和肌肉) 利用葡萄糖能力下降[11]。本实验通过将Hep G2细胞置于1×10-8mol·L-1的胰岛素中48 h建立IR模型,并给予IF干预,结果显示,IF能够提高IR-Hep G2的葡萄糖消耗量,改善糖代谢。
氧化应激是机体内氧自由基产生过多,抗氧化防御功能损害,导致机体氧化和抗氧化状态失衡,会导致蛋白质、核酸等大分子物质的氧化损伤[12-13],自由基与脂质结合后,诱导脂质过氧化产生MDA,因此MDA的定量被广泛用作氧化生物标志物,以评估组织中氧自由基含量及细胞损伤程度[14]。SOD是酶抗氧化防御系统中的重要组成成员,是对抗氧化应激的第一道生理防线,对机体的氧化与抗氧化平衡起着重要的作用,能够清除超氧阴离子自由基O2-并保护细胞免受损伤[15-17]。高血糖是引起氧化应激和氧化物产生的最重要的原因之一,氧化应激在胰岛素抵抗中发挥着关键作用,氧化应激程度增加被认为有助于糖尿病及其并发症的发生发展[14]。已有研究[18]证实,抗氧化治疗可以逆转肥胖小鼠模型中脂肪组织的胰岛素抵抗,抗氧化剂补充剂不仅可以降低细胞氧化应激水平,改变膜性质来改善胰岛素作用并降低葡萄糖水平[19],也对糖尿病继发性并发症有效。IRS-1/PI3K/AKT信号通路是胰岛素调节葡萄糖代谢最主要的信号通路,正常状态下通过级联反应发挥着调节血糖稳态的作用,SOD分泌不足,MDA产生过多,机体处于氧化应激状态时会抑制胰岛素与IRS-1的结合,进一步抑制胰岛素受体(InsR)和PI3K的磷酸化,导致胰岛素信号传导异常,细胞对葡萄糖的摄取和利用能力受损,胰岛素敏感性降低,继而又加重胰岛素抵抗程度[20],血糖持续升高促进T2DM的发生。本研究中,IF可以通过缓解IR-Hep G2细胞的氧化应激水平,恢复胰岛素与IRS的结合,通过PI3K/AKT信号途径调节葡萄糖的转运及代谢,发挥胰岛素生理学效应。
4 结论
IF能够提高IR-Hep G2细胞模型中葡萄糖的消耗量,提高SOD含量,降低MDA含量,改善细胞氧化应激水平,并通过调控IRS/PI3K/AKT信号通路改善胰岛素抵抗。该试验从细胞层面叙述了猫棒束孢对胰岛素抵抗改善的上游信号作用机制,后续将继续探讨猫棒束孢对PI3K/AKT信号通路下游靶向糖原合成激酶3和葡萄糖转运体4的调控机制。

