鞣花酸干预膜性肾病大鼠模型的实验研究*
周翔 刘志文 成平 张三勇 许向青 姜文玲 唐程远 贺理宇
(中南大学湘雅二医院肾内科·肾脏疾病与血液净化学湖南省重点实验室,湖南 长沙 410011)
膜性肾病(Membranous nephropathy,MN)是一种免疫复合物沉积于肾小球基底膜并伴基底膜增厚等病理改变为特征的肾小球疾病[1-2],根据病因分类,大约有五分之四的患者无明确病因称之为特发性膜性肾病(Idiopathic membranous nephropathy,IMN),另外20%的MN常常继发于其他疾病,如系统性红斑狼疮、血管炎、类风湿性关节炎、乙型病毒性肝炎等,称之为继发性膜性肾病。此外,药物、毒物、肿瘤或环境因素等也可以引起继发性膜性肾病[3]。鞣花酸(Ellagic acid,EA)是一种存在于各种软质水果、坚果和其他植物组织中的天然多酚,有研究[4-5]证实,EA在溃疡性结肠炎、结肠癌等多种疾病中具有抗氧化和抗炎等作用。在肾脏疾病中,亦有研究[6]报道,EA可以通过抑制肾组织氧化应激而对STZ诱导的糖尿病大鼠发挥肾脏保护作用。哺乳动物不育系20样激酶(Mammalian sterile 20-like kinase 1,MST1)基因是Hippo信号通路中的关键基因[7],核因子E2相关因子2(NF-E2-related factor 2,Nrf2)是一种重要的细胞抗氧化转录因子[8]。且已有文献[9]报道,Mst1-Nrf2通路可以调控机体的氧化应激,既往采用丙二醛(Malondialdehyde,MDA)、还原型谷胱甘肽(Reduced glutathione,GSH)和过氧化酶(Catalase,CAT)这3个比较公认的机体抗氧化能力作为监测指标的研究[10]提示,EA可能通过Mst1- Nrf2通路抑制炎症反应和氧化应激从而缓解阿霉素诱导的大鼠局灶节段性肾小球硬化。EA是否可通过Mst1- Nrf2通路改善MN的肾脏损伤尚少文献报道。通过尾静脉注射阳离子化牛血清白蛋白(Cationic bovine serum albumin,C-BSA)构建的MN大鼠模型是应用广泛且成熟的动物模型之一[11-12],本研究中利用此模型来评估EA在MN干预治疗中可能的作用和机制,以期为临床MN的治疗提供新思路。
1 资料与方法
1.1 实验动物 SD大鼠(SPF级、8周龄)购自于湖南斯莱克景达公司,在保证正常饮食饮水、昼夜规律等适宜其生长的常规环境中饲养。实验动物的饲养和处理均遵循医院医学实验动物伦理委员会的规范和条例。
1.2 主要试剂及仪器 鞣花酸购自于美国Sigma公司;C-BSA购自于美国Chondrex公司;GSH-PX测试盒、GSH检测试剂盒、MDA检测试剂盒和CAT检测试剂盒购自于南京建成生物公司;HE染色液、苏木素分色液、多聚甲醛等购自于武汉塞维尔生物公司;cDNA 合成试剂盒、SYBR green QPCR扩增试剂盒购自于TaKaRa公司。使用的主要仪器包括美国Roche公司生产的实时荧光定量PCR仪、美国赛默飞公司生产的NanoDrop 2000 分光光度计、美国MD公司生产的多功能酶标仪、重庆博士泰生产的全自动特定蛋白分析仪、德国徕卡公司生产的荧光显微镜及石蜡切片机等。
1.3 方法
1.3.1 膜性肾病大鼠模型的构建、药物干预及标本处理 将刚购置的大鼠随机分为对照组、模型组、实验组,实验组和模型组各8只,对照组6只。MN大鼠模型制备过程如下:①预免疫处理:将1 mg C-BSA与0.5 mL磷酸盐缓冲液(PBS)和等量弗氏不完全佐剂充分震荡,得到混合液体。之后每次将0.1 mL混合液体注射于模型组和实验组大鼠的腹股沟、腋下等皮下部位,隔日一次,共注射3次,对照组不注射C-BSA,其余处理同模型组。②正式免疫处理:将2.5 mg C-BSA与1 mL的PBS充分混匀得到混合液体,实验组和模型组大鼠注射0.5 mL混合液体,对照组大鼠单纯注射同剂量PBS。都通过大鼠尾静脉注射,且注射频率为连续4周、每周3次。4周后通过特定蛋白分析仪测定的各组大鼠24 h尿蛋白定量结果,若模型组结果大于20 mg/L则考虑构建成功。③药物干预:造模成功后,实验组按200 mg/kg体重腹腔注入鞣花酸,注射频率为每日一次、持续4周,模型组注入等体积生理盐水。④四周后各组大鼠行异氟烷麻醉后处死,收集24 h尿液,常温下2000 rpm、离心10 min,取上清液-80℃冻存。通过腹主动脉收集血液,常温下4000 rpm、离心10 min,取上层血清-80℃冻存。摘取肾脏标本剪成小块后分为两份,一份用多聚甲醛固定后,石蜡包埋;其余分装后-80℃冻存。
1.3.2 生化指标检测方法 ①利用全自动生化仪测定血清胆固醇(Cholesterol,CHO)、血肌酐(Scr)、尿素氮(BUN)、白蛋白(Alb)。②利用重庆博士泰全自动特定蛋白分析仪检测尿总蛋白(Urinary total protein n,UTP)、尿白蛋白(Urinary albumin,Ualb)、尿1-MG、尿2-MG、尿NAG、尿NGAL和尿RBP等。③采用TBA法按试剂盒说明书步骤测定肾组织中MDA。④采用DTNB法按试剂盒说明书步骤测定肾组织中GSH。⑤采用钼酸铵法按试剂盒说明书步骤测定肾组织中CAT的活性。
1.3.3 石蜡切片的免疫 荧光肾组织石蜡包埋后切片,按常规免疫组化操作顺序脱蜡、水化、封闭、加抗体、封片等步骤后,使用荧光显微镜观察。
1.3.4 实时荧光定量PCR 肾组织用Trizol处理后提取总RNA并测定RNA浓度,再用常规PCR仪反转录为cDNA,再根据试剂说明书流程采用RT-PCR检测,使用Roche专业软件进行相对定量法分析。
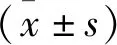
2 结果
2.1 鞣花酸对C-BSA诱导的大鼠膜性肾病模型常用临床指标的改善作用 分别检测3组大鼠模型的Scr、BUN、Alb、24 h UTP、CHO和肾小管性尿蛋白各指标水平(α1-MG、β2-MG、RPB、NAG和NGAL)。与对照组相比,模型组大鼠的Scr、BUN、Alb、24 h UTP及CHO水平均明显恶化加重(P<0.05)。但当使用了鞣花酸干预后,与模型组大鼠相比,实验组大鼠各项指标均显著好转(P<0.05)(见表1)。对于肾小管性尿蛋白,与对照组相比,模型组大鼠的尿α1-MG、尿β2-MG、尿RBP、尿NAG和尿NGAL水平均明显升高(P<0.05),但当使用了鞣花酸干预后,与模型组相比,实验组大鼠各项指标均明显下降(P<0.05)。见表2。

表1 3组大鼠模型血肌酐、尿素氮、血清白蛋白、24 h尿总蛋白和血胆固醇检测结果Table 1 Results of serum creatinine,blood urea nitrogen,serum albumin,24-hour urine protein and blood cholesterol in rat models of the three groups

表2 3组大鼠模型肾小管性尿蛋白检测结果Table 2 Results of renal tubular urinary protein in rat models of the three groups
2.2 鞣花酸缓解C-BSA诱导的大鼠膜性肾病的肾脏病理损伤 各组采用HE染色和IgG免疫荧光检测来衡量其病理损伤程度。结果显示,对照组大鼠肾脏组织中肾小球和肾小管结构完整清晰,免疫荧光染色IgG沉积较少;模型组大鼠肾小球体积明显增大,部分肾小管萎缩消失;免疫荧光染色示IgG沿系膜区及毛细血管壁呈颗粒样沉积。但当使用了鞣花酸干预后,上述病理损伤明显减轻。见图1。
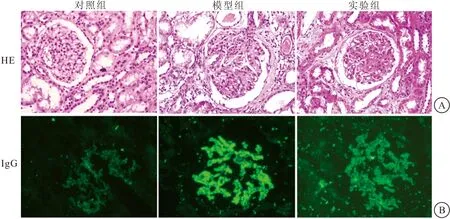
图1 鞣花酸缓解C-BSA诱导的大鼠膜性肾病的肾脏病理损伤(400×)Figure 1 Ellagic acid alleviates renal pathological damage induced by C-BSA in rats with MN注:A.HE染色;B.IgG的免疫荧光
2.3 鞣花酸缓解C-BSA诱导的大鼠膜性肾病的氧化应激 模型组MDA含量明显高于对照组(P<0.05),实验组MDA水平较模型组明显降低(P<0.05)。与对照组相比,模型组的GSH和CAT的水平均显著降低,抗氧化能力减弱(均P<0.05),而在使用了鞣花酸干预后,GSH和CAT的水平均显著上调(P<0.05)。说明使用鞣花酸干预后可以显著提升C-BSA诱导的大鼠膜性肾病的抗氧化能力。见表3。

表3 3组大鼠模型血清丙二醛、谷胱甘肽和过氧化氢酶检测结果Table 3 Results of serum malondialdehyde,glutathione and catalase in rat models of the three groups
2.4 鞣花酸可抑制Mst1的表达,促进Nrf2的表达 与对照组比较,模型组Mst1 mRNA表达升高,Nrf2 mRNA表达下降(均P<0.05),但当使用了鞣花酸干预后,与模型组相比,Mst1 mRNA表达下降,Nrf2 mRNA表达升高(均P<0.05)。同时,通过蛋白免疫印迹也进一步确定鞣花酸治疗可以抑制MN大鼠MST1蛋白表达、促进NRF2蛋白表达(P<0.05)。提示鞣花酸可能通过Mst1-Nrf2通路对C-BSA诱导的MN大鼠发挥肾脏保护作用。见图2。
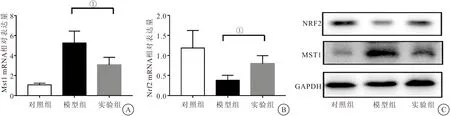
图2 鞣花酸可抑制Mst1的表达,促进Nrf2的表达(n=4)Figure 2 Ellagic acid inhibited the expression of Mst1 and promoted the expression of Nrf2注:A.RT-PCR检测Mst1 mRNA的表达;B.RT-PCR检测Nrf2 mRNA的表达;C.蛋白免疫印迹检测MST1和NRF2蛋白的表达。GAPDH作为内对照。与模型组比较,①P<0.05
2.5 Mst1和 Nrf2 mRNA表达与MN大鼠肾脏氧化应激指标的相关性分析 为进一步明确Mst1 和 Nrf2 mRNA表达与MN大鼠肾脏氧化应激的相关性,分别分析了MN大鼠Mst1和 Nrf2 mRNA表达与氧化应激指标MDA、GSH和CAT的相关性。Spearman's相关分析显示,Mst1 mRNA表达与MDA呈正相关(r=0.7539 )(见图3A),与GSH和CAT呈负相关(r=-0.9117和r=-0.8478)(见图3B、图3C)。Nrf2 mRNA表达与MDA呈负相关(r=-0.7267)(见图3D),与GSH和CAT呈正相关(r=0.8012和r=0.7423)(见图3E、图3F)。结果提示Mst1和Nrf2参与调控了C-BSA诱导的MN大鼠的氧化应激。
图3 Mst1和 Nrf2 mRNA表达与MN大鼠肾脏氧化应激指标的相关性分析Figure 3 Correlation analysis of Mst1 and Nrf2 mRNA expression and renal oxidative stress index in MN rats注:A~C.Mst1 mNA表达与氧化应激指标MDA、GSH和CAT的相关性分析 ;D~F.Nrf2 mRNA表达与氧化应激指标MDA、GSH和CAT的相关性分析
3 讨论
膜性肾病临床通常伴随有大量蛋白尿,其他表现为没有症状或不是肾脏疾病引起的蛋白尿[13-14]。目前在临床上IMN的治疗十分困难,预后不佳,因此,找到一个切实可行的治疗方案具有十分重要的意义[15]。尽管关于IMN的发病机制截至目前也没有被完全阐明,但既往已有研究证实氧化应激在IMN的进程中有重要价值[16-17]。有研究[18]证实,Mst1缺乏可以减轻细胞氧化应激,Nrf2基因激活后能够抑制线粒体活性氧(ROS)和炎症因子的产生[19],所以Mst1-Nrf2通路参与了细胞氧化应激和炎症反应等多种生物学反应[20]。尽管目前关于Mst1-Nrf2通路介导的抗氧化作用的研究得到了很大的进展,但关于Mst-Nrf2通路在膜性肾病中的作用尚不明确。
鞣花酸是植物天然多酚化合物,已有研究[21-23]证实,EA在多种疾病中具有抗氧化和抗炎等作用。在肾脏疾病中,有文献[6]报道,鞣花酸可以通过抑制肾组织氧化应激而对STZ诱导的糖尿病大鼠发挥肾脏保护作用。既往研究[10]也提示鞣花酸可能通过Mst1- Nrf2通路抑制炎症反应和氧化应激从而缓解阿霉素诱导的大鼠局灶节段性肾小球硬化。那么EA是否可通过Mst1- Nrf2通路抑制氧化应激和炎症反应而改善MN的肾脏损伤尚未有研究证实。
在本研究中,采用了应用广泛且成熟的膜性肾病大鼠模型[11-12],待模型构建成功后,通过鞣花酸的干预进而分析鞣花酸MN大鼠的治疗作用。结果发现与膜性肾病大鼠组相比,鞣花酸干预组的Scr、BUN、Alb、总蛋白定量、CHO和肾小管性尿蛋白各组分均显著好转。同时,通过免疫荧光检测等也发现通过鞣花酸的干预治疗对减轻膜性肾病大鼠的肾脏病理损伤作用明显。此外,实验组肾组织GSH和CAT的水平均显著上调,而MDA水平降低,说明使用鞣花酸干预后可以显著提升C-BSA诱导的大鼠膜性肾病的抗氧化能力。在机制上分析,与模型组相比,发现实验组大鼠Mst1 mRNA表达下降,Nrf2 mRNA表达增加,提示鞣花酸可能通过Mst1-Nrf2通路对膜性肾病大鼠发挥肾脏保护作用。但是本实验研究仅仅检测了Mst1和Nrf2的转录水平变化,关于鞣花酸是否真正通过Mst1-Nrf2通路而发挥肾脏保护作用尚需进一步的研究。
4 结论
本研究结果提示,鞣花酸可能通过Mst1-Nrf2通路减轻肾组织的氧化应激从而缓解C-BSA诱导的膜性肾病大鼠的肾脏病变,在膜性肾病的防治中具备潜在临床运用价值,但其具体的作用机制仍需进一步深入研究。

