LncRNA H19通过调节miR-let7/MMP-9分子轴促进滋养细胞侵袭及迁移*
刘明嫦,刘师玚,马 敬**
(1.昆明医科大学第一附属医院,昆明 650031;2.云南省妇幼保健院,昆明 650051)
妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)是以血压升高(收缩压≥140mmHg,舒张压≥90mmHg),不出现(妊娠期高血压)或出现(子痫前期)蛋白尿(大于0.3g/24h)为特征的一组妊娠期特发的临床综合征。HDP可继发母亲高血压脑病、脑出血、心力衰竭、肾功能衰竭、多器官功能衰竭,导致胎儿宫内发育迟缓、胎儿脐血流异常、慢性胎儿宫内窘迫,是医源性早产的主要原因。HDP治疗极为棘手,发病机制复杂,目前病因尚未完全阐明。既往研究认为,在母胎循环建立的过程中,绒毛外滋养细胞侵袭能力受损,造成“胎盘浅着床”和子宫螺旋动脉重塑障碍,是HDP发病的一个重要的原因[1]。深入研究绒毛外滋养细胞侵袭能力,可为临床早期发现、治疗HDP提供理论依据。
人类H19基因的转录产物是一种lncRNA,在人早期胎盘组织中丰富表达,生后常消失。LncRNA H19作为分子海绵吸附并抑制miRNA与靶基因的结合,促进肿瘤细胞的侵袭[2]。胎盘的种植过程类似于肿瘤的侵袭过程,胎盘中lncRNAs差异性表达与子痫前期(preeclampsia,PE)发病有关。但lncRNA H19在HDP中的表达情况存有争议。既往研究报道,HDP胎盘组织中H19表达水平明显低于正常胎盘[3]。最近有报道,PE孕妇妊娠早期血液中H19表达水平显著上调[4]。本研究旨在明确H19在HDP胎盘中的表达情况,并进一步探讨H19参与HDP发病的具体机制。
miRNA能与mRNA的3'非翻译区结合,通过调节mRNA稳定性和抑制翻译控制基因表达,进而参与肿瘤的发生[7]。目前关于miR-let7e-5p在HDP发病中具体作用机制的研究较少。PE孕妇的miR-let7表达水平发生了改变,但不同亚型报道的结果不一致。研究发现,miR-let7a及miR-let7g在重度子痫前期(severe pre-eclampsia,sPE)中明显升高[5]。李晓娟等[6]发现,miR-let7b-5p及miR-let7e-5p在sPE胎盘中表达减少。本课题组前期研究发现,H19基因内包含有miR-let7的多个结合位点[7],预测H19可能通过吸附miR-let7调控下游靶基因,进而参与HDP的发病。
基质金属蛋白酶(matrix metalloproteinase,MMPs)在肿瘤侵袭转移中起作用,参与滋养细胞侵入子宫蜕膜和肌层及子宫螺旋动脉的重塑过程[8]。MMP-9表达水平与滋养细胞侵袭力和血管重铸水平正相关,HDP中MMP-9表达下调[9]。在脂肪来源的干细胞中,MMP-9是受miR-let7e调控的下游靶基因[10]。目前尚不清楚miR-let7是否通过调控MMP-9表达进而参与HDP的发病。
本研究通过检测HDP胎盘组织中lncRNA H19、miR-let7、MMP-9 mRNA、MMP-9蛋白表达,并根据临床标本检测结果进行体外细胞实验,探索HDP发病机制。
1 资料与方法
1.1 临床标本及细胞 收集2019年12月至2021年3月在昆明医科大学第一附属医院分娩的HDP孕妇86例和正常孕妇20例。86例HDP孕妇中,妊娠期高血压26例(PIH组),子痫前期29例(PE组),重度子痫前期31例(sPE组),其中早发型8例、晚发型23例。分娩时收集胎盘组织,剪成约1cm×1cm×1cm大两块,一块置-80℃冰箱冻存备检,另一块放入10%福尔马林溶液固定24h后石蜡包埋。HTR8/Svneo细胞株购自武汉普诺赛,传代并保存于昆明医科大学科研实验中心。本研究经医院伦理委员会同意,孕产妇均签署知情同意书。根据临床标本实验结果,从miR-let7b-5p和miR-let7e-5p两者中,筛选出与疾病发展相关且与lncRNA H19负相关性更强的miRNA,进行后续研究探索其作用机制。
1.2 主要试剂 1640培养基(gibco 126 31200-022,美国)、10% 胎牛血清(FBS)(gibco 10099-141,America)和青霉素-链霉素(100U/mL,1∶1)(gibco 1902417,America)混合物培养人滋养层细胞HTR-8/SVneo。细胞在37℃、5% CO2培养箱中培养。H19过表达质粒(pexH19)、空质粒购自汉恒生物,siH19和siCon购自锐博公司。
1.3 实验方法
1.3.1 细胞转染 将HTR/SVneo细胞分组:对照组(NC组),转染空质粒组(NC+empty质粒),转染siH19敲低H19组(siH19组),用过表达H19质粒转染过表达H19组(NC+pEX-H19组),用miR-let7e-5p模拟物和含H19的质粒转染滋养细胞(pEX-H19+let-7e组)。siRNA和miRNA转染按riboFECTTMCP转染试剂盒说明书进行。转染质粒DNA按lipofectamineTM3000试剂盒(质粒浓度2500ng/孔)说明书进行。转染后48h,收集细胞用于进一步实验。
1.3.2 细胞活性测定 使用细胞计数试剂盒8(CCK-8,同仁化学,日本)测定。将HTR-8/SVneo细胞接种到96孔板(1500细胞/孔),在1640培养基置37℃、5% CO2培养箱培养24h。HTR-8/SVneo细胞转染48h,将CCK-8试剂(10μL/孔)加入细胞,置37℃和5%CO2培养箱孵育2h。使用酶标仪检测450nm处吸光度。
1.3.3 细胞划痕试验 将细胞浓度调整为2.5×104/mL,并接种到Ibidi插件的左右孔中。培养细胞,直至细胞达到95%融合,用PBS液洗涤细胞,拔除Ibidi插件后0、24h在倒置显微镜下观察划痕宽度并拍照。
1.3.4 Transwell试验 用24孔板进行。每个孔板使用Matrige基质胶(50μL/孔,corning,356234,美国)包被。转染48h后,将细胞接种到24孔板。将1×105细胞/mL细胞悬液100μL加入上室,使用无血清培养基培养。将10%FBS培养基500μL加入下室,孵育24h。去除膜上表面的非侵入细胞和基质胶。膜下表面用4%多聚甲醛固定细胞30min,用结晶紫染色15min。使用100倍显微镜拍照,使用Image J软件进行细胞计数。
1.3.5 逆转录实时定量聚合酶链反应(RT-qPCR) 通过Trizol试剂(Lifetech,美国)从胎盘组织或滋养层细胞中提取RNA。使用FastKing RT(With gDNase) FastKing cDNA第一链合成试剂盒(天根,中国)将mRNA逆转录为cDNA。使用RiboTMmRNA /lncRNA qPCR Starter Kit(锐博,中国)检测lncRNA H19。使用Bulge-Loop miRNA RT-qPCR试剂盒检测miR-let7b-5p和miR-let7e-5p,使用Starter Kit Bulge-Loop miRNA RT-qPCR Starter Kit(锐博,中国)进行逆转录。实验方法按试剂盒说明书进行。H19和let7引物购自锐博(中国广州)。MMP-9 mRNA和GAPDH引物由Beacon Designer 7.90设计,由Invitrogen(中国广州)合成。RT-qPCR使用SYBR Green master的Cycle 96实时PCR系统(LightCycle,瑞士)完成。lncRNA和mRNA的定量通过使用GAPDH作为内参;miRNA的定量由U6作为内参。采用相对定量方法(2-△△ct)分析数据。
1.3.6 免疫组化(包含IHC)检测 人胎盘组织固定,包埋,切成4μm切片,脱水,用中性树胶封闭。经脱蜡、复水、柠檬酸缓冲液浸泡,微波10min修复抗原。3%过氧化氢孵育30min,5%山羊血清25℃封闭1h,用抗MMP-9(abcam)抗体孵育过夜。山羊抗兔二抗与切片25℃孵育1h。用PBST洗涤,DAB溶液处理。用显微镜观察和成像人胎盘中MMP-9蛋白表达。使用Image J用于测量图像的灰度。

2 结 果
2.1 临床特征 进行年龄、分娩前体质量指数(body mass index,BMI)匹配后,PIH组、PE组、sPE组的收缩压、舒张压均高于正常妊娠组(P<0.001);早发型、晚发型sPE组的新生儿出生体重均显著低于正常组(P<0.001,P<0.05);早发型、晚发型sPE组的分娩孕周显著低于正常妊娠组(P<0.001,P<0.05)。见表1。
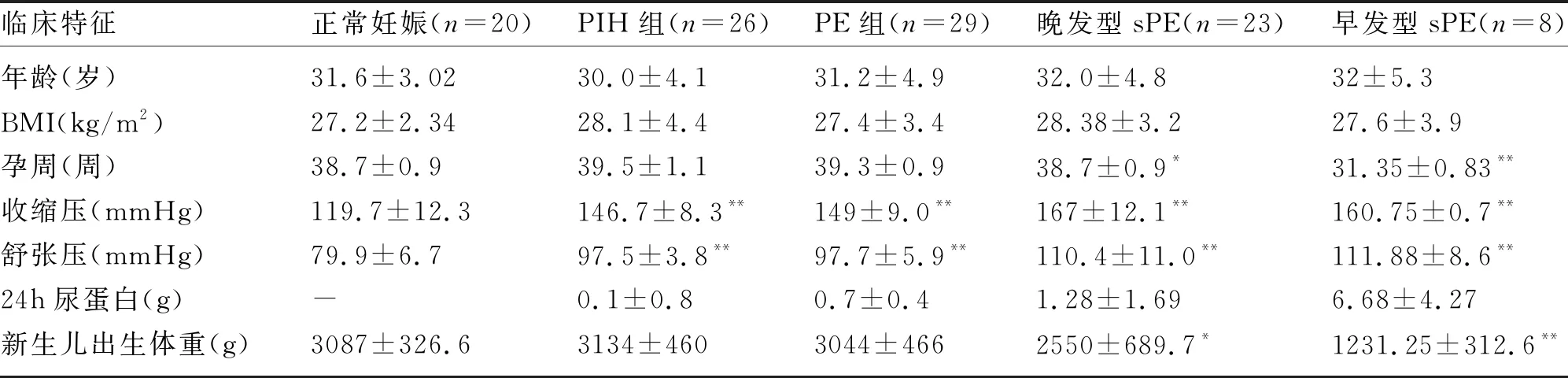
表1 各组患者临床特征
2.2 免疫组化检测HDP患者胎盘组织中MMP-9蛋白表达 免疫组化结果显示,MMP-9蛋白在合体滋养细胞的细胞膜、细胞外基质中表达;MMP-9蛋白在中性粒细胞膜上表达;PIH、PE、sPE胎盘中滋养细胞数减少,MMP-9阳性细胞少,坏死增多,出现较多中性粒细胞。PIH胎盘组织中MMP-9蛋白表达明显低于正常组,且PE及sPE组均显著低于PIH组。见图1、2。
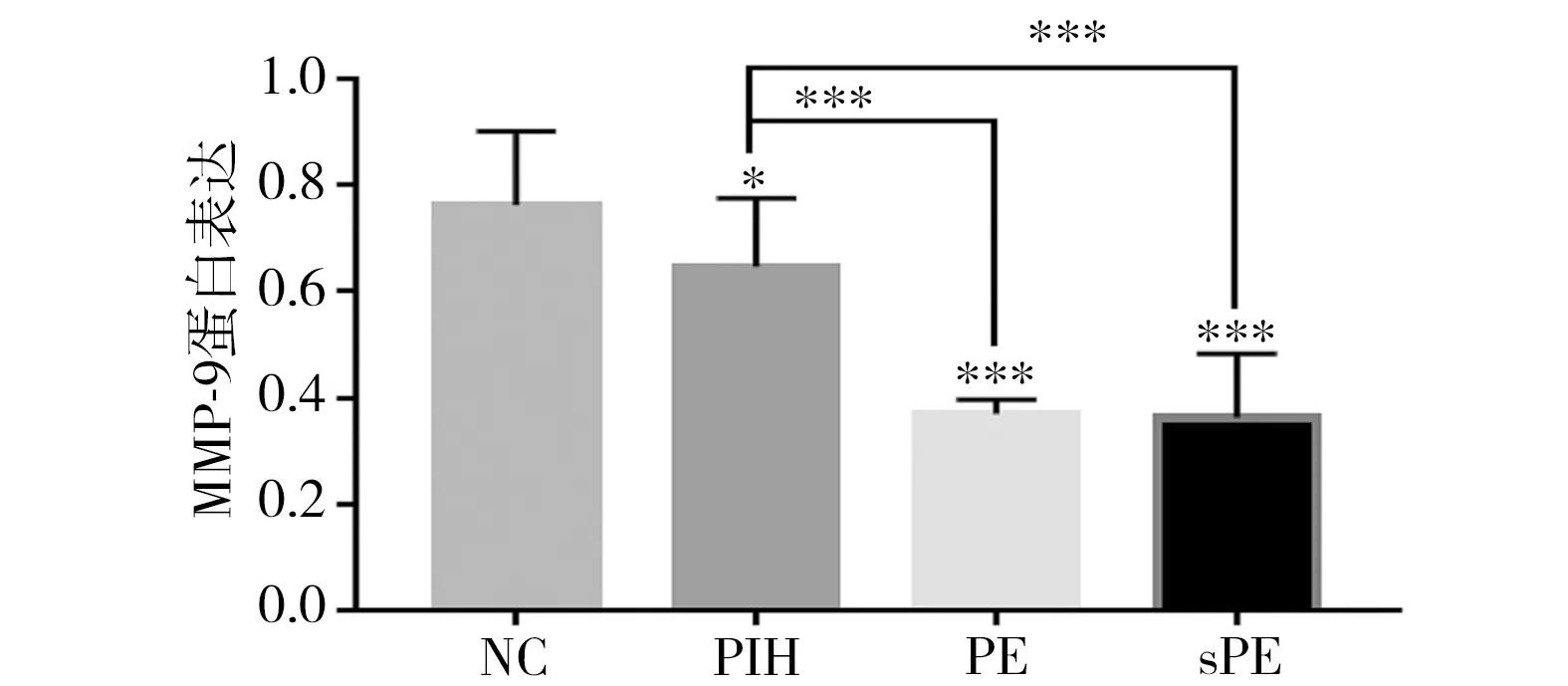
图1 PIH、PE和sPE患者胎盘组织中MMP-9蛋白表达比较
图2 免疫组化法检测MMP-9蛋白在PIH、PE和sPE胎盘中的表达(×400)
2.3 RT-qPCR检测HDP胎盘中lncRNA H19、miR-let7、MMP-9表达 与正常妊娠组比较,HDP患者中lncRNA H19表达水平显著升高,miR-let7b-5p、miR-let7e-5p水平显著降低,差异均有统计学意义(P<0.05)。与正常妊娠组比较,PIH和sPE组胎盘组织中MMP-9 mRNA表达降低,差异有统计学意义(P<0.05)。早发型和晚发型sPE患者的lncRNA H19、miR-let7e-5p表达比较,差异无统计学意义(P>0.05),早发型sPE中miR-let7b-5p、MMP-9表达低于晚发型sPE,差异有统计学意义(P<0.05)。Pearson相关性显示,lncRNA H19与miR-let7e-5p、MMP-9 mRNA均呈负相关(r=-0.54,P<0.01;r=-0.229,P<0.05),见图3。
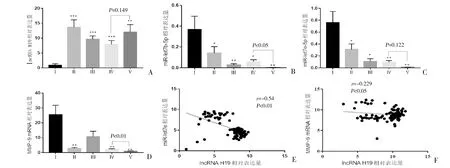
图3 胎盘组织中lncRNAH19、miR-let7b-5p、miR-let7e-5p和MMP-9 mRNA表达
2.4 lncRNA H19对滋养细胞侵袭力、迁移力及细胞活力的影响 在HTR/SVneo细胞中,过表达H19后,滋养细胞的穿膜细胞数、滋养细胞迁移率及细胞活力均增强;敲减H19后,滋养细胞的穿膜细胞数、滋养细胞迁移率及细胞活力均减弱。表明lncRNA H19促进了滋养细胞的侵袭力、迁移力及细胞活力。过表达H19与miR-let7e-5p mimics共转染后,lncRNA H19对滋养细胞的侵袭力、迁移力及细胞活力的促进作用被逆转,表明人滋养细胞中lncRNA H19抑制miR-let7e-5p表达、上调MMP-9表达,进而促进滋养细胞的侵袭力、迁移力并增强细胞活力。见图4。
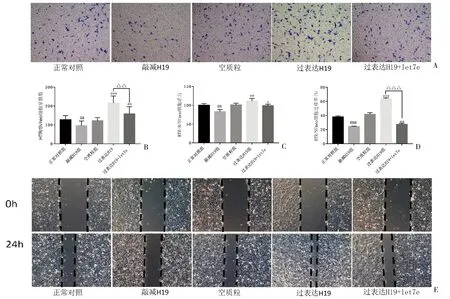
图4 细胞的侵袭力、细胞活力及迁移力
2.5 HTR/SVneo细胞中H19、miR-let7b-5p、miR-let7e-5p、MMP-9 mRNA表达 在HTR/SVneo细胞中过表达H19后,miR-let7e-5p表达下降,lncRNA H19及MMP-9 mRNA表达增加;敲减H19后,miR-let7e-5p表达增加,lncRNA H19及MMP-9 mRNA表达减少。表明lncRNA H19抑制miR-let7e-5p表达,促进MMP-9表达。过表达H19与miR-let7e-5p mimics共转染后,lncRNA H19表达量高于pEX-H19组,MMP-9 mRNA表达低于pEX-H19组。表明miR-let7e-5p增加反向促进了H19表达增加,LncRNA H19与miR-let7e-5p之间为内源性竞争性RNA;lncRNA H19对MMP-9 mRNA的促进作用受miR-let7e-5p影响,miR-let7e-5p可能抑制MMP-9 mRNA表达。见图5。
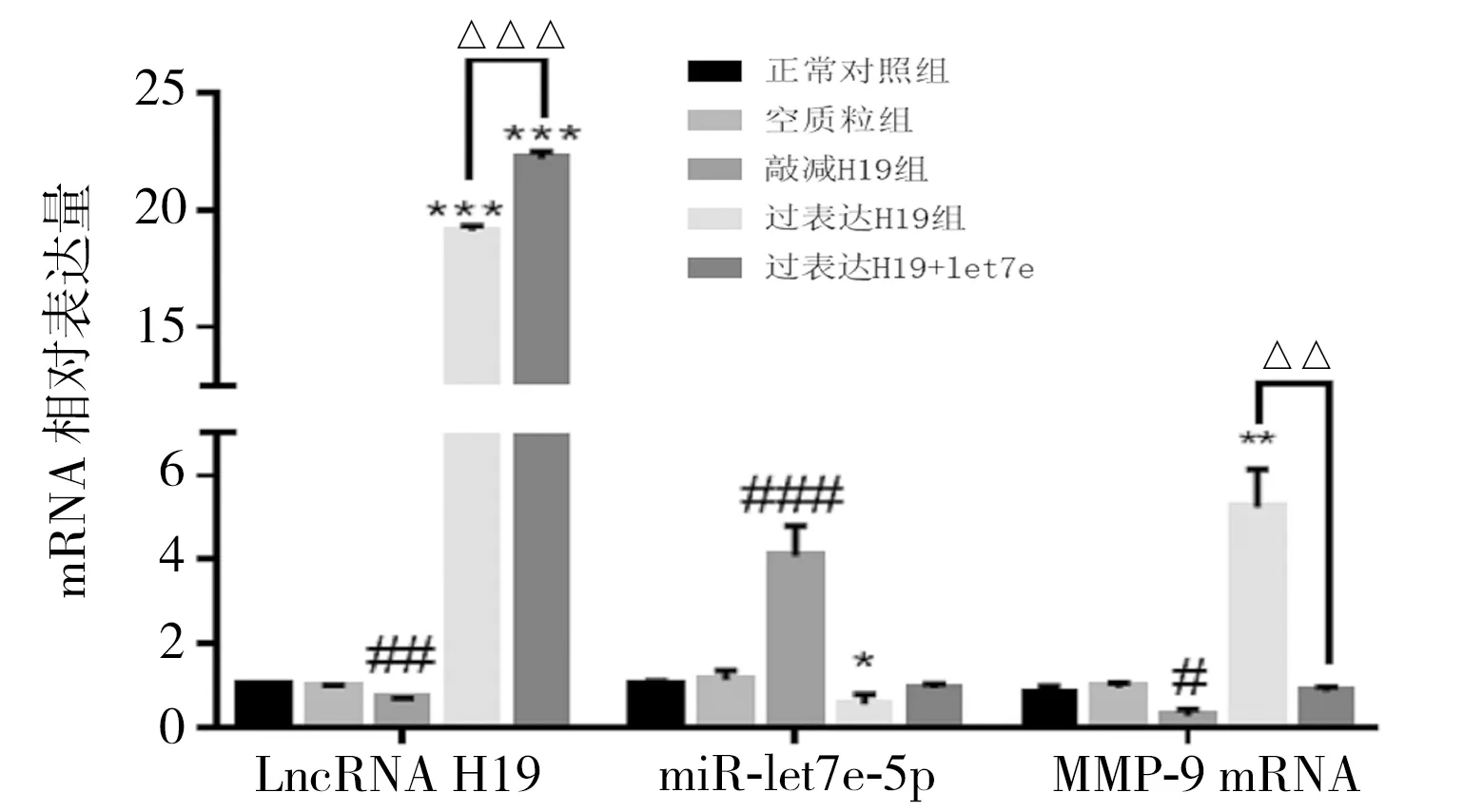
图5 滋养细胞中H19、miR-let7e-5p、MMP-9 mRNA表达
3 讨 论
PIH及PE与胎盘滋养细胞植入异常有关[11],在人类胎盘形成早期,H19呈双等位基因表达;10周后,H19仅在母系表达,父系沉默[12]。目前关于lncRNA H19参与HDP发病的机制还不清楚。本研究发现,PIH及PE胎盘组织中lncRNAH19均表达升高,lncRNA H19具有促进滋养细胞的侵袭力、迁移力和细胞活力的作用,表明lncRNA H19表达可能通过影响滋养细胞的功能参与HDP发病。
既往研究发现,H19基因上存在多个miR-let7的靶点。本研究发现,PIH、PE、sPE胎盘组织中miR-let7b-5p及miR-let7e-5p均表达降低,尤以早发型sPE胎盘中miR-let7b-5p表达最低,miR-let7e具有抑制滋养细胞的侵袭力、迁移力和细胞活力的作用,提示miR-let7差异性表达可能与HDP发病相关,并且与疾病的严重程度有关。
MMP-9是溶解细胞外基质的蛋白酶,是滋养层侵袭能力的代表分子[13]。本研究发现,在PIH及sPE胎盘中,MMP-9 mRNA均表达下降,尤以早发型sPE胎盘中下降最显著。此外,MMP-9蛋白在PIH、PE及sPE胎盘组织中表达下降。值得注意的是,PE胎盘中MMP-9 mRNA表达与正常组无明显差异,但MMP-9蛋白表达明显下降,表明MMP-9 mRNA可能在转录后水平受到损伤。滋养细胞中MMP-9表达受到lncRNA H19的促进,进而增强滋养细胞的侵袭、迁移和细胞活力;miR-let7e-5p抑制MMP-9表达,提示MMP-9 mRNA可能是miR-let7e-5p的下游靶基因。综上,滋养细胞中MMP-9表达可能在转录或转录后水平被破坏,并参与PIH及PE的发病,且因病情程度不同呈动态变化。
绒毛外滋养细胞侵袭能力差导致螺旋动脉重构不足,从而导致PE。H19促进了绒毛外滋养细胞系HTR-8/SVneo的侵袭、迁移和细胞活力,但结果显示lncRNA H19在HDP胎盘中表达上调。HTR-8/SVneo是一种来源于早孕期人类滋养细胞的细胞系。本实验通过敲减H19导致HTR-8/SVneo细胞侵袭能力下降,模拟了PIH及PE胎盘早期变化。结果显示,MMP-9 mRNA表达下调,滋养层侵袭能力减弱。但孕晚期胎盘中H19与MMP-9 mRNA表达呈轻度负相关,提示存在人体负反馈调节作用,即低水平MMP-9 mRNA可能重新激活H19表达。因而在PE胎盘中,lncRNA H19的上调促进了MMP-9 mRNA的表达,使其与正常组的表达无明显差异。但在sPE胎盘中,尤其是早发型sPE,胎盘代偿能力严重下降甚至消失,MMP-9 mRNA降至最低水平。本研究发现,H19在HDP中上调可能是HDP胎盘代偿的表现。
本研究发现,H19与let-7e共表达时,miR-let7e-5p对lncRNA H19存在一定的正反馈作用。可能是因miR-let7e-5p具有抑制滋养细胞的侵袭力、迁移力及细胞活力的作用,转染miR-let7e-5p进入滋养细胞后,细胞发生“自救”,上调lncRNA H19表达,以对抗miR-let7e-5p对细胞的“损伤”,但具体机制有待进一步研究。
综上所述,在胎盘形成早期,滋养细胞H19表达下调,MMP-9表达下调,侵袭力下降,胎盘浅着床,导致HDP发病。疾病进展过程中,低水平MMP-9负反馈激活lncRNA H19表达,通过抑制miR-let7,进而促进MMP-9表达,影响滋养细胞的侵袭力、迁移力及细胞活力,从而影响HDP病程进展。本研究将为探索HDP的早期预测、早期诊断和治疗提供理论依据。

